干扰ZEB1表达对结直肠癌细胞上皮间质转化与增殖、凋亡与迁移的影响
2019-12-04钟轩王红钰蒋涛马鹏程张超郑宝军刘金凤
钟轩 王红钰 蒋涛 马鹏程 张超 郑宝军 刘金凤
开滦总医院 1普外科,3急诊科(河北唐山063000);2唐山市工人医院肿瘤外科(河北唐山063000)
结直肠癌(CRC)是最常见的高发消化道肿瘤之一,多发于男性[1],并且发病率呈逐渐上升趋势,目前主要采用手术结合放化疗的综合治疗方式,虽然取得了一定的治疗效果并改善了患者生存质量,但却未从根本上改善结直肠癌患者的预后,特别是中晚期发生肝转移及肺转移患者的5年生存率仍未得到明显提高[2-3]。影响患者生存率的主要原因为肿瘤细胞过度增殖与转移,因此抑制肿瘤的生长、转移,促进其凋亡可降低病死率[4-5]。因此,探讨结直肠癌无限增殖及转移相关的分子与分子机制具有重要的理论价值与临床意义,可进一步阐明结直肠癌的恶性特征并制定更为有效的靶向治疗方案。
近年来的研究表明,结直肠癌细胞上皮间质转化的发生是肿瘤细胞扩散转移的重要分子机制[6-7],其中,转录抑制因子ZEB1 在该过程中发挥了重要的调节作用[8]。ZEB1 又称锌指E 盒结合蛋白1,为锌指E 盒结合蛋白(ZEB)家族成员之一,其可能在胚胎发育及创伤愈合等过程中起作用[9]。随着近年来研究的深入,检测到ZEB1 在人体内多种肿瘤中发挥着重要作用,如在乳腺癌、胃癌、肝癌、前列腺癌等肿瘤中ZEB1 的表达增高[10-13]。虽然目前关于ZEB1 的研究有所进展,但是ZEB1 调控肿瘤细胞扩散转移的具体分子机制尚未完全明确,有关ZEB1 在结直肠癌发生发展、浸润转移过程中作用的研究尚且不多。前期临床研究发现ZEB1 在人结直肠癌组织中呈高表达,且在结直肠癌Ⅲ+Ⅳ期(88.9%、91.7%)的表达明显高于结直肠癌Ⅰ+Ⅱ期[14],提示ZEB1 与结直肠癌的远处扩散、转移密切相关。故本实验进一步观察干扰ZEB1表达对体外结直肠癌细胞上皮间质转化与增殖、凋亡与迁移的影响。
1 材料与方法
1.1 材料
1.1.1 细胞人结直肠癌细胞HT29、LOVO、SW480 购买于上海信裕生物工程有限公司;人正常结直肠上皮细胞FHC 购买于上海冠导生物工程有限公司。
1.1.2 主要试剂慢病毒pPLK-ZEB1-shRNA、pPLK-control-shRNA 由上海生工生物工程技术有限公司设计并合成;RPMI-1640 培养基(CS-0013-0026,上海莼试生物技术有限公司);胎牛血清(10270106,广州威佳科技有限公司);McCoy′s 5A培养基(PM150710,武汉普诺赛生命科技有限公司);L-15 培养基(L1518,Sigma);RT-PCR 试剂(上海冠导生物工程有限公司);E-cadherin、Vimentin、Twist、GAPDH 抗体(美国CST 公司);PCR 反应试剂盒(PR2101,北京百泰克生物技术有限公司)。
1.1.3 主要仪器荧光显微镜(DFM-60C,上海蔡康光学仪器有限公司);酶标仪(HBS-1096A,南京德铁实验设备有限公司);倒置显微镜(BLD-220,北京世纪科信科学仪器有限公司);96 孔板、6 孔板(无锡国盛生物);流式细胞仪(BD FACSCalibur,美国BD)。
1.2 方法1.2.1 细胞培养将人结直肠癌细胞SW480 在含体积分数10%胎牛血清的L-15 培养基内培养;人结直肠癌细胞HT29 在含体积分数10%胎牛血清的McCoy′s 5A 培养基内培养;人结直肠癌细胞LOVO 在含体积分数10%胎牛血清的RPMI-1640培养基内培养;人正常结直肠上皮细胞FHC 在含体积分数10%胎牛血清、1%青链霉素的RPMI-1640 培养基内培养。4 种细胞的培养环境:37 ℃、5%CO2与95%湿度的恒温培养箱中。每2 ~3 天换液1 次,观察细胞生长融合至85%左右时进行传代培养,取处于对数生长期的细胞用于实验。RT-PCR 检测4 种细胞中ZEB1 基因表达,筛选ZEB1 基因表达最高的细胞进行转染实验。
1.2.2 干扰ZEB1 表达取对数生长期的LOVO细胞,以2 × 105/孔的细胞密度接种于6 孔板内,置于37 ℃、5%CO2的饱和湿度培养箱内,第2 天进行瞬时转染:干扰组转染慢病毒pPLK-ZEB1-shRNA,干扰对照组转染慢病毒pPLK-control-shRNA,每组3 复孔,shRNA 的终浓度为100 nmol/L,严格依照慢病毒感染说明书操作。转染48 h后,荧光显微镜及RT-PCR、Western Blot 检测检测观察转染效率。以未转染的细胞为正常对照(Control 组)。
1.2.3 MTT 检测细胞增殖转染48 h 后,将3 组细胞以4 × 103/孔的细胞密度接种于96 孔板内,每组3 复孔,置于37 ℃、5%CO2与95%湿度的恒温培养箱中,于培养的对应时间点取出培养板,加入5 g/L MTT 溶液20 μL,孵育4 h 后终止培养,加入150 μL DMSO,利用酶标仪在490 nm 处检测OD值。
1.2.4 克隆形成实验转染48 h 后,制备3 组单细胞悬液,以4 × 102/孔的细胞密度接种于6 孔板内,每组3 复孔,置于37 ℃、5%CO2与95%湿度的恒温培养箱中培养,第15 天时终止培养,PBS 清洗细胞3 次,甲醛固定15 min,结晶紫染色15 min,双蒸水洗涤后自然干燥,显微镜下计数>50 个细胞克隆数,计算克隆形成率。
1.2.5 Transwell实验转染48 h 后,制备3 组单细胞悬液,调整细胞浓度为1.5 × 105/mL,将200 μL细胞悬液接种于小室上层,将600 μL 含体积分数10%胎牛血清的完全培养基加入小室下层,37 ℃孵育4 h,取出小室上层,除去残留在小室表面的细胞,PBS清洗3次,40 g/L多聚甲醛固定,以结晶紫染色15 min,PBS 清洗后自然干燥,倒置显微镜下随机选择5 个视野,计数迁移穿膜细胞数。
1.2.6 细胞凋亡检测转染48 h 后,取3 组细胞,调整细胞浓度为4 × 105/mL 接种,消化后加入70%乙醇溶液固定1 h,PBS 清洗细胞,加入PI 进行染色重悬,利用流式细胞仪分析细胞凋亡情况。
1.2.7 RT-PCR 检测提取各组细胞总RNA,通过1%琼脂糖凝胶电泳分析RNA 的完整性。按照试剂盒说明书反转录合成cDNA,反应程序为:95 ℃,5 min;95 ℃,20 s;60 ℃,1 min;共45 个循环。ZEB1 上游引物:5′- TGC ACT GAG TGT GGA AAA GC-3′,下游引物:5′- TGG TGA TGC TGA AAG AGA CG-3′。GAPDH 上游引物:5′-CGA GAT CCC TCC AAA ATC AA-3,下游引物:5′- TTC ACA CCC ATG ACG AAC AT-3′。每个样品重复3 次实验。利用2-ΔΔCt法分析基因的相对表达量。
1.2.8 Western Blot 检测转染48 h 后,蛋白裂解液裂解各组细胞,提取总蛋白,利用BCA 蛋白定量试剂盒检测浓度,低温保存备用。将蛋白液与Loading Buffer 充分混匀,100 ℃煮10 min,分别制作分离胶与浓缩胶,按照每孔50 μg 蛋白上样,加入分离胶孔内,电泳转膜并封闭,加入一抗:ZEB1稀释1∶1 000,1E-cadherin 稀释1∶10 000,Vimentin稀释1∶7 000,Twist 稀释1∶1 000,4 ℃摇床孵育过夜;PBST 洗膜,二抗常温孵育1 h,PBST 洗膜后ECL 显色进行灰度值分析。
1.3 统计学方法采用统计学软件SPSS 21.0 进行数据分析。计量资料以均数± 标准差表示,两组间对比采用t检验,多组间对比采用方差分析,进一步两两比较采用Snk-q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 RT-PCR 检测ZEB1 基因表达ZEB1 基因在人正常结直肠上皮细胞FHC 中呈低表达,在3 种结直肠癌细胞中呈高表达,并且高侵袭性人结直肠癌细胞LOVO 中的ZEB1 基因表达高于低侵袭性的人结直肠癌结果细胞HT29、SW480,见图1。ZEB1 蛋白Western Blot 检测结果与RT-PCR 检测一致,见图2。
2.2 转染效率将ZEB1 基因沉默慢病毒pPLKZEB1-shRNA 载体感染人结直肠癌细胞LOVO,荧光显微镜下观察荧光表达情况,可见瞬时转染阳性率为(90.12 ± 4.15)%,慢病毒pPLK-control-shRNA 瞬时转染率也在90%以上(图3A),初步证实转染成功。RT-PCR 检测显示,干扰组ZEB1 基因表达明显低于干扰对照组,差异有统计学意义(P<0.05,图3B)。
2.3 MTT 检测细胞增殖于培养的第1、3、5、7 天检测细胞增殖,结果显示干扰组培养第3 ~7 天的细胞增殖OD值低于干扰对照组、正常对照组,差异有统计学意义(P<0.05);干扰对照组与正常对照组的细胞增殖OD值比较差异无统计学意义(图4)。
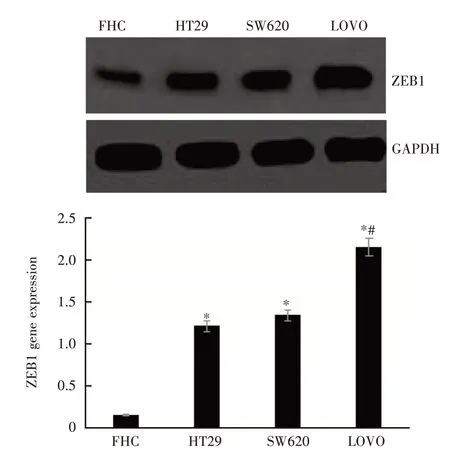
图1 RT-PCR 检测不同细胞中的ZEB1 基因表达Fig.1 Detection of ZEB1 gene expression in different cells by RT-PCR(n = 3)
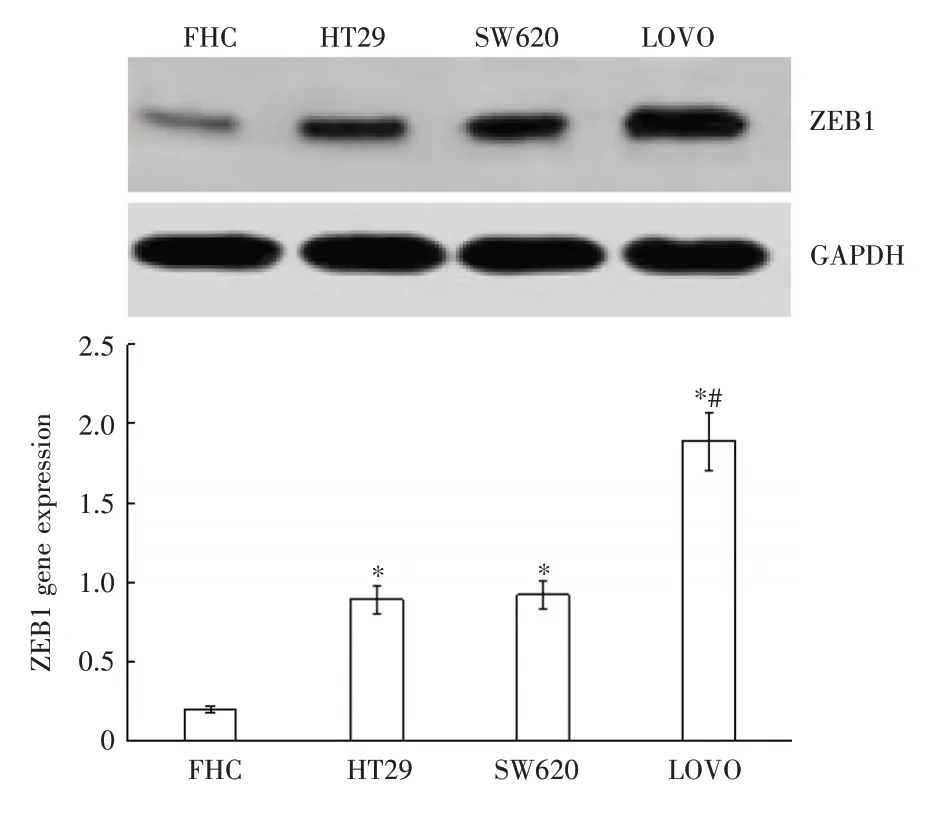
图2 Western Blot 检测不同细胞中的ZEB1 基因表达Fig.2 Western Blot detection of ZEB1 gene expression in different cells(n = 3)
2.4 克隆形成实验干扰组细胞克隆形成数目少于干扰对照组、正常对照组,差异有统计学意义(P<0.05);干扰对照组与正常对照组细胞克隆形成数目比较差异无统计学意义(图5)。
2.5 Transwell 实验干扰组、干扰对照组、正常对照组迁移穿膜细胞数目分别为(31.23 ±9.13)%、(60.32 ± 12.34)%、(62.27 ± 10.55)%,干扰组迁移穿膜细胞比例少于干扰对照组、正常对照组,差异有统计学意义(P<0.05);干扰对照组与正常对照组迁移穿膜细胞比例比较差异无统计学意义(图6)。

图3 荧光显微镜与RT-PCR 检测转染效率(n = 3)Fig.3 Detection of transfection efficiency by fluorescence microscopy and RT-PCR
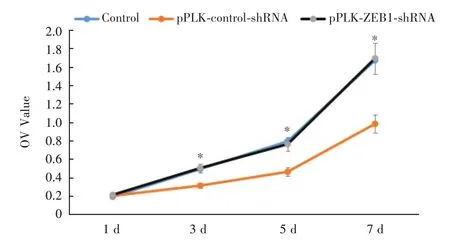
图4 MTT 检测细胞增殖(n = 3)Fig.4 MTT assay for cell proliferation

图5 克隆形成实验(n = 3)Fig.5 Clone formation experiment
2.6 细胞凋亡检测干扰组、干扰对照组、正常对照组的凋亡率分别为(18.19 ± 6.23)%、(4.27 ±1.34)%、(4.36 ± 1.88)%,干扰组细胞凋亡率多于干扰对照组、正常对照组,差异有统计学意义(P<0.05);干扰对照组与正常对照组细胞凋亡率比较差异无统计学意义(图7)。
2.7 Western Blot 检测干扰组E-cadherin 蛋白表达高于干扰对照组、正常对照组,Vimentin、Twist蛋白表达低于干扰对照组、正常对照组,差异均有统计学意义(P<0.05);干扰对照组与正常对照组E-cadherin、Vimentin、Twist 蛋白表达比较差异无统计学意义(图8)。
3 讨论
结直肠癌是发病率与病死率较高的常见恶性消化道肿瘤,目前的研究证据还无法明确其发病机制,因此从分子水平深入探讨结直肠癌的发病机制、寻找新的可靠的靶基因具有非常重要的临床意义。
近年来的研究发现ZEB1 在多种肿瘤中存在基因扩增与过度表达。吕金燕等[15]临床研究证实ZEB1 在乳腺癌组织中呈高表达,且与病理组织学分类、淋巴转移、组织学分级及HER-2、Ki-67 显著相关(P<0.05)。陈登宇等[16]的基础研究发现,靶向降低BGC823 胃癌细胞ZEB1 的水平,可降低lncRNA HOTAIR 水平及细胞增殖、侵袭、迁移力。汪楠等[17]ZEB1 免疫组化表达与恶性肿瘤相关性的Meta 分析显示,组织表达ZEB1 可以促进肿瘤的发生,ZEB1 的表达与肿瘤形成有一定程度的关系,对肿瘤早期诊断有一定的参考价值。

图6 Transwell 迁移实验Fig.6 Transwell migration experiment(×100,n = 3)
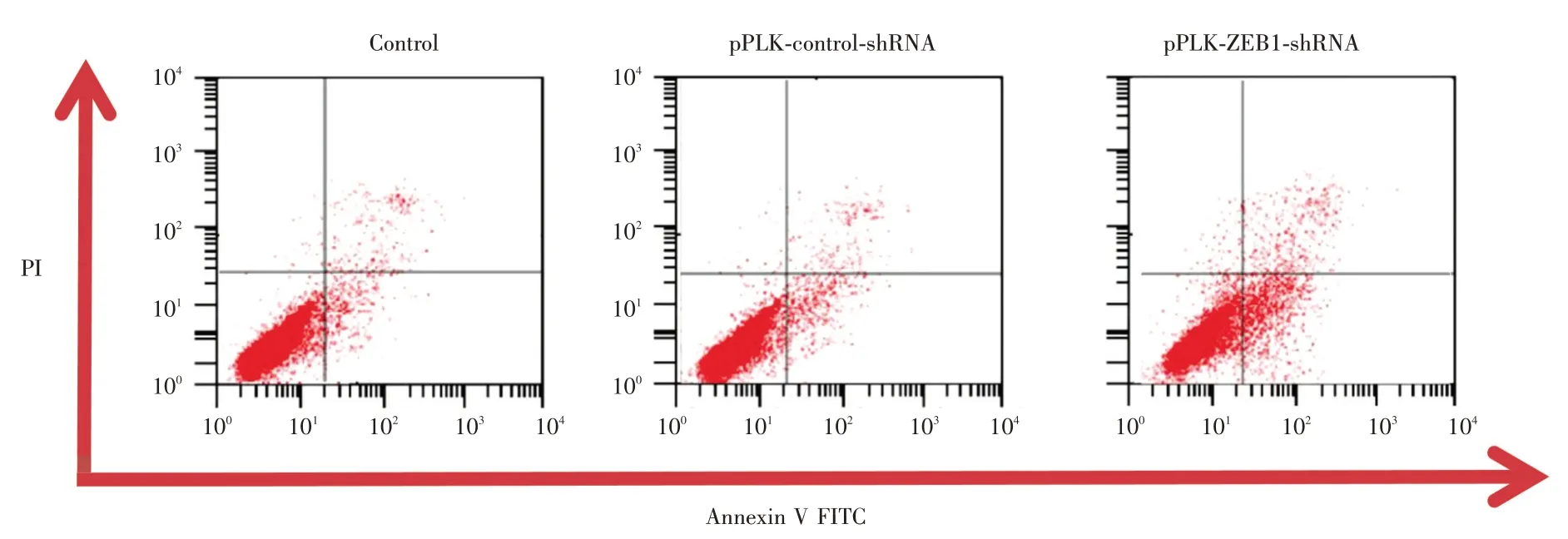
图7 细胞凋亡检测Fig.7 Apoptosis detection(n = 3)
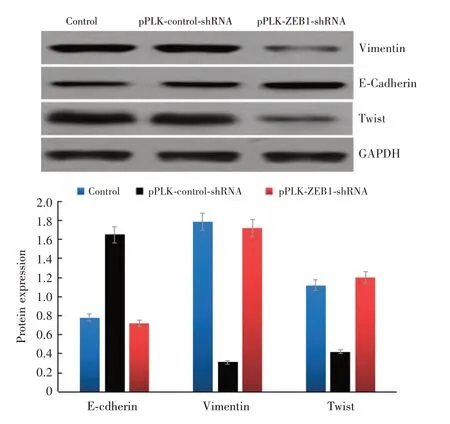
图8 Western Blot 检测E-cadherin、Vimentin、Twist 蛋白表达Fig.8 Western Blot detection of E-cadherin,Vimentin and Twist protein expression(n = 3)
为了探究ZEB1 与结直肠癌发生及发展的关系,前期研究利用免疫组织化学SP 方法检测在结直肠癌组织、良性病变组织(肠镜下取检提示不典型增生或息肉)、癌旁正常黏膜组织中ZEB1 的表达,显示ZEB1 的阳性表达率在癌组织组(73.63%)明显高于结直肠良性病变组(17.8%)及癌旁正常组织组(13.3%),ZEB1 的阳性表达率在结直肠癌的Ⅲ+Ⅳ期组(88.9%)明显高于结直肠癌Ⅰ+Ⅱ期组(58.3%),差异均具有统计学意义(P<0.05),研究结果表明ZEB1 可能在结直肠癌的发生与发展中发挥着重要作用[14]。但有关ZEB1 在结直肠癌中的具体生物学功能还有待研究。
为进一步探讨ZEB1 与结直肠癌细胞生长与迁移的关系,本实验应用沉默病毒载体感染ZEB1表达最高的结直肠癌细胞株,观察干扰ZEB1 表达对细胞增殖、凋亡与迁移能力的影响。实验发现,干扰ZEB1 表达可抑制人结直肠癌细胞珠LOVO 的增殖、克隆形成率与迁移能力,促进其凋亡,提示ZEB1 在人结直肠癌细胞的生长与转移中扮演着重要角色,为促癌基因,但其作用机制还需要进一步的研究。
研究[18-21]已证实ZEB1 可能通过调节上皮间质转化参与肿瘤的发生与发展。上皮间质转化的主要特征即是上皮细胞极性与细胞间连接的丧失,并获得了间质细胞的表型,提高了迁移性与侵袭性。很多转录因子有具有诱导上皮间质转化的作用,包括Snail 家族、bHLH 家族、ZEB 家族。上皮间质转化的过程主要表现为上皮细胞标志物E-cadherin 及细胞角蛋白等的表达降低,而间质细胞标志物,如Vimentin、N-cadherin、纤维粘连蛋白等的表达增加。作为上皮间质转化期间转录抑制因子之一的ZEB1,可结合到E-cadherin 的CDH1(编码E-Cadherin)启动子上,最终导致E-cadherin 表达下调,增加上皮细胞的间质特性,进而促进肿瘤细胞扩散、转移。前期研究发现,E-Cadherin 在结直肠癌组中的表达明显低于其在结直肠良性病组及正常黏膜组中的表达,且ZEB1 与E-Cadherin在结直肠癌组织中的表达呈负相关(r= -0.625,P<0.01),表明E-Cadherin 表达在结直肠癌肿瘤细胞组织的远处扩散转移方面有着十分重要的作用。本实验结果显示,干扰ZEB1 表达可提高上皮间质转化E-cadherin 蛋白表达,降低Vimentin、Twist 蛋白表达(P<0.05),提示干扰ZEB1 表达可抑制结直肠癌肿瘤细胞的上皮间质转化过程,从而抑制肿瘤细胞的增殖与迁移能力。
研究初步证实,干扰ZEB1 表达可抑制人结直肠癌细胞的增殖、迁移能力,增加细胞凋亡,抑制其上皮间质转化。但是ZEB1 可通过结合多种癌蛋白或肿瘤抑制因子来调节上皮间质转化过程,其也受到microRNA 的调控,所以作用机制还需要进一步明确。接下来将通过动物体内实验进一步验证体外实验结果。
