激活素A对成人脐静脉内皮细胞的转分化作用
2019-12-04张湾刘高虹于为民王艳红张楠吴之敬任小军
张湾 刘高虹 于为民 王艳红 张楠 吴之敬 任小军
1山西医科大学附属大医院肾内科(太原030032);2山西省人民医院肾内科(太原030012);3山西医科大学微生物和免疫教研室(太原030001)
中国成年人慢性肾脏病的总患病率为10.8%,慢性肾脏病患者近1.2 亿[1]。肾小管间质纤维化(TIF)是各种慢性肾脏病进展至终末期肾病的最终通路。肾TIF 主要病理过程包括炎症细胞浸润、肌成纤维细胞(MFB)活化、细胞外基质积累和微血管减少[2]。其中MFB 是细胞外基质的主要来源。以往研究[3]显示,MFB 主要由基底成纤维细胞、血管周细胞、肾小管上皮细胞上皮-间质转分化(EMT)细胞转化而来。新近研究[4-5]表明,内皮细胞也可经历内皮-间充质转分化(EndMT)促进纤维化的发生,并被认为是MFB 的生成机制之一。LEBLEU 等[6]的研究发现纤维化肾脏中内皮来源的MFB 和上皮细胞来源分别占10%、5%,而骨髓来源和基底成纤维细胞分别占35%、50%。
转化生长因子β(TGF-β)超家族与EndMT 的发生密切相关[7]。研究[8]显示,在培养的内皮细胞中TGF-β2 已被证明能够刺激EndMT;ACT A 是TGF-β超家族成员之一,与TGF-β亚基约有20%氨基酸序列一致,参与调控细胞生理过程。笔者的前期研究发现,ACT A 在单侧输尿管梗阻大鼠的小管上皮细胞表达明显增加[9]。体外实验证实,ACT A 可刺激大鼠肾小管上皮细胞分泌α-SMA 和纤维连接蛋白(FN),而使用FS 阻断ACT A 的作用后,α-SMA 和FN 表达明显减少。提示ACT A 可通过诱导EMT,促进肾脏TIF 的形成[10]。ACT A 与肾脏EndMT 是否存在一定的联系,目前还未见相关报道。
本研究运用经典的体外培养的成人脐静脉内皮细胞(HUVEC)代替肾小管周毛细血管内皮细胞,观察HUVEC 在ACT A 的作用下α-SMA、VECad 和FN 的表达以及FS 的干预作用,并以TGF-β 2 作为对照,探讨ACT A 在EndMT 过程中的作用及可能机制,为临床肾脏TIF 发病机理及防治提供新的理论依据。
1 材料与方法
1.1 主要试剂HUVEC 细胞株(山西医科大学微生物免疫实验室),DMEM 低糖培养基(美国Hyclon),胎牛血清(杭州四季青),TGF-β2(美国Peprotech),Activin A(美国Peprotech),兔抗α-平滑肌肌动蛋白(α-SMA)单克隆抗体(英国Abcam),兔抗纤维连接蛋白多克隆抗体(英国Abcam),兔抗VE-Cad 多克隆抗体(美国CST),兔抗actin 多克隆抗体(美国CST),通用型二步法免疫组化试剂盒(北京中山金桥),DAB 显色试剂盒(博士德)。
1.2 方法
1.2.1 细胞培养及传代取HUVEC 细胞采用DMEM 培养基+ 10%胎牛血清培养基培养,在37 ℃、5%CO2的条件下生长,倒置显微镜下观察。2 ~3 d 换液1 次。待贴壁细胞长到大约80%融合时,0.25%胰蛋白酶与0.02% EDTA 消化传代,传至3 ~5 代时换到无胎牛血清的培养基中培育24 h,让细胞进行同步化生长,再进行各指标检测。
1.2.2 MTT 法检测细胞增殖率消化指数生长期HUVEC 细胞,调整细胞密度为1 × 105/mL,每孔200 μL 接种于96 孔板培养板上,培养48 h 后,分别加入含不同浓度ACT A(0、10、30、60、100 mg/mL)培养液200 μL(A 组),含不同浓度(0、10、30、60、100 ng/mL)的FS 培养液(F 组),30 ng/mL ACT A + 不同浓度(10、30、60、100 ng/mL)的FS 培养液(A + F 组),再培养72 h。将各浓度组都设置5 个复孔。每孔加入20 μL MTT(5 mg/mL,即0.5%MTT)溶液,继续培养4 h。弃去培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min。用酶联免疫检测仪测量各孔的OD值,细胞增殖率= 实验组OD值/对照组OD值。
1.2.3 细胞分组将HUVEC 细胞分为5 组:(1)对照组:ACT A 及rh-FS 浓度均为0 ng/mL;(2)TGF-β组(T 组):TGF-β2 浓度为10 ng/mL;(3)ACT A 组(A 组):ACT A 浓度30 ng/mL;(4)TGF-β + FS 组:TGF-β2 浓度:10 ng/mL,rh-FS 浓度:100 ng/mL;(5)ACT A+FS组(A+F组):rh-FS浓度为100 ng/mL,ACT A 浓度:30 ng/mL。
1.2.4 免疫细胞化学染色法检测各组细胞α-SMA、VE-Cad 和FN 蛋白表型情况HUVEC 细胞按照分组接种于铺有盖玻片的六孔板中,爬片处理72 h 后,4%多聚甲醛室温固定20 min,洗涤后加入0.1% Triton-X100,室温作用20 min 破膜,PBS 洗涤后滴加兔抗α-SMA 单克隆抗体、兔抗VE-Cad 多克隆抗体和兔抗FN 多克隆抗体,4 ℃孵育过夜;PBS 洗涤后滴加对应二抗、辣根酶标记链霉卵白素工作液(S-A/HRP)、DAB 显色,苏木素复染,常规脱水,二甲苯透明,中性树胶封片。以胞浆出现棕黄色并高出背景,胞核呈深蓝色为阳性染色,随机于采取5 个不连续的视野(400 ×),观察细胞形态学变化,拍照采集图片,采用Image Pro Plus 图像分析系统对免疫组化结果进行半定量分析,计算出HUVEC 细胞α-SMA、VE-Cad 和FN 的平均光密度(mean optical density,MOD),即α-SMA、VE-Cad和FN 的相对表达量。
1.2.5 Western Blot印迹检测α-SMA、VE-Cad、FN蛋白表达收集各组细胞于离心管中,加入150 μL裂解混合液(RIPA∶PMSF = 100∶1),冰浴30 min后,12 000 r/min 离心10 min 取上清,在金属浴中煮沸变性,冷却后加入等体积buffer,用BCA 法检测蛋白含量。然后于8%分离胶和10%浓缩胶聚丙烯酰胺凝胶中电泳,切出分离胶,于电转模转移至PVDF 膜上,放入5%脱脂奶粉中,于室温下封闭2 h,TBST 洗膜后分别加入α-SMA、VE-Cad、FN 多克隆抗体(1∶1 000),4 ℃下摇床培养隔夜,收回一抗,洗膜后加入羊抗兔二抗(1∶5 000)培育2 h,洗膜后加入ECL 显色液在凝胶成像系统曝光。目的蛋白与相应内参灰度值的比值作为该蛋白的相对表达量。
1.3 统计学方法应用SPSS 24.0 统计软件进行分析,数据以均数± 标准差表示。组间差异比较采用方差分析和独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 ACT A、FS 对HUVEC 细胞增殖率的变化ACT A 对HUVEC 细胞生长有明显的促进作用,在30 ng/mL 促增殖作用最强,当浓度达到100 ng/mL时,促进细胞增生的作用反而减弱(F =22.768,P<0.001);单独给予FS 对细胞增生无明显影响(F =0.437,P= 0.781);但FS 能拮抗ACT A 对内皮细胞生长的促进作用,呈剂量依赖性(F =15.270,P<0.001),见图1。
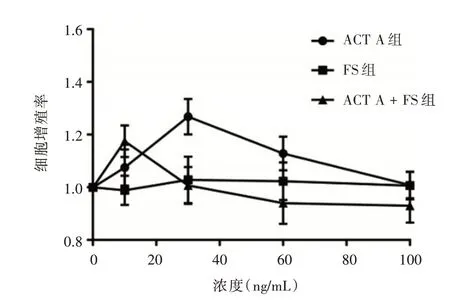
图1 不同浓度ACT A 和FS 对细胞增殖率的影响Fig.1 Effects of different concentrations of ACT A and FS on cell proliferation
2.2.ACT A 和TGF-β对HUVEC 细胞形态的影响对照组细胞呈纺锤状,实验组ACT A 和TGFβ 作用细胞72 h 后细胞形态开始出现细微变化,细胞形态明显变为长梭形;TGF-β + FS 组与TGFβ 组比较细胞形态无明显变化;ACT A + FS 组与ACT A 组细胞比较,ACT A 这种效应可被抑制,见图2。
图2 各组细胞形态变化(免疫细胞化学染色法,400×)Fig.2 Morphological changes of cells in each group(immunohistochemical staining,400×)
2.3 ACT A 诱导HUVEC 细胞表型变化细胞化学染色法结果显示,ACT A 组刺激细胞48 h 后与对照组相比,α-SMA 和FN 表达水平升高(tα-SMA=-4.988,P= 0.002;tFN= -7.407,P<0.001),而VECad 的表达减少(tVE-Cad= 2.820,P= 0.03);TGF-β +rh-FS 组与TGF-β 组比较细胞表型无明显变化(tα-SMA= 1.185,P= 0.057 5;tFN= -1.042,P= 0.338;tVE-Cad= -1.743,P= 0.132);ACT A + rhFS 组与ACT A 组细胞比较,α-SMA 和FN 表达水平降低(tα-SMA=4.440,P= 0.004;tFN= 5.455,P= 0.002),VE-Cad 的表达增加(tVE-Cad= -3.396,P= 0.015),见图3。
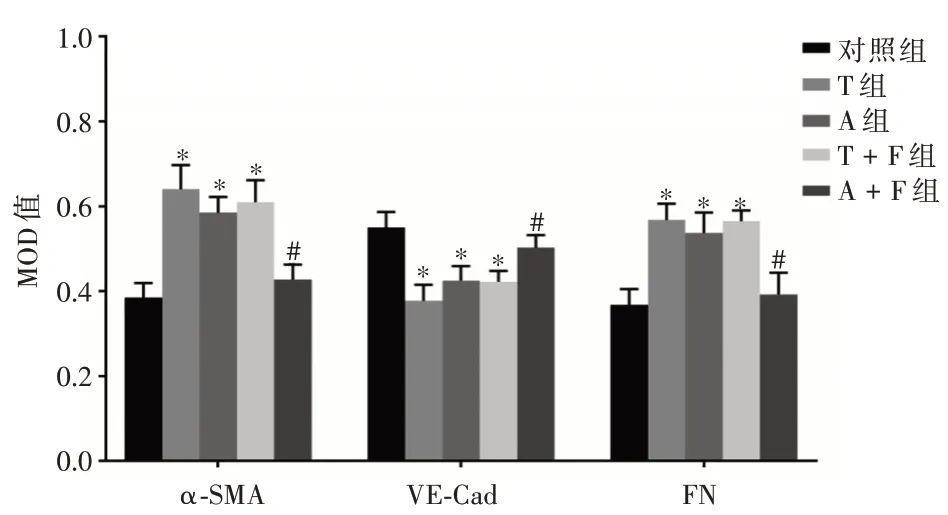
图3 各组α-SMA、VE-Cad 和FN 蛋白MOD 值比较Fig.3 Comparison of MOD values of α-SMA,VE-Cad and FN proteins in each group
2.4 Western Blot 印迹法检测细胞标志蛋白α-SMA、VE-Cad 和FN 的表达水平结果显示,ACT A 组细胞的α-SMA、FN 水平较对照组明显增高(tα-SMA= -11.363,P<0.001;tFN= -8.381,P<0.001),而VE-Cad 蛋白的水平较对照组有下降趋势(tVE-Cad=5.378,P<0.001),ACT A + FS 组α-SMA 和FN 的水平与ACT A 组比较有下降趋势(tα-SMA= 3.898,P=0.03;tFN= 4.174,P= 0.002),TGF-β + FS 组α-SMA和FN 的水平与TGF-β 组比较差异无统计学意义(tα-SMA= 0.934,P= 0.372;tFN= 1.049,P= 0.319;tVE-Cad= -2.132,P= 0.059),见图4。
3 讨论
肾脏血管系统是调节肾脏功能的必要条件。肾小管周围毛细血管网是肾小球的重要供氧结构,其功能改变可促进肾脏疾病进展。正常情况下,内皮细胞表达一组内皮细胞标志物包括VE-cad、CD31、血管性血友病因子和细胞角蛋白等。病理条件下,内皮细胞可通过EndMT 促进疾病的发生。EndMT 过程中,内皮细胞失去附着力和标志蛋白,形成具有迁移性、细长状间充质样细胞,获得间充质细胞标志蛋白,如α-SMA、FSP-1、FN、波形蛋白、胶原蛋白Ⅰ型和Ⅲ型、巢蛋白等[4,11]。内皮细胞的表型经过转分化可同时含有内皮细胞和间充质细胞属性。

图4 各组α-SMA、VE-Cad 和FN 蛋白相对表达量Fig.4 Relative expression of alpha-SMA,VE-Cad and FN proteins in each group
EndMT 首先在胚胎心脏发育过程中被发现[4]。在成年生物体中,损伤、炎症或老化等病理条件都可以激活EndMT 并诱导相关器官的纤维化,如心脏、肾脏、肺、肝脏、角膜及肠道纤维化的发 生 发 展[12-13]。EndMT与肾脏TIF关系密切。ZEISBERG 等[14]在小鼠肾TIF 的研究证实,大约30% ~50%的成纤维细胞共表达CD31、成纤维特异性蛋白(FSP-1)和α-SMA,提示EndMT 与TIF 关系密切。用Tie2-Cre 追踪小鼠内皮细胞实验进一步证实存在EndMT 衍生的MFB。LI 等[15]在STZ 诱导的糖尿病肾病动物模型证实,肾小管间质有大量表达α-SMA 阳性的内皮来源的细胞,提示End-MT 促进早期糖尿病肾脏纤维化的发生。
TGF-β 超家族参与了EndMT 的调节,其包括3个主要成员:TGF-β、骨形成蛋白(BMP)和激活素(ACT)。已有研究显示,TGF-β2 能够刺激EndMT,TGF-β2 基因敲除小鼠消除了胚胎的EndMT,而TGF-β1 或TGF-β3 基因敲除小鼠没有明显影响EndMT 的发生过程[9]。BMP-7 主要在远端集合管和成人肾脏的肾小球足细胞表达,在肾小管间质纤维化损伤区中表达减少。研究[16]证实,TGF-β激活Smad-2/3 信号诱导EndMT 的过程中,BMP-7可通过与特定受体结合,促进Smad-1/5/8 的磷酸化,发挥拮抗TGF-β信号通路的作用,因此BMP-7可能对EndMT 的抑制发挥作用。
ACT A 与组织纤维化关系密切。ACT A 异常分泌,可以引起组织细胞分化、增殖及代谢异常等[17-19]。有研究[20]发现ACT A 在人动脉粥样硬化斑块和新生内膜平滑肌细胞中表达增加,尤其是进展中的粥样病变血管。也有研究[21]发现,ACTA及它的特异性抑制剂FS 失衡则会促发心肌梗死后心肌纤维化,ACT A 促进肌细胞增殖和内细胞的迁移,ACT A-Smad 2/3 通路在糖尿病胚胎的心肌畸形形成中也发挥重要作用。在肝纤维化和肺纤维化模型中,ACT A 表达均上调[17,22]。也有研究[23]证实,ACT A 可刺激肾脏和胰腺的间质细胞产生TGF-β,ACT A 与ACT 受体在肾缺血后表达增加,而肾小管细胞的FS 在缺血后其表达显著减少。研究[24]发现,缺氧条件下可诱导内皮细胞ACT A 的表达增加,并降低内皮细胞血管生成活性。
综上所述,本研究发现ACT A 可诱导HUVEC发生EndMT,FS 可通过阻断ACT A 的效应产生抑制EndMT 和抗纤维化作用。靶向ACT 可能是抑制肾TIF,延缓肾脏病进展的有效途径。但本研究还有很多局限。首先由于技术原因,本研究采用HUVEC 代替原代培养的肾小管管周毛细血管内皮细胞。其次,进一步在动物体内实验及开展相关临床研究验证本研究的结论也是必须的。最后,ACT A 促进EndMT 的具体信号转导机制仍需进一步研究证实。
