两种检测生鲜乳中β-内酰胺酶的方法比对
2019-12-04郝苗苗徐伟良李春冬孙春玲
郝苗苗 ,徐伟良 ,3,李春冬 ,3, 孙春玲
(1.锡林郭勒职业学院,内蒙古锡林浩特 026000;2.锡林郭勒食品检验检测和风险评估中心,内蒙古锡林浩特 026000;3.锡林郭勒生物工程研究院,内蒙古锡林浩特 026000)
乳及乳制品在生产、加工过程中抗生素的残留严重危害人体健康[1-3]。近年来,随着国家对生鲜乳品质监控力度加大,一些不法分子为了谋求经济利益,通过人为添加β-内酰胺酶以分解乳中的抗生素类药物,使“高抗奶”变为“无抗奶”[4]。2001年9月,我国农业部颁布了《无公害食品生鲜牛乳》行业标准,规定生鲜乳中“不得检出”抗生素[5]。卫生部于2009年3月发布了《全国打击违法添加非食用物质和滥用食品添加剂专项整治近期工作重点及要求》和《全国打击违法添加非食用物质和滥用食品添加剂专项整治抽检工作指导原则和方案》的通知,明确指出β-内酰胺酶是非食品用物质且属违法添加剂。
常用的β-内酰胺酶检测方法主要有微生物法、理化检测法、仪器检测法、免疫法和试剂盒检测等方法。现今常使用的检测方法为微生物法中的杯蝶法[6-9]、快速检测的试剂盒法[10-12],2种方法各有优缺点。因此,试验研究对比杯蝶法与试剂盒法的差异,以供人们在检测过程中根据实际需求选择最优方法。
1 材料与方法
1.1 材料
试验样品为10份生鲜奶样;藤黄微球菌(Micrococcus luteus) CMCC(B)28001,中国医学细菌保藏管理中心提供;β-内酰胺酶标准品(600万U/mL),中国食品药品检定研究院提供;青霉素G标准品(99.8%)、舒巴坦(99.4%),Dr.Ehrentorfer公司提供;0.1 mol/L Tris-HCl溶液(pH值7.0,含 0.1%BSA);抗生素检定培养Ⅱ号、营养琼脂、脑心浸液培养基,北京陆桥公司提供;无水磷酸二氢钾,无水磷酸氢二钾,国药公司提供;β-内酰胺酶残留试剂盒,勤帮生物技术有限公司提供。
1.2 杯蝶法[6]
1.2.1 菌悬液的制备
将藤黄微球菌划线接种于营养琼脂平板上,于36℃下培养24~36 h直至长出单个菌落。挑取单菌落于无菌的5 mL脑心浸液培养基,经36℃下培养20~24 h至菌液浑浊,测定菌悬液浓度在1×108~1×109CFU/mL,菌悬液应在4℃下保藏5 d内使用。
1.2.2 样品的制备
将待检样品充分混匀,取1mL待检样品分别置于4支1.5 mL离心管中,分别标为A,B,C,D,每个样品做3个平行,共12管。同时做阳性对照和阴性对照样品,阳性对照样品为灭菌后并经检测为阴性的牛乳,经添加β-内酰胺酶标准品至终质量浓度为0.5 U/L。阴性对照样品为灭菌后并经检测为阴性的牛乳。制备操作同待检样品。
1.2.3 检测用平板的制备
菌悬液按1∶20加入到无菌约50℃的抗生素检定培养基Ⅱ号中,充分摇匀。取无菌培养皿,加入15 mL含菌的抗生素检定培养基Ⅱ号,凝固后在其表面放置4个无菌牛津杯,备用。
1.2.4 样品的测定
各离心管标准物质添加量见表1。
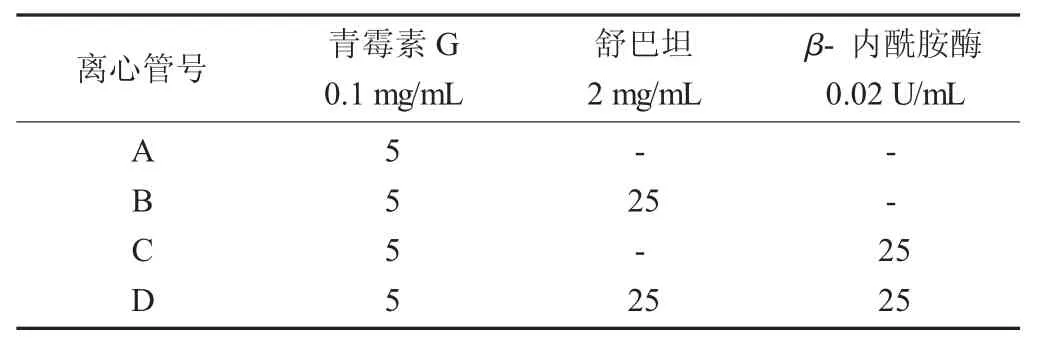
表1 各离心管标准物质添加量
按照表1分别将青霉素G标准溶液、β-内酰胺酶标准溶液、舒巴坦标准溶液加入到待检样品及阳性/阴性对照样品中。混匀后,将上述A~D试样各取200 μL加入放置于检测用平板上的4个无菌牛津杯中,于36℃下培养18~22 h,测量抑菌圈直径。每个样品取3次平行试验平均值。
1.2.5 结果判定
阴性对照样品应A,B,D产生抑菌圈,且A,B抑菌圈直径差异<3 mm,C抑菌圈直径小于D抑菌圈,且抑菌圈直径差异≥3 mm,且3次平行试验结果一致。阳性对照样品应B,D产生抑菌圈,且A抑菌圈直径小于B抑菌圈直径,差异≥3 mm,C抑菌圈直径小于D抑菌圈,且抑菌圈直径差异≥3 mm,且3次平行试验结果一致。以对照组结果为前提,检测系统成立,可对样品结果进行如下判定:
(1) 若样品结果中B,D产生抑菌圈,且C抑菌圈直径小于D抑菌圈,抑菌圈直径差异≥3 mm,3次平行试验结果一致时,进行如下判定:①A抑菌圈直径小于B抑菌圈直径,差异≥3 mm,3次平行试验结果一致,则判定该样品检出β-内酰胺酶,报告β-内酰胺酶检测结果为阳性。②A,B抑菌圈差异<3 mm,3次平行试验结果一致,则判定该样品未检出β-内酰胺酶,报告β-内酰胺酶检测结果为阴性。
(2)当样品结果中A不产生抑菌圈且B产生的抑菌圈<11 mm或A、B均不产生抑菌圈,应将样品稀释10倍,再按照该方法进行检测。
1.3 试剂盒法
将样品与试剂条恢复至室温,迷你金属浴提前预热至35℃。从试剂桶中取出白色微孔试剂,开盖,吸取250 μL均匀样品至该微孔中,充分混匀,盖好盖板膜。将微孔放入45±5℃的恒温箱,保温15 min,取出后回温3 min。取出试剂桶,打开后取出所需的红色微孔试剂和试纸条并标记。用微量移液器吸取200 μL待检样本于微孔中,缓慢抽吸且充分与微孔中试剂混匀,将微孔放入迷你金属孔中,孵育3 min。在35℃条件下,将试纸条插入微孔中一手柄端向上,吸水垫端向下,并使吸水垫充分浸入溶液中,反应3 min。从微孔中取出试纸条,轻轻刮去试纸条下端的吸水垫,并进行结果判读。反应完成5 min内读取结果。
2 结果与分析
分别采用杯蝶法与试剂盒法对10份生鲜乳进行β-内酰胺酶检测。
杯蝶法与试剂盒法结果见表2。
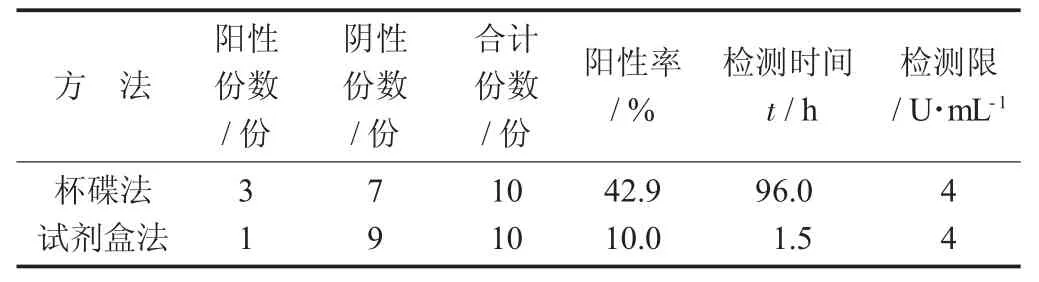
表2 杯蝶法与试剂盒法结果
由表2可以看出,10份样品经杯蝶法检测有3份阳性样品,阳性检出率为42.9%。用试剂盒法可检测出1份阳性样品,阳性检测率为10%,检出率低于杯蝶法。与试剂盒检测相比杯碟法检测时间过长。
3 结论
杯蝶法是微生物法测定β-内酰胺酶的主要方法,该法采用对青霉素类药物绝对敏感的藤黄微球菌作为标准菌株,在样品中加入青霉素G作为对照,利用舒巴坦特异性抑制β-内酰胺酶活性的特性,通过比对加入舒巴坦与未加入舒巴坦的样品所产生抑菌圈的大小,间接测定样品中是否含有β-内酰胺酶类药物。此方法对样品进行3个平行测试,重复性好,阴阳性对照均符合标准要求,适合大批量检测,检测结果相对准确。
试剂盒法利用间接竞争法测定β-内酰胺酶,其基本原理是β-内酰胺酶可分解β-内酰胺类抗生,通过快速测定β-内酰胺反应后残留的酶含量,从而检测牛奶中残留的β-内酰胺。根据样本中β-内酰胺酶含量的变化可使检测试剂条发生颜色深浅的变化,从而进行测定。此方法适用于现场的快速检测,对环境要求不高,检测速度虽快但易出现假阴性结果,如需进行确证仍应按照标准的微生物杯蝶法进行确证。
