HOXA6基因过表达对肺癌A549细胞增殖和凋亡的影响
2019-12-04闫秀明
郭 丹,闫秀明,杨 亮,石 科
1)河南医学高等专科学校科研实验中心 郑州 451191 2)河南医学高等专科学校检验系生物化学教研室 郑州 451191 3)河南医学高等专科学校检验系微生物与免疫学教研室 郑州 451191
HOX基因又名Ⅰ型同源异形盒基因,是重要的转录调节因子,在细胞增殖、分化等方面发挥重要的调控作用,决定胚胎和器官的发育[1]。研究[2]表明,HOX基因与人类多种恶性肿瘤的发生发展及预后有关,有可能成为癌症早期诊断和基因治疗的分子靶点。因此探讨HOX基因在肿瘤发生发展中的作用,对肿瘤的诊断、治疗及预后评估具有指导意义[3]。HOX根据序列的相似性及其在染色体上的位置可以分为HOXA、HOXB、HOXC和HOXD 四个家族[4]。HOXA6定位于人类染色体7p15.3,全长2 192 bp。据报道[5-6]HOXA6可以促进结直肠癌细胞的增殖,参与肿瘤的侵袭和转移。然而HOXA6在肺癌细胞中的表达如何,是否对肺癌细胞的增殖和凋亡有影响尚不清楚。本实验利用慢病毒技术上调人肺腺癌A549细胞中HOXA6基因的表达,观察细胞增殖和凋亡的变化,探讨HOXA6是否参与肺癌的发生发展。
1 材料与方法
1.1细胞与主要试剂293T细胞、人正常支气管上皮BEAS-2B细胞、A549细胞均购自中国科学院上海细胞库。慢病毒载体系统购自上海吉凯基因公司,QIAamp DNA Mini试剂盒购自德国Qiagen公司,胎牛血清、胰蛋白酶和RPMI 1640培养基购自美国Gibco公司,Trizol、反转录试剂盒购自美国Invitrogen公司,PCR引物由上海生工生物公司合成,CCK-8试剂盒购自碧云天生物技术公司,凋亡检测试剂盒购自凯基生物技术公司,HOXA6、GAPDH、cleaved Caspase-3、cleaved Caspase-9、Bax和Bcl-2一抗购自美国Abcam公司,HRP标记的二抗购于北京中杉金桥生物技术有限公司,Nanodrop 100核酸定量分析仪购自美国Thermo公司,流式细胞仪购自美国Bectone Dickson公司。
1.2细胞培养BEAS-2B和A549细胞用含体积分数10%胎牛血清的RPMI 1640培养基,于37 ℃、体积分数5%CO2培养箱中培养,隔2~3 d传代。
1.3BEAS-2B和A549细胞中HOXA6mRNA的检测取对数生长期细胞,用Trizol提取总RNA,反转录成cDNA后进行qRT-PCR。HOXA6引物:上游5’-TACACGCGCTACCAGACAC-3’,下游5’-GCGT GGAATTGATGAGCTTGTTT- 3’;GAPDH引物:上游5’-AGGTGAAGGTCGGAGTCA-3’,下游5’- AGGGGTCATTGATGGCAACA-3’。反应体系:上游引物0.5 μL,下游引物0.5 μL,10×扩增缓冲液 2 μL,dNTP 2 μL,模板DNA 0.2 μg,Taq DNA聚合酶0.2 μL,1.5 mmol/L Mg2+1.5 μL,加双蒸水至20 μL。反应条件:94 ℃10 min,30个循环;94 ℃15 s,60 ℃32 s退火延伸。用2-ΔΔCt法计算HOXA6 mRNA的相对表达量。实验重复3次。
1.4BEAS-2B和A549细胞中HOXA6蛋白的检测用RIPA提取细胞中总蛋白,BCA法测定蛋白浓度。取20 μg蛋白上样进行SDS-PAGE,湿转至PVDF膜上,50 g/L脱脂奶粉4 ℃过夜封闭,加一抗(HOXA6按1∶3 000稀释,GAPDH按1∶4 000稀释),4 ℃孵育过夜,二抗(按1∶2 000稀释)室温孵育2 h,ECL发光试剂盒显影,扫描条带,并用Image J分析。先以BEAS-2B或A549细胞中HOXA6蛋白与内参条带灰度值的比值作为HOXA6蛋白的表达水平,再以A549与BEAS-2B细胞中蛋白表达水平的比值作为A549细胞的蛋白相对表达量。实验重复3次。
1.5HOXA6过表达对A549细胞增殖和凋亡的影响
1.5.1 细胞分组 将A549细胞分为正常对照组(未处理)、阴性对照组(感染阴性对照慢病毒)和HOXA6过表达组(感染HOXA6过表达慢病毒),每组设3个复孔。
1.5.2 3组细胞中HOXA6 mRNA和蛋白的表达 采用qRT-PCR和Western blot法检测,方法同1.3和1.4。
1.5.3 3组细胞存活率检测 将细胞接种于96孔板培养24 h,每孔加入20 μL CCK-8试剂,37 ℃培养箱中孵育4 h,吸弃上清,每孔加入150 μL的DMSO室温振荡10 min。用酶标仪检测490 nm波长处的吸光度(A)。细胞存活率=实验组A/正常对照组A×100%。
1.5.4 3组细胞凋亡检测 采用Annexin V-APC/7-AAD凋亡检测试剂盒检测。接种细胞至6孔板,4 ℃预冷的PBS洗细胞2次,用 250 μL结合缓冲液重悬细胞。取 100 μL细胞悬液于 5 μL流式管中,加入 Annexin V-APC和 7-AAD 溶液各1 μL ,混匀后室温避光孵育 10 min,上流式细胞仪检测。实验重复3次。
1.5.5 3组细胞中cleaved Caspase-3、cleaved Caspase-9、Bax和Bcl-2蛋白表达的检测 收集各组细胞,参照1.4用Western blot法检测cleaved Caspase-3(一抗按1∶3 000稀释)、cleaved Caspase-9(一抗按1∶3 000稀释)、Bax(一抗按1∶2 500稀释)、Bcl-2(一抗按1∶3 000稀释)蛋白的表达情况。先以目的蛋白与内参灰度值的比值作为目的蛋白的表达水平,再以实验组与正常对照组目的蛋白表达水平的比值作为目的蛋白的相对表达量。实验重复3次。
1.6统计学处理采用SPSS 23.0分析,采用两独立样本t检验比较A549和BEAS-2B细胞中HOXA6 mRNA和蛋白的表达。采用单因素方差分析和SNK-q检验比较3组细胞增殖、凋亡情况。采用两独立样本t检验比较阴性对照组和HOXA6过表达组HOXA6 的表达、cleaved Caspase-3、cleaved Caspase-9蛋白表达和Bax/Bcl-2的差异,检验水准α=0.05。
2 结果
2.1BEAS-2B细胞和A549细胞中HOXA6表达的比较BEAS-2B细胞和A549细胞中HOXA6 mRNA的表达水平分别为(1.00±0.17)和(0.57±0.03),二者比较差异有统计学意义(t=4.314,P=0.013)。A549细胞中HOXA6 蛋白的相对表达水平为(0.58±0.02),低于BEAS-2B细胞。
2.2A549细胞中HOXA6表达的比较结果见图1和表1。

1:正常对照组;2:阴性对照组;3:HOXA6过表达组

组别nmRNA蛋白阴性对照组30.98±0.030.96±0.07HOXA6过表达组31.65±0.131.55±0.15t8.6716.310P0.0010.003
2.3A549细胞存活率和凋亡率的比较HOXA6过表达组A549细胞存活率降低,凋亡率增加(表2)。

表2 3组A549细胞存活率和凋亡率的比较%
*:与其他两组相比,P<0.05
2.4A549细胞中cleaved Caspase-3、cleaved Caspase-9蛋白表达和Bax/Bcl-2比值的比较结果见图2和表3。
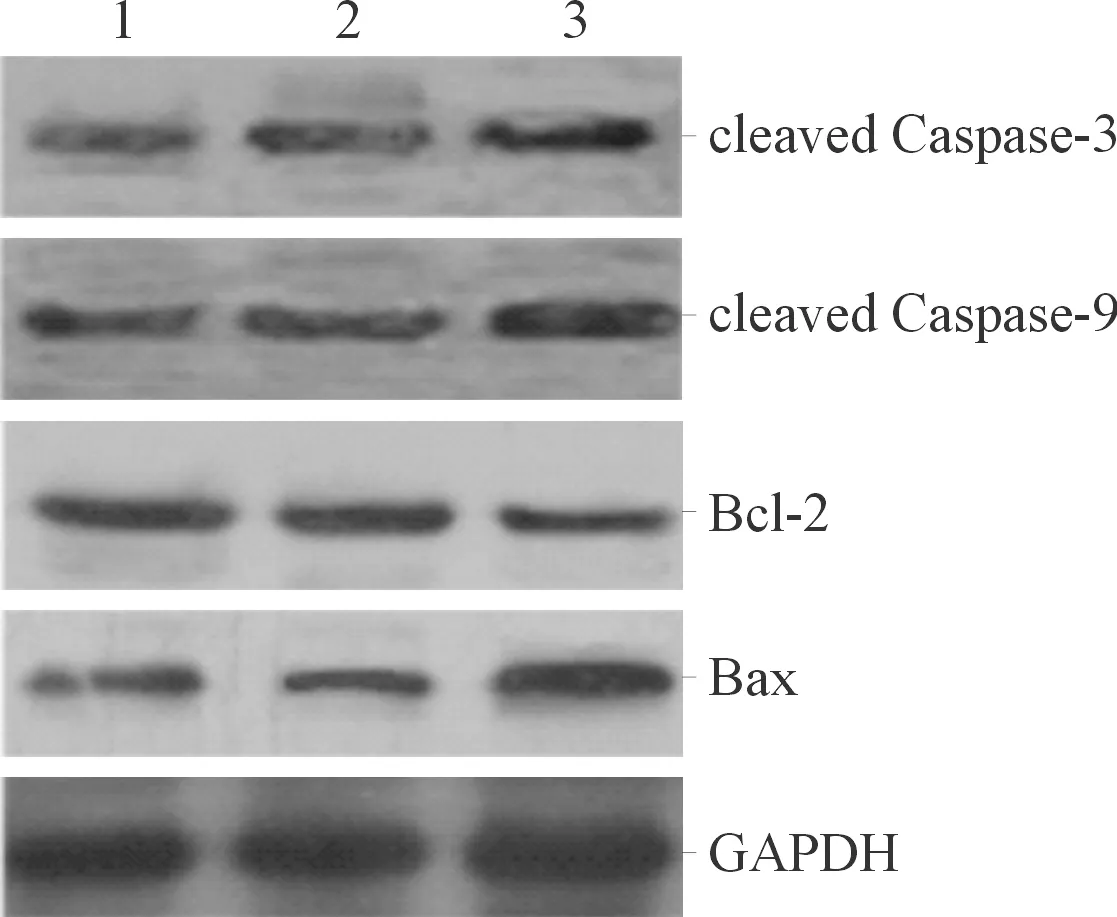
1:正常对照组;2:阴性对照组;3:HOXA6过表达组

组别ncleaved Caspase-3蛋白cleaved Caspase-9蛋白Bax/Bcl-2阴性对照组30.97±0.071.05±0.121.02±0.17HOXA6过表达组32.57±0.473.11±0.352.95±0.18t5.9139.81113.780P0.004<0.001<0.001
3 讨论
有研究[7]表明,HOX基因在大多数实体瘤中被上调或下调,而且特定的HOX基因在癌症中的表达往往会根据组织类型和肿瘤部位而有所不同。HOX基因在多种肿瘤中表达异常,其表达调控涉及染色体表观修饰以及一些信号分子[8-9]。Kishida等[10]报道成人慢性淋巴瘤和儿童急性淋巴瘤中HOXA6基因出现高甲基化,导致HOXA6蛋白表达下调和功能异常,被鉴定为抑癌基因。有研究[11-13]表明HOXA家族基因在肺癌组织中的表达低于正常肺组织。本研究结果显示,与正常支气管上皮BEAS-2B细胞相比,肺癌A549细胞中HOXA6 mRNA和蛋白的表达水平均下降,与文献报道一致。
Wu等[5]认为HOXA6过表达抑制了结直肠癌Caco2和HT-29细胞的增殖、转移和侵袭能力,并诱导了细胞凋亡,而用siRNA抑制HOXA6的表达后表现出相反的作用,可能与HOXA6通过Bcl-2信号通路调节细胞凋亡有关。研究[14]显示肾透明细胞癌细胞中HOXA6过表达后,细胞存活减少,凋亡增加;而抑制HOXA6表达的肾透明细胞细胞增殖增加,凋亡降低。本文的研究结果表明,A549细胞HOXA6过表达后细胞存活能力降低,凋亡增加,促细胞凋亡蛋白Caspase-3和Caspase-9的降解产物cleaved Caspase-3和cleaved Caspase-9的表达亦显著增高,凋亡相关因子Bax/Bcl-2比值增加,提示HOXA6过表达诱导了A549细胞凋亡,机制可能与Bcl-2信号通路有关。
总之,HOXA6过表达可抑制A549细胞的增殖,可能通过Bcl-2相关信号通路诱导细胞凋亡。
