上调miR-15a表达对子宫内膜癌细胞增殖、凋亡和NOB1蛋白表达的影响
2019-12-04刘慧源耿旭景
王 慧,耿 玲, 郭 威, 刘慧源, 耿旭景
1)驻马店市中心医院生殖医学科 河南驻马店 463000 2)郑州大学第二附属医院生殖医学部 郑州 450014
子宫内膜癌是常见的女性恶性肿瘤,发病率呈现逐年上升的趋势,寻找有效的分子标记物对于子宫内膜癌的诊治具有重要意义[1]。miRNA在肿瘤进展中发挥类似抑癌基因或癌基因的作用,调控肿瘤细胞的生长、凋亡等过程[2]。miR-15a属于miR-15家族,在人体组织中广泛存在,参与调控软骨细胞等多种细胞的生长和分化[3-4]。miR-15a在肿瘤发生中发挥抑制作用,目前在乳腺癌、胰腺癌等肿瘤中已经证实[5-6]。miR-15a可抑制子宫内膜癌细胞的侵袭和迁移,在子宫内膜癌转移中发挥抑制作用[7]。生物信息学预测结果显示NOB1的3′UTR含有与miR-15a结合的位点,提示NOB1可能是miR-15a的靶基因。NOB1是一种RNA结合蛋白,参与宫颈癌[8]、胶质瘤[9]、肝癌[10]等肿瘤细胞的增殖、凋亡调控,与肿瘤的发生发展密切相关。本实验通过转染miR-15a模拟物(mimics)至子宫内膜癌RL-952细胞,观察上调miR-15a表达对RL-952细胞增殖、凋亡的影响,验证miR-15a和NOB1的靶向关系,为明确子宫内膜癌的发生机制和分子靶向治疗提供参考。
1 材料与方法
1.1细胞来源及主要试剂、仪器RL-952细胞购自上海研晶生物科技有限公司;Opti-MEM培养基购自美国Gibco公司;Lipofectamine2000试剂盒购自美国Invitrogen公司;RNA提取试剂盒、反转录试剂盒、实时荧光定量PCR(qRT-PCR)试剂盒购自日本TaKaRa公司,LightCycler480 PCR仪购自美国Roche公司,Thermo FC酶标仪购自美国Thermo公司。SDS-PAGE试剂盒、CCK-8试剂盒、Annexin V-FITC/PI凋亡检测试剂盒购自上海碧云天生物技术研究所;Bcl-2抗体购自美国Cell Signaling Technology公司,Bax抗体、NOB1抗体购自美国Proteintech公司。miRNA cDNA合成试剂盒购自天根生化科技(北京)有限公司;miR-15a mimics及其阴性对照、NOB1过表达载体(pcDNA3.1-NOB1)和空载体(pcDNA3.1)均由基尔顿生物科技(上海)有限公司构建;psiCHECK-2荧光素酶报告载体购自北京合生基因科技有限公司。
1.2实验分组将对数生长期的RL-952细胞接种于6孔培养板中,每孔2×105个细胞。待细胞生长融合至60%时进行转染操作。取无菌的1.5 mL EP管(A管)加入miR-15a mimics(miR-15a组)或阴性对照(miR-NC组),再加入200 μL Opti-MEM培养基,用移液器轻轻吹打,混合均匀,室温条件下放置5 min。另取无菌的1.5 mL EP管(B管)加入15 μL 脂质体Lipofectamine2000,再加入200 μL Opti-MEM培养基,用移液器轻轻吹打,混合均匀,室温条件下放置5 min。将A、B管中的溶液混合均匀,室温放置15 min,然后滴加到细胞培养板中,于37 ℃、体积分数5%CO2、相对湿度95%的培养箱中培养。同时设置空白对照组,细胞不做转染处理,正常培养。转染12 h后,更换新鲜培养基,继续培养48 h。
1.3 3组细胞中miR-15a 表达水平的检测分组培养48 h后,qRT-PCR法测定细胞中miR-15a的表达。Trizol法提取细胞总RNA,经紫外分光光度计测定浓度和纯度后,进行反转录。反转录体系:2×miRNA Reaction Buffer Mix 5 μL、BSA封堵液1 μL、miRNA PrimeScript RT Enzyme Mix 1 μL、总RNA 1 μL,加RNase-free水至10 μL。反转录条件:37 ℃孵育1 h,85 ℃孵育5 s。PCR反应体系:0.4 μmol/L的上、下游引物各2 μL,SYBR Premix Ex Taq TMII 20 μL,cDNA模板4 μL,添加RNase-free水至40 μL。反应条件:95 ℃30 s,95 ℃5 s,60 ℃20 s,共40个循环。引物由南京金斯瑞合成。miR-15a上游引物序列为5’-GCGGTAGCAGCACATAA-3’,下游为 5’-GTGCAGGGTCCGAGGT-3’。U6上游引物序列为5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游为5’-CGCTTCACGAATTTGCGTCTCAT-3’。采用2-ΔΔCt法计算miR-15a相对表达水平。实验重复3次。
1.4 3组细胞增殖能力的CCK-8法检测分别将3组细胞接种到96孔板中,每孔5×103个,于37 ℃、体积分数5%CO2、湿度为97%的培养箱中培养。48 h后,每孔加入10 μL的CCK-8工作液和100 μL的无血清RPMI 1640培养基,于培养箱中继续培养2 h。培养结束后,于酶标仪450 nm处检测吸光度(A)。以A值表示细胞增殖能力。每组设置3个复孔,实验重复3次。
1.5 3组细胞克隆形成能力的检测采用平板克隆实验检测。分别将3组细胞接种到6孔板中,每孔500个细胞,十字交叉晃动以使细胞均匀分布。3~4 d换液1次,培养10~14 d后,出现肉眼可见的细胞克隆团。吸弃细胞培养液,用PBS洗涤,然后以40 g/L多聚甲醛固定,结晶紫染色,对≥50个细胞的克隆团进行计数。克隆形成率=克隆团数目/接种细胞数目×100%。
1.6 3组细胞凋亡率的检测分组培养2 d以后,Annexin V-FITC/PI双染法检测细胞凋亡。收集3组细胞,用PBS洗涤,然后用2.5 g/L胰蛋白酶消化,收集消化液,1 000×g离心5 min, PBS再洗1次。添加195 μL结合缓冲液,然后加入5 μL Annexin V-FITC,于避光条件下反应5 min。再加入190 μL结合缓冲液,添加10 μL PI染液,避光孵育10 min。立即上流式细胞仪检测凋亡率。
1.7 3组细胞中Bax、Bcl-2蛋白表达的检测采用Western blot法检测。分别收集3组细胞,用含1 mmol/L PMSF的蛋白裂解液于冰上裂解细胞20 min,12 000×g离心5 min,收集上清,BCA法测定蛋白浓度。以每泳道20 μg上样量行SDS-PAGE,蛋白分离后转PVDF膜,用50 g/L脱脂奶粉封闭1 h。加入Bax抗体(稀释度1∶400)、Bcl-2抗体(稀释度1∶400),4 ℃孵育过夜。加入HRP标记的二抗(稀释度1∶200),室温孵育1 h,ECL显色。用Quantity One分析条带光密度值。内参为GAPDH。以目的条带与GAPDH条带光密度的比值表示目的蛋白表达水平。
1.8miR-15a和NOB1靶向关系的预测和鉴定使用互联网靶基因预测软件Targetscan预测miR-15a的靶基因,结果显示NOB1的3′UTR端与miR-15a有结合位点,利用荧光素酶报告实验鉴定两者的靶向关系。PCR扩增NOB1的3′UTR端序列,克隆到psiCHECK-2载体的Xho和Not酶切位点之间,构建野生型(WT)荧光素酶报告载体。利用基因突变技术将结合位点突变后构建突变型(MUT)荧光素酶报告载体。将WT、MUT载体分别与阴性对照、miR-15a mimics转染到RL-952细胞中,48 h后检测荧光素酶活性,Western blot法检测NOB1表达水平,操作同1.7,其中NOB1抗体稀释度为1∶600。
1.9过表达NOB1和上调miR-15a表达后RL-952细胞增殖、克隆形成能力及凋亡的变化将miR-15a mimics和pcDNA3.1-NOB1共转染至RL-952细胞中(miR-15a+NOB1组),同时将miR-15a mimics和空载体共转染至RL-952细胞中(miR-15a+NC组),培养48 h后,分别以CCK-8法、平板克隆实验、Annexin V-FITC/PI双染法测定细胞增殖能力、克隆形成率、凋亡率,Western blot法检测细胞中NOB1(一抗稀释度1∶600)、Bax(一抗稀释度1∶400)、Bcl-2(一抗稀释度1∶400)蛋白表达水平,操作同前。
1.10统计学处理数据均用SPSS21.0分析。miR-NC、miR-15a组荧光素酶活性、NOB1蛋白表达水平,以及miR-15a+NC组与miR-15a+NOB1组各指标的比较采用两独立样本t检验;空白对照组、miR-NC及miR-15a组各指标的比较采用单因素方差分析,组间两两比较采用SNK-q检验;检验水准α=0.05。
2 结果
2.1空白对照、miR-NC、miR-15a组细胞中miR-15a表达水平及细胞活性的比较见表1。与空白对照、miR-NC组比较,miR-15a组细胞中miR-15a表达水平升高,细胞增殖能力、克隆形成率降低,凋亡率升高。
2.2空白对照、miR-NC、miR-15a组细胞中Bax、Bcl-2蛋白表达水平的比较见图1和表1。与空白对照、miR-NC组比较,miR-15a组细胞中促凋亡蛋白Bax表达水平升高,抗凋亡蛋白Bcl-2表达水平降低。
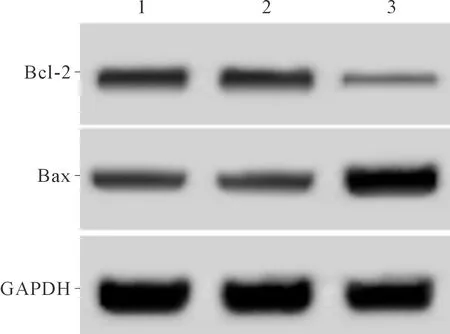
1、2、3:分别为空白对照组、miR-NC组、miR-15a组
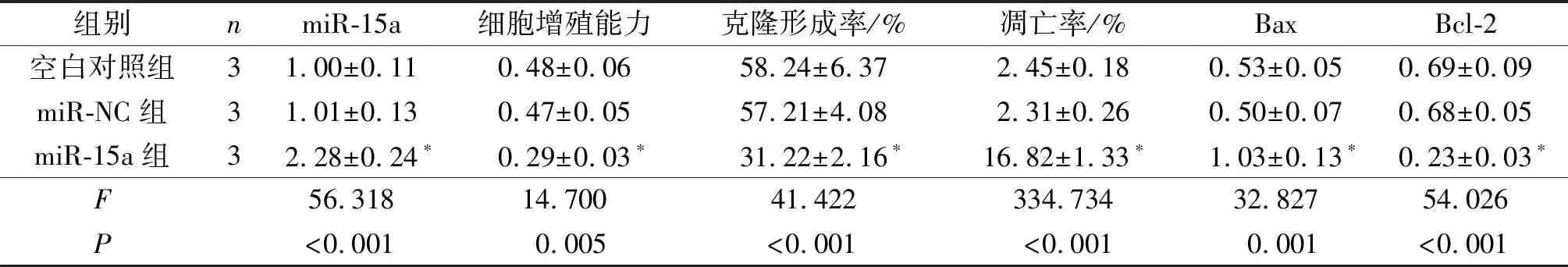
表1 3组细胞中miR-15a表达水平、细胞增殖能力、克隆形成率、凋亡率及Bax、Bcl-2蛋白表达水平的比较
*:与空白对照组和miR-NC组比较,P<0.05
2.3miR-15a和NOB1靶向关系的验证经Targetscan靶基因在线预测发现miR-15a与NOB1的3′UTR端有碱基互补结合位点(图2)。WT 3′UTR和miR-15a mimics共转染的RL-952细胞荧光素酶活性降低(表2),说明miR-15a可与NOB1的3′UTR靶向结合。与miR-NC组比较,miR-15a组NOB1蛋白表达水平降低(表2)。
2.4NOB1过表达和上调miR-15a表达对RL-952细胞增殖、克隆形成能力及凋亡的影响见表3。与miR-15a+NC组比较,miR-15a+NOB1组细胞增殖能力、克隆形成率升高,凋亡率降低,细胞中Bax蛋白表达水平下降,Bcl-2、NOB1表达水平升高。
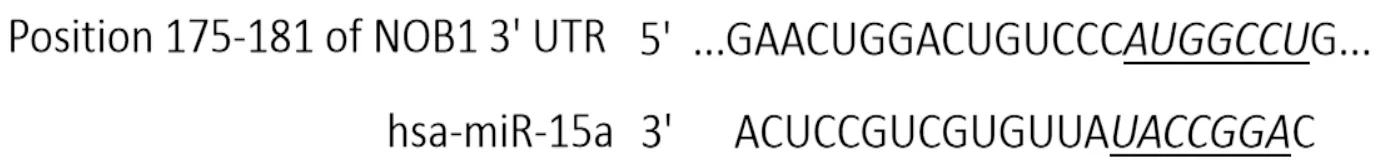

图2 miR-15a与NOB1的靶向关系
3 讨论
研究[11]显示,miRNA在子宫内膜癌发生发展过程中发挥了重要作用。miR-15a基因定位于染色体13q14,参与多种病理及生理过程。研究[12]显示,miR-15a参与膝关节软骨细胞增殖、凋亡过程,与关节炎的发生有关。miR-15a可以减少阿尔茨海默病神经细胞的凋亡[13]。miR-15a在肿瘤组织中表达下调,已经证实的有子宫内膜癌、胰腺癌、肾癌等[6-7,14]。miR-15a还能够抑制胃癌、肝癌细胞的生长[15-16]。有研究[7]报道,miR-15a在子宫内膜癌组织中低表达,上调其表达可以抑制子宫内膜癌细胞的侵袭和迁移。Bcl-2蛋白家族是与细胞凋亡密切相关的调控因子,其可以分成两种,一种是在细胞凋亡过程中发挥促进作用的促凋亡蛋白,另外一种是在细胞凋亡过程中发挥抑制作用的抗凋亡蛋白,Bax属于促凋亡蛋白,Bcl-2属于抗凋亡蛋白,其表达水平可反映细胞凋亡水平[17-18]。本实验结果显示,上调miR-15a表达后子宫内膜癌RL-952细胞的增殖和克隆形成能力下降,细胞凋亡率升高,细胞中Bax蛋白表达水平升高,而Bcl-2蛋白表达水平降低,提示miR-15a具有诱导子宫内膜癌细胞凋亡,抑制其增殖的作用,具有抑制子宫内膜癌细胞生长的功能。
miR-15a发挥生物学作用与靶向调控基因的表达有关,现阶段已知CXCL10、NF-κB等是miR-15a的靶基因[19-20]。我们利用预测软件发现,miR-15a和NOB1可能具有靶向关系。NOB1是一个在肿瘤组织中高表达的癌基因,其具有促进肿瘤细胞生长和抑制凋亡的作用[21]。我们进一步利用双荧光素酶报告实验证实了miR-15a可以靶向负调控子宫内膜癌细胞中NOB1蛋白的表达;提高RL-952细胞中NOB1蛋白的表达后,细胞的增殖、克隆形成能力均升高,凋亡率降低,Bax蛋白表达降低,Bcl-2表达升高。上述研究结果提示miR-15a可能通过抑制NOB1发挥抑制子宫内膜癌细胞增殖和诱导凋亡的作用。
综上,提高肿瘤细胞中miR-15a表达可能是治疗子宫内膜癌的途径之一。对于这一结论,在以后的实验中我们会在多株子宫内膜癌细胞中进行验证,并探讨可能的具体机制。
