NF-κB对A549细胞上皮间质转化进程的影响
2019-12-04翟若南任亚南史凤显马铭泽
周 舫,张 恺,翟若南,薛 腾,任亚南,史凤显,马铭泽,王 航
郑州大学公共卫生学院劳动卫生与职业病学教研室 郑州 450001
肺癌是中国乃至世界范围内重大的公共卫生问题,肺癌患者死亡率高的主要原因之一是肺癌易发生转移,这也是肺癌临床治疗上的重、难点问题[1]。上皮间质转化(epithelial mesenchymal transition,EMT)在肺癌的原发性浸润和继发性转移中发挥重要作用,经历EMT进程的肺上皮细胞由上皮细胞立方样形态向间质细胞纺锤样形态转化,细胞骨架重建,细胞失去极性并产生伪足使细胞的运动能力增强[2],同时细胞内间质细胞标记蛋白Vimentin、N-cadherin的表达上升,而上皮细胞标记蛋白E-cadherin的表达下降。
近来有研究[3-4]发现在发生转移的肺癌组织中非吞噬细胞氧化酶4(non-phagocytic cell oxidase 4,NOX4)高表达;此外NOX4也是哺乳动物机体细胞内活性氧簇(reactive oxygen species,ROS)的主要来源。研究[5-6]表明ROS在转化生长因子-β(transforming growth factor-β, TGF-β)诱导的EMT进程中发挥重要作用,TGF-β的刺激可使细胞内ROS的水平升高,而ROS在肿瘤的发生发展过程中对包括Smads、MAPK等在内的多条细胞信号通路具有调节作用,影响癌细胞的运动能力。因此,本研究利用TGF-β诱导A549细胞的EMT进程,然后用BAY11-7082特异性地抑制NF-κB的表达,观察A549细胞NOX4、ROS水平,EMT进程以及细胞迁移能力的变化,从而为控制肺癌转移提供相应的实验基础和理论依据。
1 材料与方法
1.1材料A549细胞购自中科院上海细胞生物研究所。BCA蛋白浓度测定试剂盒、RPMI 1640培养基、NF-κB抑制剂BAY11-7082、二甲基亚砜(DMSO)购自北京索莱宝生物科技有限公司,胎牛血清购自美国GEMINI公司,TGF-β购自美国Peprotech公司,NF-κB(p65)、磷酸化NF-κB(p65)[p-NF-κB(p65)]、Vimentin抗体购自武汉三鹰生物技术有限公司,NOX4、Snail、GAPDH、E-cadherin抗体购自美国Cell Signaling Technology公司,ROS检测试剂盒购自上海碧云天生物科技有限公司。ECLIPSE TS100-F倒置显微镜(日本尼康公司),Accuri C6流式细胞仪(美国BD公司),SUNRISE自动酶标仪(奥地利TECAN公司),DYCZ-24DN电泳仪(北京六一仪器厂),凝胶成像仪(美国Bio-Red公司)。
1.2细胞培养使用含有青链霉素双抗和体积分数10%胎牛血清的RPMI 1640培养基复苏、培养A549细胞;培养条件为37 ℃、体积分数5%CO2、相对湿度95%。
1.3实验分组A549细胞铺满培养瓶80%左右时,对细胞进行饥饿处理(使用不含血清的RPMI 1640培养基培养8 h),然后分为空白组、TGF-β组(5.0 μg/L TGF-β)、TGF-β+BAY11-7082组、BAY11-7082组和溶剂(DMSO)对照组。BAY11-7082工作浓度为20 mmol/L,以DMSO为溶剂。处理24 h后,进行以下检测。
1.4EMT相关蛋白及NF-κB(p65)、NOX4蛋白表达的检测收集细胞并提取总蛋白,测定蛋白浓度后进行聚丙烯酰胺凝胶电泳,每孔蛋白的上样量为25 μg。电泳结束转膜,用含50 g/L脱脂奶粉的TBST封闭2 h,加一抗[NF-κB(p65)和p-NF-κB(p65)抗体按1∶1 000稀释,Vimentin、E-cadhein、Snail抗体均按1∶2 000稀释,NOX4抗体按1∶500稀释,GAPDH抗体按1∶5 000稀释],4 ℃孵育过夜,加二抗(按1∶5 000稀释),孵育1 h,洗脱3次后加入适量ECL发光液曝光显影,结果使用Quantity One软件进行定量分析。以目的条带与内参条带灰度值的比值作为目的蛋白的表达水平。实验重复3次。
1.5ROS检测利用DCFH-DA探针检测各组细胞的ROS水平,采用流式细胞仪检测荧光信号的强度,用以反映细胞内ROS的水平。实验重复3次。
1.6划痕实验取处于对数生长期的A549细胞接种于6孔板,使用无菌的200 μL枪头在6孔板中心划一个“十”字形的划痕,然后用PBS清洗,再按照1.3中分组对细胞进行相应的处理,培养24 h后观察划痕宽度的变化,并使用相应图像处理软件分析划痕宽度。实验重复3次。
1.7统计学处理应用SPSS 19.0处理数据,采用单因素方差分析比较多组间NF-κB(p65)、p-NF-κB(p65)、EMT相关蛋白、NOX4蛋白的表达水平以及细胞内ROS水平的差异,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1 5组细胞NF-κB(p65)、p-NF-κB(p65)、NOX4、ROS水平及EMT相关蛋白表达水平的比较如图1和表1、2所示,与空白组比较,TGF-β组E-cadherin蛋白的表达水平降低,同时Vimentin、Snail、NF-κB(p65)、p-NF-κB(p65)、NOX4蛋白的表达水平和ROS的水平升高;与TGF-β组相比,TGF-β+BAY11-7082组E-cadherin蛋白的表达升高,同时Vimentin、Snail、NF-κB(p65)、p-NF-κB(p65)、NOX4蛋白的表达水平和ROS的水平降低,提示BAY11-7082与TGF-β联用存在着拮抗作用。
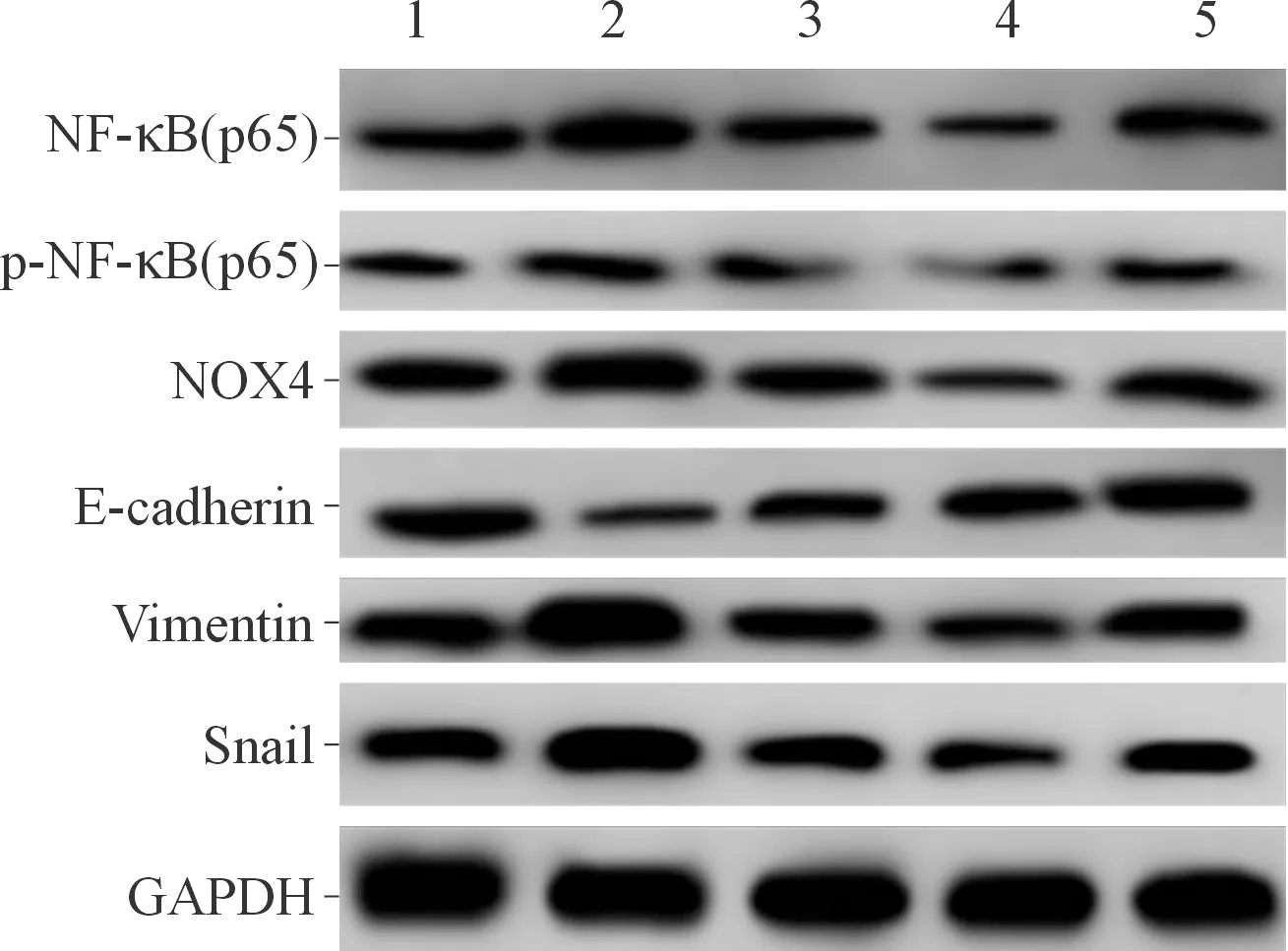
1~5:分别为空白组、TGF-β组、TGF-β+BAY11-7082组、BAY11-7082组和溶剂对照组
图1 5组细胞NF-κB(p65)、p-NF-κB(p65)、NOX4及EMT相关蛋白的表达

表1 5组细胞NF-κB(p65)、p-NF-κB(p65)及EMT相关蛋白表达水平的比较(n=3)
*:与空白组相比,P<0.001;#:与TGF-β组相比,P<0.001;△:与TGF-β+BAY11-7082组相比,P<0.001
2.2 5组细胞迁移能力比较如表2所示,与空白组相比,TGF-β组划痕宽度变小,说明TGF-β使细胞的迁移能力增强;而与TGF-β组相比,TGF-β+BAY11-7082组划痕宽度增大,说明BAY11-7082抑制NF-κB(p65)降低了细胞的迁移能力。

表2 5组细胞NOX4蛋白表达水平、ROS水平及划痕宽度的比较(n=3)
*:与空白组相比,P<0.001;#:与TGF-β组相比,P<0.001;△:与TGF-β+BAY11-7082组相比,P<0.001
3 讨论
肺癌的发病率呈逐年上升趋势,而肺癌易于向骨、脑以及肾脏等部位转移,是造成肺癌患者高死亡率的主要原因之一;在肺癌转移过程中往往伴随着EMT进程的发生[7];而研究[8]表明NF-κB可通过调节Snail转录因子的活化从而对EMT进程产生调控作用。
NF-κB是细胞内最重要的转录因子之一,普遍存在于真核细胞内并参与多种基因的转录调控,同时NF-κB信号通路的持续激活与许多恶性肿瘤的发生以及侵袭转移过程密切相关[9]。本实验在TGF-β的诱导下检测到NF-κB(p65)、p-NF-κB(p65)的水平升高,同时A549细胞发生EMT进程,具体表现为上皮细胞标志蛋白E-cadherin的表达下降,间质细胞标记蛋白Vimentin的表达上升,而使用NF-κB抑制剂BAY11-7082特异性地降低NF-κB(p65)的表达后,E-cadherin蛋白的表达升高,而Vimentin、Snail蛋白的表达下降,提示TGF-β诱导的EMT进程受抑,同时造成NOX4蛋白表达下降以及ROS的水平降低。有研究[10-11]表明,ROS作为细胞内的第二信使可以通过影响蛋白的磷酸化过程调控细胞内的多条信号通路,比如NOX/ROS/MAPK信号通路、PI3K/Akt/mTOR信号通路等,从而影响Smad、Snail等转录因子的表达,进而对EMT进程产生影响。本研究结果显示抑制NF-κB(p65)的表达可使NOX4来源的ROS的水平降低,低水平的ROS不足以激活相关的信号通路,导致转录因子Snail蛋白的表达下降,EMT进程被抑制。相似的,在乳腺上皮细胞中,高水平的ROS诱导的EMT进程同样受到NF-κB的调控[12]。而在人恶性胶质细胞瘤细胞系U251细胞和U87细胞中发现,沉默趋化因子受体7(chemokine receptor 7, CCR7)或者用CCR7的中和抗体处理细胞后,可抑制NF-κB的活化,进而使细胞内MMP-2、MMP-9蛋白的表达受到抑制,最终对细胞的侵袭、转移以及EMT进程产生影响[13]。另有研究[14]显示,下调CDX2可诱导EMT发生,从而增强结肠癌细胞的侵袭、迁移能力,提示EMT与肿瘤细胞的侵袭、迁移能力密切相关。本实验中使用BAY11-7082抑制NF-κB(p65)的表达后造成细胞内ROS水平降低,抑制了A549细胞的EMT进程,使细胞迁移能力下降,和上述研究的结果相符。因此,由以上结果可以推断出:NF-κB对TGF-β诱导的A549细胞EMT进程具有调节作用,即TGF-β的刺激使NF-κB(p65)活化,细胞内NOX4、ROS水平升高,进而激活ROS/Snail等信号通路促进细胞的EMT进程。
综上所述,在A549细胞中,NF-κB介导由TGF-β诱导产生的EMT进程,而抑制NF-κB的活化可抑制NOX4的表达,导致细胞内ROS的水平下降。低水平的ROS不能充分激活ROS/Snail等信号通路,从而抑制了A549细胞的EMT进程并降低细胞的迁移能力。
