NF1和p-ERK1/2蛋白在苯并芘联合脂多糖诱导的小鼠肺癌中的表达
2019-12-04冯斐斐
邵 华,张 怡,黄 丽,高 敏,冯斐斐
郑州大学公共卫生学院卫生毒理学教研室 郑州 450001
肺癌已成为世界上发病率和病死率最高的恶性肿瘤之一,由于当前肺癌的早期诊断率和远期疗效仍不够理想,故对肺癌的诊治手段还需做更多的研究和探索[1]。有研究[2]表明,神经纤维瘤蛋白1(neurofibromatosis 1,NF1)可以将活性的RAS-GTP复合物转换为非活性的RAS-GDP,NF1表达水平的降低导致RAS信号通路的持续激活,进而刺激细胞生长、增殖。此外NF1缺失还可激活以RAS和细胞外信号调节激酶(ERK)活性增加为特征的旁路途径[3]。ERK是丝裂原活化蛋白激酶(MAPKs)通路的一个重要因子,能够被多种刺激因子激活,引起多种内在调控基因的表达,从而导致细胞恶性增殖和转化。谭婧瑾[4]研究发现,非小细胞肺癌患者肺组织中磷酸化ERK1/2(p-ERK1/2)蛋白的表达水平明显高于癌旁正常组织。此外,有研究[5]表明炎症与多种恶性肿瘤的发生有关,并且已有研究证实脂多糖(LPS)能够加速4-(甲基亚硝氨基)-3-吡啶-1-丁酮[4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone,NNK)]诱导的小鼠肺部肿瘤的发生[6]。故本实验采用苯并芘[B(a)P][7]替代NNK联合LPS染毒,构造小鼠炎症促癌模型,探讨NF1和p-ERK1/2蛋白表达与炎性相关肺癌的关系,从而为其防治提供作用靶点。
1 材料与方法
1.1实验动物来源SPF级C57BL/6小鼠,雌雄各半,体重20~30 g,均购自北京维通利华实验动物技术有限公司,常规饲养于郑州大学公共卫生学院动物房,自由饮水和进食,饲养温度为18~22 ℃,昼夜节律同自然。
1.2实验分组采用随机数字表法将实验动物分为4组:B(a)P联合LPS组[B(a)P+LPS组,n=35)、单独B(a)P组[B(a)P组,n=35]、单独LPS组(LPS组,n=15)和三辛酸甘油酯联合生理盐水组[对照组,n=15]。B(a)P+LPS组小鼠经异氟烷麻醉后气管内滴注B(a)p悬浮液,染毒剂量为1 mg/只(溶于50 μL三辛酸甘油酯),每周1次,连续4周后停止,B(a)p染毒结束后记为第0周,第3周进行LPS气管内滴注,染毒剂量为2.5 μg/只(溶于50 μL生理盐水),每3周1次,给予5次后停止。B(a)p组小鼠气管内滴注1 mg/只的B(a)p悬浮液,每周1次,连续4周。LPS组每只小鼠气管内滴注2.5 μg/只LPS溶液,每3周1次,连续给予5次。对照组小鼠气管内滴注等体积的三辛酸甘油酯和无菌生理盐水。
1.3观察指标及方法染毒结束后,小鼠正常饲养,30周后对小鼠进行解剖,肉眼观察小鼠肺部出现肿瘤的数量和出现肺癌的小鼠数,计算肺癌发生率和各组小鼠平均肿瘤形成数。取左侧肺叶固定在40 g/L多聚甲醛中,石蜡包埋,检测肺部相关蛋白的表达。
1.4肺癌组织中NF1、p-ERK1/2蛋白表达的免疫组化检测肺组织切片经脱蜡水化、抗原修复、灭活内源性过氧化物酶后,用山羊血清室温封闭30 min,滴加兔抗小鼠NF1和p-ERK1/2(均按1∶100稀释)4 ℃孵育过夜,然后滴加山羊抗兔二抗室温孵育50 min,最后经DAB显色和苏木素复染后脱水封片。以磷酸盐缓冲液代替一抗作为阴性对照。山羊抗兔二抗、兔抗小鼠p-ERK1/2抗体和兔抗小鼠NF1抗体购自北京博奥森生物技术公司;SP双标记染色试剂盒和DAB显色剂购自武汉谷歌生物技术有限公司。结果判定:NF1和p-ERK1/2蛋白以着色呈浅黄色至棕褐色为阳性细胞。采用Image-Pro Plus 6.0 图像分析软件测量3个视野(×200)下阳性区域面积和累积光密度,通过公式(平均光密度=累积光密度/阳性表达区域面积)计算并分析数据[8]。
1.5统计学处理采用SPSS 21.0对数据进行分析。应用χ2检验比较各组小鼠肺部成瘤率,采用非参数秩和检验比较各组小鼠平均肿瘤形成数,应用完全随机设计的方差分析和Bonferroni检验比较各组小鼠肿瘤组织中NF1蛋白和p-ERK1/2蛋白表达的差异。应用Pearson相关分析各组肺组织中NF1和p-ERK1/2蛋白表达的相关性,检验水准α=0.05。
2 结果
2.1各组小鼠肺部成瘤情况对照组与LPS组小鼠未形成肿瘤;B(a)p+LPS组小鼠肿瘤形成率(96.97%)高于B(a)p组(82.05%)(χ2=4.028,P=0.045);B(a)p+LPS组小鼠的平均肿瘤形成数[10.0(4.0,19.2)]高于B(a)p组[3.0(1.0,6.0)](Z=3.762,P<0.001)。
2.2各组小鼠肺癌组织中NF1和p-ERK1/2蛋白的表达见图1、2和表1。NF1蛋白主要表达于细胞核,在癌巢部位多呈低表达或不表达,在正常组织中明显表达;p-ERK1/2蛋白主要表达于细胞质,在癌巢部位多呈高表达状态,在正常组织中散在分布。
2.3各组小鼠肺癌组织中NF1和p-ERK1/2蛋白表达的相关性见表2。B(a)p+LPS组两者的Pearson相关系数为-0.771(P<0.05),其他3组两蛋白表达无相关性。
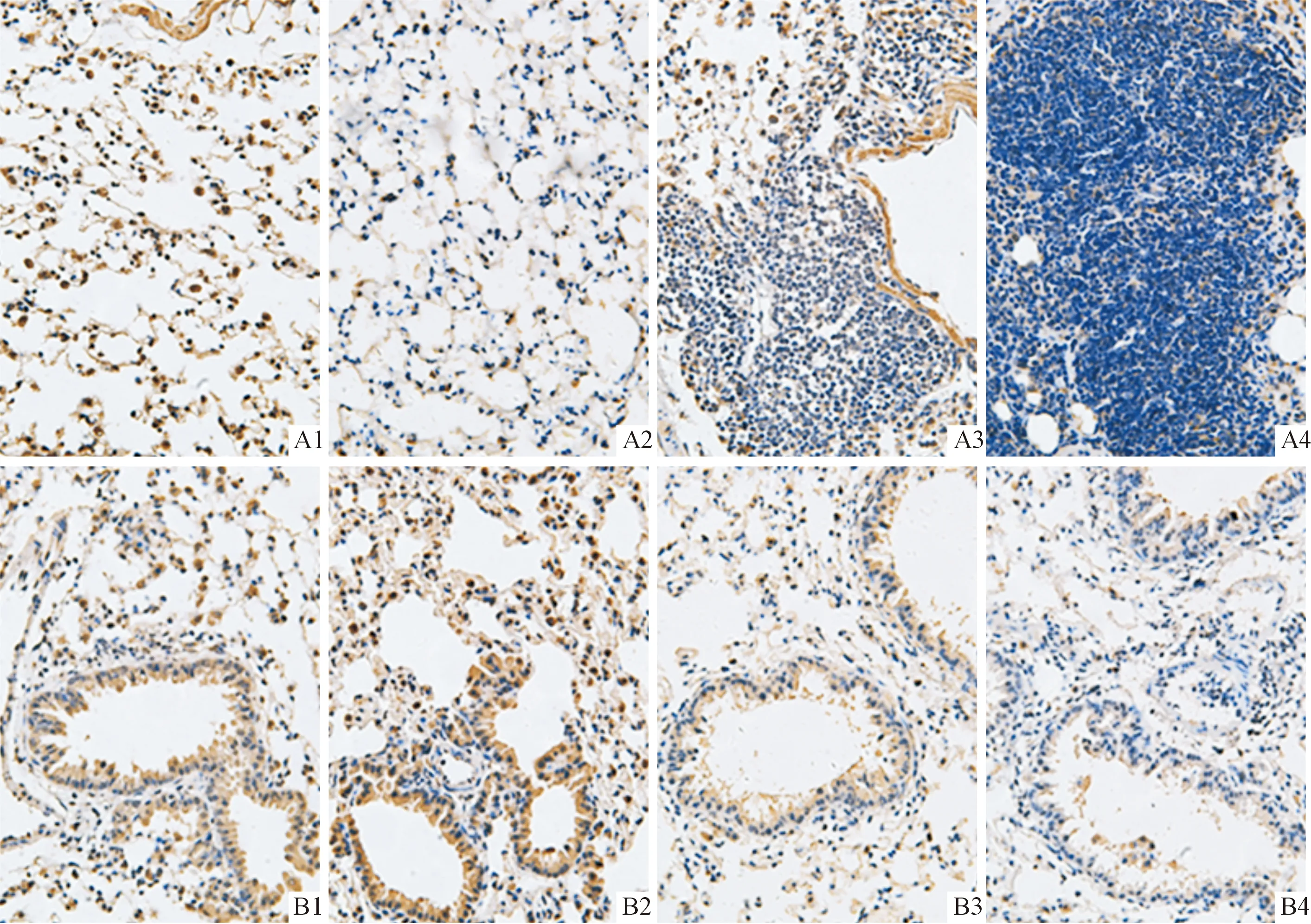
A:肺泡;B:细支气管;1:对照组;2:LPS组;3:B(a)p组;4:B(a)p+LPS组
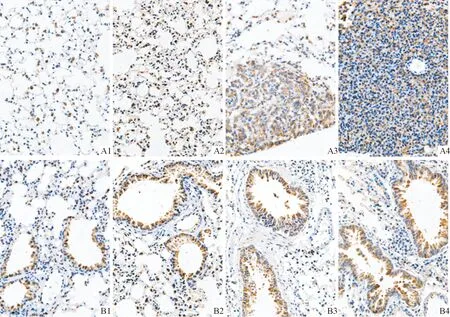
A:肺泡;B:细支气管;1:对照组;2:LPS组;3:B(a)p组;4:B(a)p+LPS组
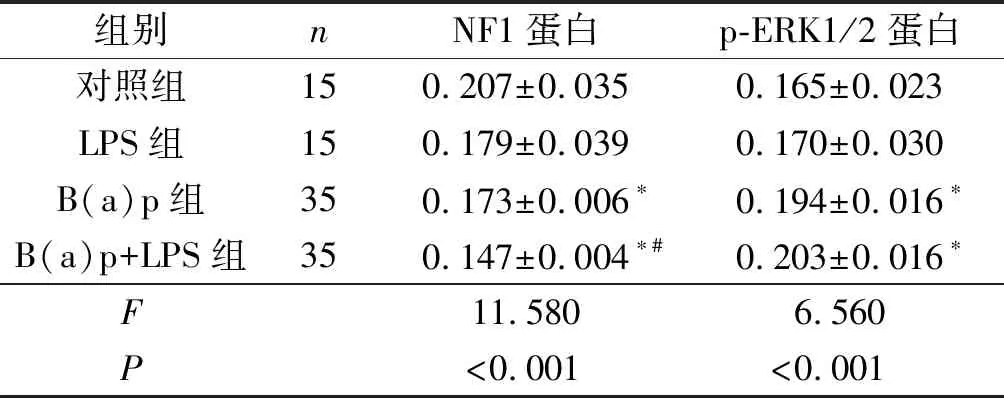
表1 各组小鼠肺癌组织中NF1和p-ERK1/2蛋白表达的比较
*:与对照组相比,P<0.05;#:与B(a)p组相比,P<0.05
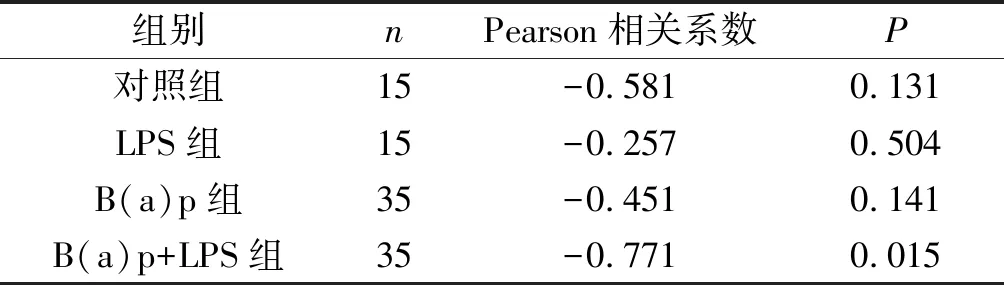
表2 各组小鼠肺癌组织中NF1和p-ERK1/2蛋白表达的相关性分析
3 讨论
肿瘤的发生、进展受肿瘤微环境调控,慢性炎症在肿瘤发生过程中发挥着极其重要的作用[9]。肿瘤微环境中炎性细胞和因子的长期存在可以促进肿瘤细胞的生长,抑制凋亡。研究[10]发现LPS作为一种内毒素能够诱导炎症反应,通过改变肿瘤微环境而参与癌症的发生发展。本研究结果显示,单独LPS作用并不诱发肺癌,单独B(a)p可诱导肺癌发生;而与B(a)p组相比,B(a)p+LPS组小鼠的肿瘤形成率升高、小鼠的平均肿瘤形成数明显增加,提示LPS确实可以通过介导炎症加重B(a)p诱导的肺癌的形成。
NF1基因已被确认为抑癌基因,其突变、缺失与肿瘤的发生、进展、疾病的疗效、预后,甚至和某些肿瘤的不良抵抗有关[11]。杜珊等[12]在一项胃癌研究中发现NF1蛋白在胃癌组织中的阳性表达率低于正常胃组织,NF1蛋白高表达组的生存率高于低表达组。另外,张鹏[13]在对未分化多形性肉瘤(UPS)的研究中发现瘤组织中NF1蛋白表达阳性率低于瘤旁正常肌肉组织。本实验结果显示NF1蛋白在肺部正常组织中明显表达,而在癌组织中多呈低表达或不表达;与对照组相比,B(a)p+LPS和B(a)p组NF1蛋白表达降低,提示NF1可能具有抑癌基因的功能,与以往的研究结果一致。B(a)p+LPS组NF1蛋白表达水平与B(a)p组相比亦明显降低,表明炎症的存在能够使肺癌加重。
NF1基因缺失会引起Ras超活化,随后导致Raf/MEK/ERK信号通路的激活。 ERK是MAPKs家族的重要成员之一,在丝裂原受相应信号刺激后,ERK接受上游的级联反应信号转化为p-ERK进入细胞核,活化细胞核内的某些转录因子,进而参与细胞的调控及增殖[14-15]。王西洁[16]通过免疫组化法检测发现TNMⅢ~Ⅳ期肺癌组织中p-ERK蛋白表达高于Ⅰ~Ⅱ期,并且高于正常肺组织。本研究结果显示,p-ERK1/2蛋白在肺癌组织中高表达,在正常组织中低表达且散在分布;与对照组相比,B(a)p+LPS和B(a)p组的p-ERK1/2蛋白表达增加,这与上述研究结果一致。
为了探究肺癌组织中NF1和p-ERK1/2蛋白表达之间的关系,本研究进行了相关分析,结果表明NF1与p-ERK1/2蛋白的表达呈负相关,这证实NF1作为RAS蛋白的负调节因子,其表达产物减少使RAS通路不断激活,进而使下游的ERK磷酸化水平升高[17]。然而B(a)p+LPS组与B(a)p组相比以及LPS组与对照组相比p-ERK1/2蛋白的表达均无统计学意义,其原因可能是除了NF1低表达导致RAS-ERK通路的持续激活外,还可能有其他的因子参与ERK的调控,如蛋白激酶C(protein kinase C, PKC)对ERK通路的活化。
综上所述,NF1蛋白在肺癌组织中低表达,p-ERK1/2蛋白呈高表达,两者表达呈负相关,提示NF1作为一种抑癌基因其正常表达可抑制肺癌的发生发展;低表达时RAS下游的RAF/MEK/ERK通路持续激活,从而使p-ERK1/2蛋白表达水平升高,细胞发生癌变和增殖。探索NF1和p-ERK1/2蛋白在肺癌中的表达情况,有助于对肺癌发病机制进行更深了解,开辟肿瘤治疗新途径。
