甲基化芯片检测电离辐射诱导人外周血淋巴细胞DNA甲基化水平的变化
2019-12-03田雪蕾封江彬刘青杰
田雪蕾,封江彬,田 梅,刘青杰*
(中国疾病预防控制中心辐射防护与核安全医学所,中国疾病预防控制中心辐射防护与核应急重点实验室,北京 100088)
表观遗传是指DNA序列不发生变化,但基因的表达发生了可遗传的改变。表观遗传学的研究范围包括DNA甲基化、组蛋白修饰、染色体重塑和各种RNA介导的反应[1-2]。其中研究的最广泛的是DNA甲基化。DNA甲基化主要发生在5'-CpG-3'双核苷酸序列的胞嘧啶上。在人类基因组中,大约有60%~70%的CpG胞嘧啶是甲基化的。基因组中存在成簇的CpG称之为CpG岛,岛内的CpG几乎不被甲基化或甲基化程度很低,而岛外的CpG大多数是甲基化的。DNA甲基化对基因表达的调控有重要作用[1-3]。
研究发现电离辐射能够造成DNA甲基化水平的改变。目前对电离辐射诱导DNA甲基化改变的研究主要集中在全基因组DNA低甲基化上。研究报道4、7及10 Gy X射线急性全身照射后8、24、48及72 h,C57BL/6 NJcl小鼠肝组织中出现全基因组DNA低甲基化,0.5~10 Gy γ射线急性照射后24、48及72 h后,体外培养的CHO K-1、HeLa S-3、C1300 N1E及V79A03细胞中基因组DNA 5-甲基胞嘧啶均明显减少[4-6]。大剂量及低剂量电离辐射均可诱导全基因组DNA低甲基化[7-12]。尽管研究证明电离辐射可以影响基因组DNA甲基化水平,但目前的研究大都是在动物细胞、肿瘤细胞而不是正常人的细胞中,从全基因组水平上来考察电离辐射对DNA甲基化的影响。而针对具体基因其甲基化受电离辐射的影响是怎样的,以及这些基因的分子功能,参与哪些生物学途径还不十分清楚。
基于此,本研究利用Illumina 450K甲基化芯片检测不同剂量(0.5、2.0 Gy)照射后人外周血淋巴细胞基因组DNA甲基化水平的变化,筛选甲基化水平发生显著性变化的基因。众所周知,电离辐射能够引起染色体畸变,而这些畸变的产生可能是因为DNA修复受阻的结果,所以本研究的目的是要探索受电离辐射影响的甲基化水平差异基因中是否有与DNA修复,维持染色体结构稳定相关的基因,为在其中寻找新型辐射损伤标志物奠定前期研究基础。
1 材料与方法
1.1 主要试剂
Tris-HCl粉末(货号H5135)和蛋白酶K购于Sigma Aldrich公司,十二烷基磺酸钠(SDS)粉末购于北京市东环联合化工厂。氯化钠(NaCl)粉末,无水乙醇及75%乙醇购于北京化工厂。乙二胺四乙酸(EDTA)粉末购于北京化学试剂公司。
1.2 细胞外照射
在知情同意的情况下抽取人外周血全血样本3份,本研究经中国疾病预防控制中心辐射防护与核安全医学所医学伦理委员会审核批准(伦理审查号LLSC2015-001)。将全血样本分为3组,室温下分别受到剂量为0.5和2.0 Gy的Co60γ射线的照射,以未照射样本为阴性对照组,剂量率为0.5 Gy/min。照射后将样品置于37℃培养箱2 h,然后提取DNA。放射源由北京师范大学北京辐射中心提供,源放射性活度为22.2 TBq,均匀照射野为25 cm×25 cm,样品距放射源距离为126 cm。
1.3 人外周血淋巴细胞全DNA提取
取EDTA-Na2抗凝血5 mL,置于50 mL有盖离心管中;加入5~8倍体积冷蒸馏水,反复颠倒混匀,冰中放置5 min后于4℃、4 000 r/min离心20 min;缓慢倾倒上清,在沉淀中加入4℃预冷0.9%NaCl(体积同上一步),轻柔混匀沉淀,4℃、4 000 r/min离心20 min,弃上清;沉淀中加入2 mL裂解液,彻底打碎沉淀,加入10%的SDS 100 μL,混匀;加入10 mg/mL蛋白酶K(至终浓度为200 μg/mL),混匀,55℃消化3 h;加入6 mol/L的NaCl 0.7 mL,剧烈震荡20 s后5 000 r/min,离心20 min,将上清移至另一有盖离心管中;加入2倍体积无水乙醇,反复颠倒混匀至出现絮状DNA沉淀,挑出DNA至另一离心管中;75%乙醇洗涤DNA 2遍,将DNA放置于-20℃备用。
1.4 IIIumina 450K甲基化芯片实验
进行芯片实验时每份样本每个剂量点设置3个平行样本。扫描原始数据,获得每个位点原始信号值,然后依次进行荧光偏倚矫正、quantile归一化;对于探针类型偏椅,对前一步校正后的甲基化水平进行校正。甲基化芯片实验委托北京博奥晶典生物技术有限公司进行[13-15]。
1.5 数据分析
对于甲基化水平差异分析,基于校正后的甲基化水平,采用empirical Baye statistics进行差异甲基化分析,同时针对多重假设检验问题,计算误判率校正的P值(P校正),选取P校正≤0.05的点为差异位点;对得到的差异位点分布情况进行统计学分析,统计位点映射的甲基化水平差异基因,将甲基化水平差异基因进行GO功能富集分析,富集的标准为P<0.05。
2 结果
2.1 甲基化水平差异位点的数量及分布
本实验一共扫描了473 760个位点,排除X、Y染色体上的位点。甲基化水平差异位点的数量如图1所示。图1A中,0.5 Gy γ射线照射组与阴性对照组相比,甲基化水平升高的位点有21 051个,甲基化水平降低的位点有9 075个。2.0 Gy γ射线照射组与阴性对照组相比,甲基化水平升高的位点有14 850个,甲基化水平降低的位点有9 284个。可以看出,随着照射剂量的升高,甲基化水平升高的位点数量在减少,降低的位点数量有所增加。图1B中,2.0 Gy照射组与0.5 Gy照射组相比,甲基化水平升高的位点有12 571个,甲基化水平降低的位点有13 884个。甲基化水平降低的位点数目多于甲基化水平升高的位点数目。

图1 照射组与对照组相比甲基化水平差异位点数量变化
甲基化水平差异位点分布如图2所示。分布区域的划分是按与CG岛的距离命名的。“Open sea”是指距离CG岛两端4 kb以外的区域,“shelf”是指距离CG岛两边2~4 kb的区域,“shore”是指距离CG岛两边0~2 kb的区域。从图中可以看出,无论是0.5 Gy γ射线照射组还是2.0 Gy γ射线照射组,差异位点主要分布在“Open sea”,约占43%。当剂量升高时,分布在CPG岛中的差异位点数量减少,而在“shore”区域的差异位点数量增多。

图2 照射组与对照组相比甲基化水平差异位点分布变化
2.2 甲基化水平差异基因的数量
得到差异位点后,我们对各位点映射的基因情况进行了统计,计算出了甲基化水平差异基因的数量,如图3所示。图3A中,0.5 Gy γ射线照射组与阴性对照组相比,甲基化水平升高的基因有8 995个,甲基化水平降低的基因有4 826个。2.0 Gy γ射线照射组与阴性对照组相比,甲基化水平升高的基因有7 884个,甲基化水平降低的基因有5 555个。可以看出,随着照射剂量的升高,甲基化水平升高的差异基因数量减少而降低的差异基因数量增加。对于同时在0.5 Gy和2.0 Gy两个剂量点下甲基化水平均有差异的基因,水平升高的基因数目(1 311个)明显大于甲基化水平下降的基因数目(286个)(图3B)。

图3 照射组与对照组相比甲基化水平差异基因数量变化
2.3 GO功能富集分析
DNA甲基化受许多细胞内途径的影响,但都涉及哪些途径和功能还不十分清楚,快速有效的基因注释对进一步识别基因,研究基因的表达调控机制,分析基因产物的相互作用关系具有重要意义,因此有必要描绘甲基化水平差异基因显著富集在哪些功能。为了寻找不同样品间差异基因可能和哪些基因功能的改变有关,我们用统计学方法对0.5和2.0 Gy γ射线照射下甲基化水平均有差异的基因进行了GO功能富集分析。如图4所示,富集在3个水平上进行:生物途径、细胞定位和分子功能。斜线表示背景基因分类到注释中的数量,实色表示差异基因分类到注释中的数量。根据分类到各个注释中差异基因与背景基因的比例,GO功能在生物途径上排在首位的是“细胞过程”(富集度=5.86),在细胞定位上排在首位的是“细胞”(富集度=7.48),在分子功能上排在首位的是“结合”(富集度=5.27),说明分类到这3个注释中的基因其甲基化对电离辐射是比较敏感的。

图4 0.5和2.0 Gy γ射线照射下甲基化水平均有差异的基因GO 功能富集分析
通常人们更关心基因产物参与的生物学途径和分子功能,因此将注释到“细胞过程”和“结合”的基因进行了进一步细分。表1中列出了P<0.05的情况下,富集度从大到小排前10名的注释。
从表中可以看出,甲基化水平差异基因具有与调节转录作用相关的功能,如基因表达(GO:0010467)、结合转录调控区域DNA(GO:0044212)、结合核酸转录因子活性(GO:0001071)和RNA结合(GO:0003723)这样的注释被排在了前列。
除了参与调控基因表达外,DNA甲基化还对DNA修复、改变染色体结构和维持染色体结构稳定起重要作用。我们在核苷酸结合(GO:0001882)中初步筛选了一些基因。RAD54L,编码产物为DEAD样螺旋酶超家族,参与DNA双链断裂的同源重组修复;SMC1B,编码产物为染色质粘连蛋白家族成员,参与有丝分裂过程的DNA重组;INIP,编码产物为DNA单链结合复合体亚基,对维持基因组稳定起重要作用;HIST1H4K,编码产物为组蛋白H4家族成员,对维持核小体结构稳定起重要作用。芯片结果显示这些基因的甲基化水平随照射剂量或显著上升,或显著下降。但能否作为辐射损伤标志物还需进一步研究。
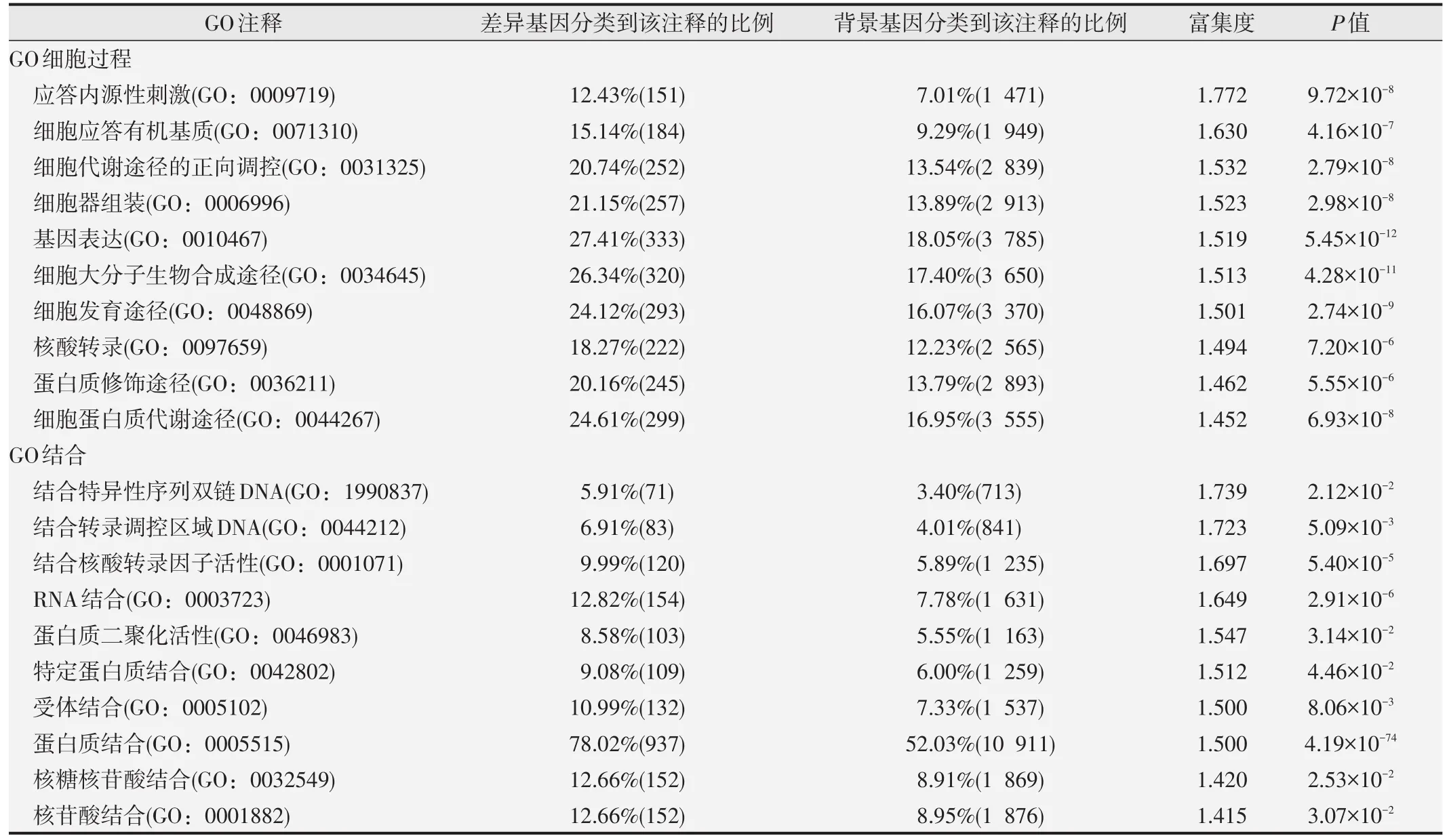
表1 “细胞过程”及“结合”二级分类下按富集度大小排名前10的注释
3 讨论
本研究首次利用Illumina 450K甲基化芯片测定了在60Co γ射线照射下正常人外周血淋巴细胞DNA甲基化的变化。筛选了受电离辐射后的甲基化水平上调的基因有1 311个,甲基化水平下调的基因有286个。将这些甲基化水平差异基因进行GO功能富集分析,结果显示在生物途径、细胞定位和分子功能3个水平排在首位的分别是“细胞过程”(富集度=5.86),“细胞”(富集度=7.48)和“结合”(富集度=5.27)。同时在核苷酸结合(GO:0001882)中筛选出与DNA修复、维持染色体结构稳定相关的基因,RAD54L、SMC1B、INIP和HIST1H4K,为寻找新型辐射损伤标志物奠定前期研究基础。
以往的研究认为DNA甲基化参与转录调控和基因表达[2,16-18]。本研究的芯片结果也显示,甲基化水平差异基因显著富集在基因表达(GO:0010467)、结合转录调控区域DNA(GO:0044212)、结合核酸转录因子活性(GO:0001071)和RNA结合(GO:0003723)。另外注释到结合特异性序列双链DNA的基因中,有多个编码锌指蛋白的基因。锌指蛋白在转录和翻译水平上对基因表达起重要的调控作用[19-20]。显著富集的甲基化水平差异基因大部分是甲基化水平升高的基因。研究表明,高度甲基化的序列往往被包装在异染色质中,而低度甲基化或非甲基化的序列则处在转录活跃的低凝聚态的染色质中。因此基因的甲基化水平升高会降低其转录活性,影响编码产物的生成。所以当辐射剂量升高时,细胞产生更多的损伤,这可能与相关基因甲基化水平改变,影响基因表达进而影响DNA损伤应答或修复有关。
作为良好的辐射损伤标志物,其水平受辐射剂量影响的趋势要有一致性。尽管大多数报道认为电离辐射可以引起全基因组DNA的低甲基化。但有研究得出全基因组DNA甲基化水平随辐射剂量的升高而升高的结果[21]。另有研究认为全基因组DNA甲基化水平随辐射剂量呈先升高后下降或先下降后升高的趋势[22]。还有研究发现DNA甲基化水平随电离辐射的变化具有组织特异性,其水平变化在不同组织可能呈现相反的趋势[11,23]。因此,将DNA总甲基化水平作为辐射损伤标志物可能是不合适的。所以有必要筛选具体的甲基化水平差异基因。
电离辐射诱导细胞产生染色体畸变、微核和核质桥等细胞遗传学改变,其中染色体畸变和微核早已用于辐射生物剂量估算。细胞之所以产生这些异常可能是因为电离辐射导致DNA修复受阻或产生错误修复,进一步可能是因为与修复相关或染色体结构维持相关基因的甲基化水平发生改变。因此在涉及DNA修复、维持染色体结构稳定等途径的基因中寻找辐射损伤标志物更具有针对性。本研究初步筛选出的甲基化水平差异基因RAD54L、SMC1B、INIP和HIST1H4K能否成为新型辐射损伤标志物还需进一步研究。
综上所述,本研究利用Illumina 450K甲基化芯片筛选出正常人外周血淋巴细胞甲基化水平差异基因,可进一步研究与DNA修复、维持染色体结构稳定相关的基因甲基化水平作为辐射损伤标志物的可行性。
