纳米氧化铈颗粒对人肺腺癌耐顺铂细胞辐射敏感性的影响
2019-12-03王春燕曲功霖王成芳齐雪松
王春燕,佟 鹏,李 辰,邵 帅,曲功霖,苟 巧,王成芳,齐雪松*
(中国疾病预防控制中心辐射防护与核安全医学所,辐射防护与核安全应急中国疾病预防控制中心重点实验室,北京 100088)
我国的肺癌发病率和死亡率在恶性肿瘤中居首位[1],其中非小细胞肺癌(non-small-cell lung cancer,NSCLC)的发病率约占肺癌发病率的80%。铂类药物是一线化疗药物,但多次应用后易产生耐药性,因此,放化疗结合是治疗中晚期肺癌常采取的手段[2]。
NSCLC的辐射敏感性低,常规放疗疗效不佳[3]。临床急需有效的手段增加其放射敏感性,目前相关的研究涉及热疗、放射增敏剂等[4-5]。纳米氧化铈晶体有较多的氧空位和比较低的氧化还原电势,活性较高[6]。在对胰腺癌放射敏感性的研究中发现,纳米氧化铈联合放疗可诱导胰腺癌细胞凋亡[7]。本项目以人肺腺癌耐顺铂细胞(A549/DDP)为研究对象,观察纳米氧化铈与γ射线联用的杀伤能力,为NSCLC的辐射增敏提供有效的手段。
1 材料与方法
1.1 细胞和受试物
人肺腺癌耐顺铂A549/DDP细胞,购自中国医学科学院肿瘤医院肿瘤研究所)。采用含10%FBS、100 U/mL青霉素和100 μg/mL链霉素的1640培养基,在37℃、CO2体积分数为5%条件下常规培养。纳米氧化铈悬液由有色金属研究院合成并赠予,一次粒径为2~4 nm。将纳米氧化铈与超纯水混合配置成10 mmol/L贮存液(混悬液),备用。
1.2 主要试剂和仪器
CCK-8细胞增殖毒性检测试剂盒购自同仁化学研究所,姬姆萨染液即用型购自北京雷根生物技术有限公司,FITC-Annexin V凋亡检测试剂盒购自美国BD公司,细胞周期检测试剂VybrantDycCycle Orange染料购自英潍捷基公司,乙酰甲酯荧光探针(BCECFAM)购自美国Sigma公司。二氧化碳培养箱为美国Thermo公司生产,全波长酶标仪为美国Thermo公司生产,流式细胞仪为美国BD公司生产,钴源为北京师范大学辐照中心所有。
1.3 确定辐射半数抑制剂量和纳米氧化铈浓度
细胞分为7组,分别对照组以及2、4、8、16、24、32 Gy γ射线照射组,每组6个平行样。细胞接种于96孔板中,每孔2 000个,24 h后给予60Co γ射线照射,剂量率为1 Gy/min,照射后连续培养5 d,用CCK-8检测试剂盒检测细胞的增殖抑制率,建立剂量-效应曲线,并计算得到A549/DDP细胞的半数抑制剂量。在细胞培养液中分别加入终浓度为500、50、5、0.5、0.05、0.005、0.000 5和0.000 05 μmol/L 的纳米氧化铈,24 h后给予半数抑制剂量的60Co γ射线照射,照后24 h用CCK-8检测试剂盒检测细胞的增殖抑制率,根据每种细胞的增殖抑制率变化选定纳米氧化铈浓度。
1.4 细胞集落形成实验
细胞按照射剂量分为6组,分别为0、1、2、4、6和8 Gy,接种于直径10 cm的培养皿中,每组6个皿,每皿112个。待细胞贴壁后每组取3皿加入终浓度为0.000 5 μmol/L的纳米氧化铈,作用24 h,这些细胞为纳米氧化铈组,其余未添加纳米氧化铈的细胞为照射组,将所有细胞分别给予上述剂量的60Co γ射线照射,37℃、CO2体积分数为5%的条件下连续培养20 d。弃培养基,每个培养皿中加入3.5 mL甲醇,固定10 min。然后用Giemsa染色,冲洗晾干后,细胞集落计数,用于存活分数的计算。根据单击多靶模型SF=1-(1-e-kD)n计算细胞的平均致死剂量(D0)、靶数(n)准阈剂量(Dq)和2 Gy照射后的细胞存活分数(SF2)。根据线性二次模型SF=aD-bD2计算一次断裂系数(a)、二次断裂系数(b)和2 Gy照射后的细胞存活分数(SF2)。
1.5 流式细胞术检测
1.5.1 实验分组和处理将细胞分为阴性对照组,照射组,以及纳米氧化铈低、中、高浓度(分别为0.000 5、0.05、5 μmol/L)处理组。阴性对照组细胞不进行任何处理;照射组细胞给予半数抑制剂量60Co γ射线照射,剂量率为1 Gy/min;纳米氧化铈处理组细胞于贴壁后加入不同浓度的纳米氧化铈,24 h后给予半数抑制剂量60Co γ射线照射,剂量率为1 Gy/min。照后24 h用25%胰酶消化细胞,制备细胞悬液,检测细胞凋亡率、细胞周期和胞内pH值。
1.5.2 细胞凋亡率检测按照FITC-Annexin V凋亡检测试剂盒操作规程进行实验,流式细胞术进行细胞凋亡率检测。
1.5.3 细胞周期检测按细胞周期检测试剂VybrantDycCycle Orange染料操作规程标记细胞,流式细胞仪进行检测。
1.5.4 细胞内pH值检测配制pH分别为5.78、6.28、6.78、7.24、7.69和8.48的标准溶液,把细胞分别混入到上述不同pH值的溶液中,加入BCECF-AM避光孵育,流式细胞仪检测,获得FL1/FL2比值(荧光强度比值),建立标准曲线。制备的细胞悬液加入BCECF-AM避光孵育,Hank’s平衡盐溶液(HBSS),清洗重选后过膜,流式细胞仪检测,计算FL1/FL2比值,按标准曲线求出pH值。
1.6 统计学方法
采用SAS 9.3统计软件进行数据统计。所有数据均进行方差齐性检验,若方差齐,采用等方差t检验;若方差不齐,编秩后采用 LSD-t检验。
2 结果
2.1 确定照射剂量和纳米氧化铈使用浓度
通过不同剂量的γ射线诱导A549/DDP细胞,计算抑制率,建立剂量-效应曲线(图1A),确定γ射线诱导其的半数抑制剂量为25 Gy。采用用不同浓度纳米氧化铈处理后给予半数抑制剂量的γ射线作用,与对照组相比,各浓度组(分别为500、50、5、0.5、0.05、0.005、0.000 5和0.000 05 μmol/L)的细胞增殖抑制率均 显 著 增 加 (tLSD=6.63、 4.12、 3.53、 4.12、 2.65、2.41、2.36和2.5,P<0.05),差异均有统计学意义(图1B)。结合文献[7]确定后续实验使用的终浓度为0.000 5、0.05和5 μmol/L。

图1 γ射线单独作用和纳米氧化铈处理后给予γ射线照射对A549/DDP细胞增殖的影响
2.2 纳米氧化铈处理对γ射线照射A549/DDP细胞存活的影响
通过细胞集落形成实验,可观察到,与单独照射组细胞比较,低浓度纳米氧化铈处理24 h后给予半数抑制剂量γ射线照射可使A549/DDP细胞克隆数减少(图2A)。未照射且未添加加纳米氧化铈组得到细胞的接种效率约为95.6%,按此计算各组细胞存活分数,建立单击多靶模型和线性二次模型。同样可以看出,与单独照射比较,纳米氧化铈处理可使A549/DDP细胞存活分数下降(图2B、2C)。

图2 纳米氧化铈处理后给予γ射线照射的A549/DDP细胞存活的浓度效应关系
单击多靶模型和线性二次模型的参数由表1列出。与单独照射比较,单击多靶模型分析发现纳米氧化铈处理后细胞的平均致死剂量(D0)、准阈剂量(Dq)和2 Gy照射后的细胞存活分数(SF2)均下降,虽然靶数(n)没有增加,但经线性二次模型分析发现纳米氧化铈处理后细胞的SF2,且a/b比值升高,表明低浓度纳米氧化铈可促使A549/DDP细胞较早出现射线诱导的损伤效应,与单纯照射相比较,增敏比(SER)提高至1.1倍。

表1 单击多靶模型和线性二次模型结果比较
2.3 纳米氧化铈处理对γ射线照射A549/DDP细胞凋亡的影响
采用流式细胞术对纳米氧化铈处理后γ射线照射A549/DDP细胞进行凋亡率的检测,结果见图3,发现纳米氧化铈低浓度组的凋亡率为0.6%,比单独照射组的凋亡率0.17%明显增加,且差异有统计学意义(t=5.42,P<0.05)。
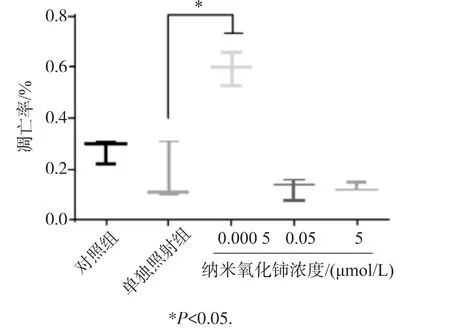
图3 纳米氧化铈处理后γ射线照射A549/DDP细胞凋亡的变化
2.4 纳米氧化铈处理对γ射线照射A549/DDP细胞周期的影响
由图4可见,单独照射组S期细胞百分比为46.3%,采用低、中、高浓度纳米氧化铈处理后给予射线照射的S期细胞百分比分别为71.2%、72.1%和84.3%,各浓度组纳米氧化铈可导致细胞S期阻滞,差异有统计学意义(t=3.14、4.08、6.81,P<0.05)。

图4 纳米氧化铈处理后γ射线照射A549/DDP细胞周期的变化
2.5 纳米氧化铈处理对γ射线照射A549/DDP细胞内pH的影响
通过对pH标准溶液的测量,建立标准曲线y=0.19x+0.15,R2=0.97。根据标准曲线,计算得出各样品的胞内pH值。如图5所示,单独照射组的胞内pH值为6.06,纳米氧化铈低、中、高浓度组pH值分别为6.1、6.11和6.13。与单独照射组相比,纳米氧化铈低和高浓度组的差异有统计学意义(t=2.86、4.93,P<0.05)。

图5 纳米氧化铈处理后γ射线照射A549/DDP细胞内pH值的变化
3 讨论
随着纳米技术的发展,纳米物质辐射增敏的相关研究逐渐增多。盐藻依聚糖-二氧化锰的纳米颗粒可以缓解肿瘤组织的乏氧现象,增强胰腺癌细胞对X射线的辐射敏感性[8]。纳米金胶体[9]和纳米银颗粒[10]均可诱导神经胶质瘤干细胞,使其对X射线的辐射敏感性增强。氧化铁的纳米复合颗粒可通过降低U251细胞的自噬,使其对X射线是辐射敏感性增强[11]。纳米硅颗粒诱导HER2过表达的乳腺癌细胞对X射线的辐射敏感性,使其凋亡增加[12]。但纳米颗粒对γ射线的增敏作用的研究并不多见。
本项目的研究发现低浓度纳米氧化铈处理后γ射线照射使A549/DDP细胞的SF2降低、a/b比值和SER值升高,表明在纳米氧化铈的作用下,细胞对射线的敏感性增强,且增敏作用与N值无关,与纳米氧化铈颗粒更易诱导细胞出现早期损伤有关。低浓度纳米氧化铈处理后γ射线照射A549/DDP细胞凋亡率明显增加,表明纳米氧化铈的浓度在0.000 5 μmol/L时更易使细胞发生凋亡,此浓度与纳米氧化铈致神经胶质瘤细胞辐射增敏的浓度一致[13]。低浓度的纳米氧化铈颗粒还可使A549/DDP细胞的S期阻滞明显增加,这可能是细胞凋亡增加的原因。由于肿瘤细胞需要借助糖酵解途径对葡萄糖加以吸收,以生成能量来促进自身的生长[14],因此其生存的微环境中乳酸堆积,pH偏酸,可使一些碱性化疗药物失效,产生耐药性[15]。而纳米氧化铈本身具有类似超氧化物歧化酶的作用[16],可调节细胞外的偏酸性环境,随后的射线作用提高了A549/DDP细胞内pH值,破坏了细胞的稳态,促使细胞凋亡或死亡,这可能是低浓度的纳米氧化铈颗粒致A549/DDP细胞辐射敏感性增强的又一原因。
辐射增敏一直是临床放疗过程中亟待解决的难题,尤其是对辐射敏感性较低的癌症或肿瘤急需找到低毒、高效的增敏剂。纳米氧化铈以其易获得、易纯化、成分单一等优势,成为一种有潜力的辐射增敏剂,越来越受到研究者的关注[17]。
(感谢有研稀土新材料股份有限公司稀土材料国家工程研究中心赠送纳米氧化铈悬浮液和对本实验研究的支持)
