磁性壳聚糖微球的制备及其固定化乳糖酶的研究
2019-12-03许可曾丹林吴洁王园园杨媛媛王光辉
许可,曾丹林,吴洁,王园园,杨媛媛,王光辉
(武汉科技大学 化学与化工学院 湖北省煤转化与新型炭材料重点实验室,湖北 武汉 430081)
壳聚糖(CS),是唯一大量存在于自然界中的阳离子碱性多糖[1],其分子链上含有大量的氨基和羟基,具有高反应活性,在化工、生物、材料、食品和环保等[2-5]领域具有广泛的应用价值。
乳糖酶,被广泛应用于乳制品的加工和治疗乳糖不耐症[6-7]。近年来,将兼具高分子材料和磁性物质双重特性的磁性壳聚糖用于固定化乳糖酶成为了学者们的研究热点,以其为载体制备的固定化酶活力高、半衰期长、性能稳定[8]。
本文以磁性壳聚糖微球为载体,制备了固定化乳糖酶,以酶活力为考察指标,研究了不同固定化条件对制备固定化酶的影响,以及固定化酶的酶学性质,为其工业应用提供理论依据。
1 实验部分
1.1 试剂与仪器
壳聚糖、乳糖酶(来源于米曲霉)、邻硝基苯酚(ONP)、邻硝基苯酚-β-半乳糖苷(ONPG)、甲醛、Span 80、冰醋酸、乙醇、FeCl3·6H2O、柠檬酸三钠、尿素、聚乙二醇、聚丙烯酰胺均为分析纯。
100 mL水热反应釜,由上海予名仪器设备有限公司提供;UV1800-PC 型紫外可见光分光光度计;Vertex70 型傅里叶红外光谱仪;Nova 400 Nano型扫描电子显微镜。
1.2 实验方法
1.2.1 Fe3O4纳米粒子的制备 分别称取8 mmol柠檬酸三钠、4 mmol FeCl3·6H2O和12 mmol尿素置于烧杯中,加入80 mL蒸馏水搅拌均匀至完全溶解,再加入0.6 g聚丙烯酰胺,搅拌溶解,再加入0.3 g聚乙二醇,溶解后将溶液转入反应釜中,200 ℃真空干燥箱中反应12 h,冷却至室温后,用磁铁分离,再经蒸馏水、无水乙醇反复洗涤,真空干燥得到磁性Fe3O4纳米粒子。
1.2.2 磁性壳聚糖微球的制备 量取20 mL 3%的醋酸壳聚糖溶液于圆底烧瓶中,加入一定量的Fe3O4磁性纳米粒子,超声分散30 min,将混合溶液加入到有160 mL液体石蜡溶液(3 mL Span 80)中,充分搅拌混合均匀,加入6 mL甲醛,40 ℃条件下反应1 h,然后用1 mol/L的NaOH溶液将pH调至9~10,升温至70 ℃,继续反应2 h,用磁铁收集沉淀物,用蒸馏水和无水乙醇反复洗涤,在真空干燥箱中60 ℃条件下干燥,得到磁性壳聚糖微球。
1.2.3 磁性壳聚糖微球固定化乳糖酶
1.2.3.1 固定化方法 将一定量的磁性壳聚糖微球(M-CS)加入到磷酸缓冲液中溶胀2 h,用磁铁收集溶胀后的磁性壳聚糖微球,再加入到一定浓度的乳糖酶磷酸缓冲液中,置于恒温振荡器上室温振荡1 h,于4 ℃条件下冰箱中静置,然后用磁铁将其沉淀在底部,倾倒出上层清液,得到磁性壳聚糖微球固定化乳糖酶,用磷酸缓冲液充分洗涤,最后于4 ℃冰箱中保存。
1.2.3.2 邻硝基苯酚(ONP)标准曲线的绘制 取一定量的邻硝基苯酚(ONP)于烧杯中,加入10 mL乙醇溶液使之完全溶解,用蒸馏水定容至1 000 mL,并混合均匀,分别吸取配制的溶液2,4,6,8,10,12,14 mL于100 mL容量瓶中,用NaHCO3溶液定容,稀释后的溶液浓度分别为0.02,0.04,0.06,0.08,0.10,0.12,0.14 μmol/mL,测定420 nm处吸光度,然后以邻硝基苯酚(ONP)浓度为横坐标,吸光度值为纵坐标,绘制标准曲线见图1。

图1 ONP标准曲线Fig.1 Standard curve of ONP
1.2.3.3 乳糖酶酶活测定方法 采用ONPG法测定乳糖酶酶活。
乳糖酶活力定义:以ONPG为底物,在一定条件下,每分钟催化ONPG生成1 μmol邻硝基苯酚(ONP)所需的乳糖酶酶量定义为一个酶活力单位(u)。
底物邻硝基苯酚-β-半乳糖苷(ONPG)在乳糖酶的作用下,可水解为邻硝基苯酚(ONP),邻硝基苯酚在碱性条件下呈黄色,且在波长420 nm处有吸收,因此结合ONP标准曲线可对其进行定量分析,从而测定乳糖酶的活力。
1.2.3.4 固定化酶酶活的测定 向一定量的固定化酶中加入磷酸缓冲液,40 ℃下保温5 min,加入3 mL 4 g/L的ONPG溶液,反应10 min后,加入2 mL Na2CO3溶液灭活,于分光光度计上测定波长420 nm处的OD值。
式中U2——加入的游离酶总活力;
k——ONP标准曲线的斜率,为5.9;
T——反应时间,为5 min。
2 结果与讨论
2.1 结构表征
2.1.1 SEM分析 图2为磁性壳聚糖微球的SEM图。
由图2可知,制得的磁性壳聚糖微球粒径在30~60 μm,微球形貌规整,球形较好,表面光滑,分布较为均匀无粘连。

图2 磁性壳聚糖微球的SEM图Fig.2 SEM of magnetic chitosan microspheres
2.1.2 FTIR分析 图3为壳聚糖(CS)、磁性壳聚糖微球(M-CS)和Fe3O4纳米粒子的红外光谱图。

图3 CS、M-CS和Fe3O4的红外光谱图Fig.3 FTIR spectra of CS,M-CS and Fe3O4
由图3可知,3 400 cm-1附近处吸收峰是由 —NH2和 —OH键的伸缩振动引起的,说明壳聚糖和磁性壳聚糖微球表面均含有大量的氨基和羟基。2 925 cm-1和2 860 cm-1处的吸收峰是由脂肪族C—H的伸缩振动引起的,1 060 cm-1处是由C—O—C伸缩振动引起的。对比壳聚糖和磁性壳聚糖微球可以看出,1 650 cm-1处出现新的特征峰,是由新出现的Shiff碱键(C≡N)特征峰引起的,这证明了交联剂的 —CHO与壳聚糖上的 —NH2发生了交联反应。此外,在磁性壳聚糖微球和Fe3O4谱线的570 cm-1处出现了Fe—O键的特征吸收峰,表明磁性壳聚糖中含有Fe3O4。
2.1.3 磁响应性分析(VSM) 图4是Fe3O4和磁性壳聚糖微球的磁滞回线。
由图4可知,两者均具有超顺磁性,Fe3O4和磁性壳聚糖微球的饱和磁化强度M分别达到37.83 emu/g和11.14 emu/g。当Fe3O4与壳聚糖形成复合物之后,饱和磁化强度M会有所降低,一方面是由于形成的磁性壳聚糖微球中磁性物质占比较小,另一方面也是由于制备磁性壳聚糖微球过程中Fe3O4会被氧化导致饱和磁化强度降低,仍具有较强的磁响应性。

图4 Fe3O4和磁性壳聚糖微球的磁滞回线Fig.4 Magnetic hysteresis of Fe3O4 and M-CS
2.1.4 XRD分析 图5是Fe3O4和磁性壳聚糖微球的XRD图谱。

图5 Fe3O4和磁性壳聚糖微球的XRD图谱Fig.5 XRD spectra of Fe3O4 and M-CS
由图5可知,各衍射峰与粉末衍射标准联合会(JCPDS)编制的标准粉末衍射PDF卡片19-0629的峰位置基本一致,各衍射峰分别为Fe3O4(220)、(311)、(400)、(422)、(511)和(440)的晶面衍射峰。表明磁性壳聚糖中含有Fe3O4,这与FTIR表征结果一致。磁性壳聚糖微球的谱线在2θ=10~28°出现了一个较宽的衍射峰,对应无定形碳碳面的衍射峰。
2.2 乳糖酶固定化条件的优选
2.2.1 pH对酶活性的影响 考察磷酸缓冲液pH分别为6.4,6.6,6.8,7.0,7.2对固定化乳糖酶酶活性的影响,测得的固定化乳糖酶相对活力见图6。

图6 pH值对酶活性的影响Fig.6 Effect of the pH on enzyme activity
由图6可知,随着pH值的增加,固定化酶的酶活性呈现先增后减的趋势,当磷酸缓冲液的pH为7.0时,固定化得到的酶活性最高。乳糖酶通过静电吸附固定在磁性壳聚糖微球表面,溶液酸碱度的变化会影响微球表面活性基团的电性,同时也会影响乳糖酶所带的电荷,从而影响乳糖酶在磁性壳聚糖微球表面的吸附[9],因此,在中性条件下,制备得到的固定化酶活性最高。
2.2.2 固定化时间对酶活性的影响 考察磁性壳聚糖微球对乳糖酶的吸附时间对酶活性的影响,分别于4 ℃条件下静置1,2,4,6,8 h进行固定化,测试固定化酶的酶活性,并计算相对酶活,结果见图7。
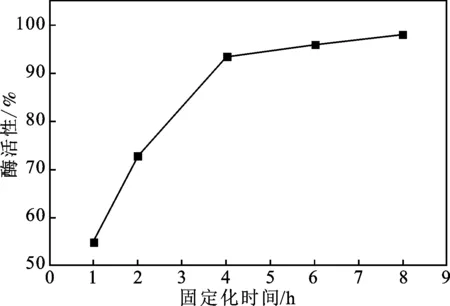
图7 固定化时间对酶活性的影响Fig.7 Effect of the immobilization time on enzyme activity
由图7可知,随着固定化时间的增加,酶活性逐渐增加,当固定化时间达到4 h时,酶活性的变化较小,趋于稳定,表明磁性壳聚糖微球对于乳糖酶的吸附趋于饱和,因此,选用的固定化时间为4 h。
2.2.3 加酶量对酶活性的影响 由于磁性壳聚糖微球对酶的固定量是一定的,在保证不造成酶的浪费的前提下尽可能的使磁性壳聚糖微球固定更多的酶,考察了酶液浓度分别为0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8 mg/mL时固定化酶酶活性以及酶活回收率,测定结果见图8。
由图8可知,随着乳糖酶浓度的增加,固定化酶的活力逐渐增加,而酶活回收率逐渐减小,当酶液浓度达到0.6 mg/mL时,若继续增加酶液浓度,固定化酶酶活性增加的幅度较小,而酶活回收率呈现急剧下降的趋势。这是由于磁性壳聚糖微球上可与乳糖酶结合的位点的数量是固定的,在结合位点饱和之前,固定化酶的活性会随着给酶量的增加而增加,当位点趋于饱和时,给酶量的增加对于固定化酶酶活性的提升影响较小,而且会使酶活回收率明显降低。因此,综合考虑酶制剂的成本、固定化酶活性以及酶活回收率,选择酶液浓度为0.6 mg/mL。

图8 加酶量对酶活性的影响Fig.8 Effect of enzyme addition on enzyme activity
2.3 固定化酶的酶学性质
2.3.1 固定化酶pH稳定性 25 ℃条件下,分别将游离乳糖酶和固定化乳糖酶置于不同pH(6.0,6.5,7.0,7.5,8.0,8.5)的磷酸缓冲液中,10 min后,测定固定化酶和游离酶的酶活性,计算相对酶活,结果见图9。

图9 固定化乳糖酶的pH稳定性Fig.9 pH stability of immobilized lactase
由图9可知,固定化酶和游离酶的活性都随着pH的增加呈现先上升后下降的趋势,游离酶在pH为7.0时活性最高,固定化酶在pH为8.0时活性最高。与游离酶相比,固定化酶的pH稳定性明显高于游离酶,特别是对碱的耐受性增加明显。这是由于在固定化过程中,酶与载体的多位点结合使固定化酶的构象更加稳定,降低了外部溶液对固定化酶分子结构的影响。此外,壳聚糖上含有大量的氨基和羟基,使其在碱性溶液中具有一定的缓冲作用,减弱外部溶液对酶蛋白和活性基团的破坏作用。在最适pH范围内,固定化酶相对于游离酶具有更宽的pH适用范围,表明固定化酶具有较好的pH稳定性。
2.3.2 固定化酶的温度稳定性 将固定化酶和游离酶在pH为7.0条件下,置于不同的温度条件下预热10 min,测定固定化酶和游离酶的酶活性,结果见图10。

图10 固定化乳糖酶的热稳定性Fig.10 Thermal stability of immobilized lactase
由图10可知,随着温度的升高,固定化酶和游离酶的活性均呈现降低的趋势,40 ℃下预热10 min后,固定化酶酶活性仍保持78.5%,而游离酶仅存47.4%,说明固定化后的乳糖酶热稳定性提高,可以适应相对较高的温度。固定化酶热稳定性提高是因为固定化后酶与载体之间相互作用,使得酶分子结构刚性增强,使得其抗拒热变性作用的能力提高,因此,固定化乳糖酶具有更好的热稳定性。
2.3.3 固定化酶的重复利用率 在25 ℃、pH为8.0的条件下,将固定化乳糖酶重复使用5次,测定每次使用后固定化乳糖酶的酶活性,结果见图11。
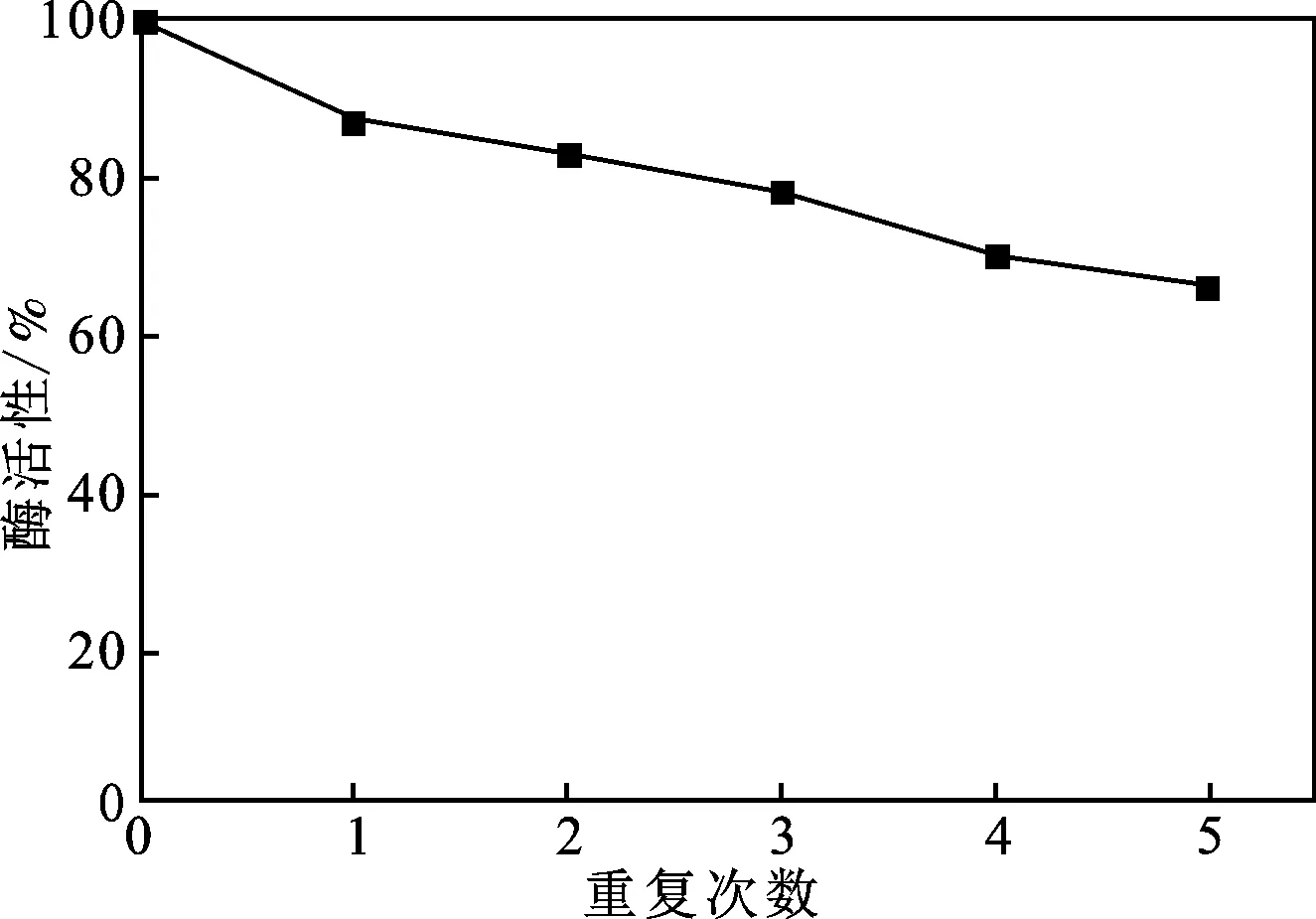
图11 固定化乳糖酶的热稳定性Fig.11 Thermal stability of immobilized lactase
由图11可知,随着使用次数的增加,固定化酶的酶活性逐渐降低,重复使用5次后,酶活性仍保留有65%以上。由于使用过程中磁分离都会有磁性粒子损失,使得酶活性降低,除去这一部分损失,可见固定化酶拥有良好的操作稳定性。
3 结论
以壳聚糖、FeCl3·6H2O为原料,采用乳化交联法制备了磁性壳聚糖微球。制备得到的磁性壳聚糖微球形貌规整,表面光滑,微球之间分散性较好,无黏连,表面存在着大量的 —NH2、—OH等官能团,且具有良好的磁响应性。以酶活力为考察指标,研究了不同固定化条件对制备固定化酶的影响,以及固定化酶的酶学性质。
(1)乳糖酶的最佳固定化条件为:固定化时间4 h,pH为7.0,乳糖酶酶液浓度为0.6 mg/mL,制得的固定化乳糖酶的酶活为58%,酶活回收率为35%。
(2)相较于游离酶,固定化乳糖酶的热稳定性和pH稳定性均有所提高,尤其是耐碱性,同时,固定化酶也拥有良好的操作稳定性,重复使用5次后,酶活性仍保留65%以上。
