氨基糖苷类抗生素质量控制进展
2019-12-03袁耀佐张玫金少鸿
袁耀佐 张玫 金少鸿
(1 国家药监局化学药品杂质谱研究重点实验室,南京 210019;2 江苏省食品药品监督检验研究院,南京 210019;3 中国食品药品检定研究院,北京 100050)
1 氨基糖苷类抗生素概述
氨基糖苷类抗生素(aminoglycoside antibiotics)是临床使用较早的一类抗生素,其与β-内酰胺类药物联合使用时有良好的协同作用,用药方便,价格低廉,有临床应用价值的品种达200余种,但部分品种临床不良反应特别是耳肾毒性严重限制了使用,目前临床常用的品种仅20种左右,它们的化学结构(图1~3)、来源、分类、原研公司等基本信息在相关文献中已有系统总结[1]。文献[2]按结构特点、抗菌谱和耐钝化酶等,将氨基糖苷类抗生素类抗生素发展分为3个阶段,或称为3代:第1代以卡那霉素为代表,其结构特点是完全羟基化的氨基糖与氨基环醇相结合,不抗铜绿假单胞菌;第2代以庆大霉素为代表,其结构中均含有脱氧氨基糖,具有抗铜绿假单胞菌的特点;第3代则是氨基环醇上1-N位取代的半合成衍生物,代表性品种有阿米卡星、奈替米星、依替米星、异帕米星等,其特点是保留了母体的抗菌活性,耳肾毒性较母核小,并对耐药菌的钝化酶有良好的抵御作用,其中依替米星为我国自主研发的一类新药;2018年由Achaogen开发并获美国食品和药品监督管理局(FDA)批准上市的新型氨基糖苷类抗生素普拉佐米星(plazomicin),可治疗多重耐药性的肠杆菌科菌引起的严重感染。可惜的是,由于“监管方面的不利因素以及唯一的抗生素品种市场非常有限,抗生素企业市场环境艰难、资金来源不断减少”等原因,Achaogen于2019年4月申请破产[3],但此新型氨基糖苷类抗生素普拉佐米星(500mg/10mL)已被WHO基本药物目录第21版(2019)收入。氨基糖苷类抗生素的历史变迁如图4所示。

图1 常见的4,6双取代脱氧链霉胺的氨基糖苷类抗生素的化学结构Fig.1 Chemical structures of deoxystreptamine aminoglycosides,4,6-disubstituted

图2 常见的4,5双取代脱氧链霉胺的氨基糖苷类抗生素的化学结构Fig.2 Chemical structures of deoxystreptamine aminoglycosides,4,5-disubstituted
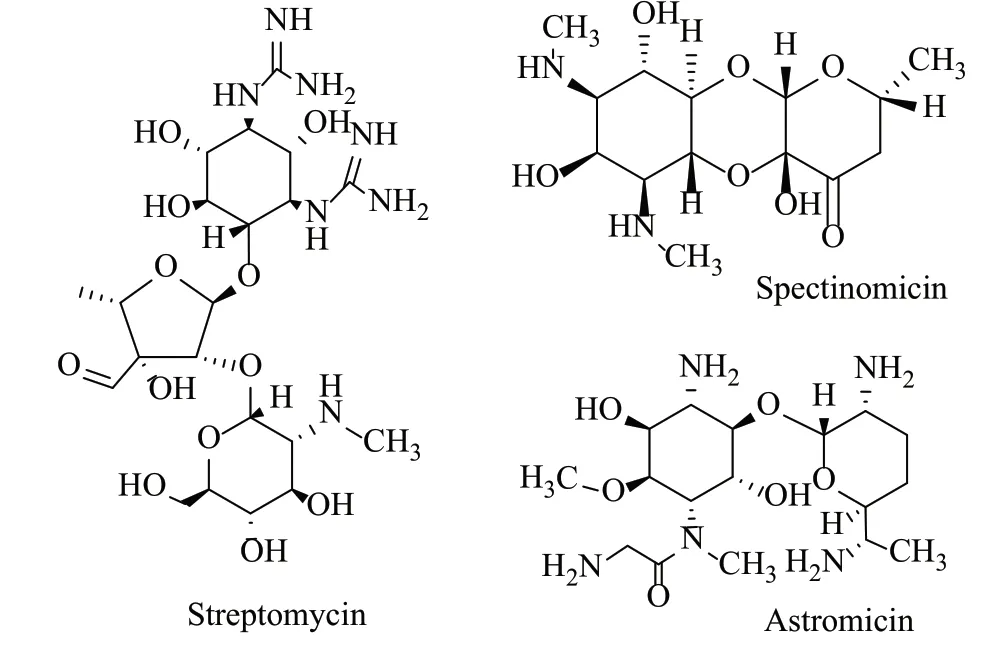
图3 药典中收载过的其它氨基糖苷类抗生素的化学结构Fig.3 Chemical structures of some other aminoglycosides antibiotics incorporated in pharmacopeia (s)
2 氨基糖苷类抗生素国内外药典标准现状

图4 氨基糖苷类抗生素变迁过程示意图Fig.4 Evolution paths of aminoglycosides antibiotics
目前全球药典约50余种[4],作为一类重要的抗生素,氨基糖苷类抗生素原料及其制剂在国内外主要药典均有收载,但各药典收载的品种、剂型不尽相同,设置的控制项目、测定方法及限度也不完全一致,为协调的标准,1990年ICH率先成立药典讨论工作组(Pharmacopeia Discussion Group,PDG),并成立专家工作组(Expert Working Group,EWG),试图在ICH成员国之间进行标准协调。2012年,WHO通过沟通、合作、协作和组建联盟等手段,也在积极寻求药典标准的一致性,但迄今为止,效果甚微。为了方便读者了解氨基糖类抗生素国内外药典标准的现状,特将中国药典2015年版(ChP2015)、美国药典42版-处方集37版(USP42-NF37)、英国药典2019(BP2019)、韩国药典第10版(KPX)、印度药典2010年版(IP2010)、国际药典第8版(Ph.Int.8th)中氨基糖苷类抗生素的原料及制剂的收载情况进行归纳总结,并对标准中相关内容进行评述。
2.1 药典收载情况
氨基糖苷类抗生素原料及其制剂在国内外主要药典均有收载,各国药典的收载情况如表1所示,原料共涉及16个品种,ChP2015收载最多,为14种。日本药典从第15版开始不再收载硫酸阿司米星,USP42-NF37、JP17等也不再收载硫酸西索米星及硫酸奈替米星的原料及制剂。
药典涉及剂型有注射液、注射用、片剂、缓释片、胶囊剂、软膏、眼用软膏、子宫输液(uterine infusion)、眼用溶液、口服溶液、注射用混悬液(injectable suspension)、滴耳液、雾化用溶液(nebulizer solution)、吸入液(inhalation solution)等,美国药典收载的剂型最为全面。氨基糖苷类抗生素主要以注射液、注射用以及外用制剂为主,也有用于肠道疾病治疗的口服剂型。药典中还有很多复方制剂,如USP42-NF37中新霉素的复方制剂就达53种之多。
2.2 药典标准分析与评述
国内外主要药典中氨基糖苷类抗生素原料药标准正文部分主要涉及如下14个项目:分子式(chemical formula)、化学名称(chemical name)、定义(definition)、生产工艺(manufacture/production)、性状(characters)、鉴别(identification/identities test)、检查(tests)、含量测定(assay)、类别(categories)、包装与贮藏(container and storage)、制剂(formulation)、杂质列表(impurities)、标签(labeling)、补充要求或信息(additional requirements/additional information)。不同品种的氨基糖类抗生素药典标准收载的主要项目基本一致,但因监管体系、体例要求、思维方式乃至习惯沿袭等不同,也出现部分收载项目及具体要求有较大的差异。在药典标准执行过程中发现,有些项目执行过程中会出现分歧,本部分主要针对需要关注或者容易出现争议的项目进行讨论。至于制剂方面,由于剂型种类较多,考虑篇幅,本文不进行具体介绍。

表1 氨基糖苷类抗生素原料在国内外主要药典的收载情况Tab.1 List of pharmaceutical substance of aminoglycosides adopted in the main pharmacopeias
2.2.1 性状
性状项在大多数药典中为强制执行项目,一般包含颜色、状态、臭味、引湿性等,中国药典通常还会将溶剂中的溶解度、比旋度等物理参数列在性状项中。该项目执行过程会出现很多问题,如(1)臭味需要实验者去闻和尝,对检验者健康存在潜在风险;(2)形状和颜色因为主观判断,容易出现争议;(3)溶解度也会因工艺不同出现偏差等。为此,USP中性状项已经不再列入正文,而是在Reagents and reference table中以“Description and relative solubility”形式出现,只作为参考信息,不作为强制执行项目。另外需要提醒的一点还有“引湿性”,以往药典描述比较笼统,各国药典均没有一个具体的测定方法,中国药典从2015年版开始,制定了“9103药物引湿性试验指导原则”,规定了具体的测定方法及标准。中国药典注意到上述问题,正在着手修订相关内容,如中国药典四部中部分品种已经将容易出现争议的性状内容删除,部分有重要信息提示的内容也是以“注”的形式体现。
2.2.2 鉴别
目前常见氨基糖苷类抗生素药典方法如表2所示。表中显示,由于绝大部分氨基糖苷类抗生素无紫外特征吸收,目前常规的仪器分析方法如UV,HPLC-UV均不适用;通常情况下,红外分光光度法(IR)因其谱图能很好地反映特征官能团而具有较佳的专属性,但对于氨基糖苷类抗生素,由于大多数特征基团均为氨基和羟基,IR对该类产品的区分力不强,因此,有采用化学显色和薄层色谱(TLC)进行补充,中国药典及欧洲药典中则采用了专属性较佳HPLC方法;在欧洲药典9.0(Ph.Eur9.0)和日本药局方17版(JP17)的妥布霉素标准中,还将核磁共振氢谱应用于鉴别。在欧美药典中,还会采用熔点、比旋度等理化特征作为鉴别项目,如硫酸卡那霉素在Ph.Eur.9.0中把熔点作为鉴别的方法之一。
2.2.3 检查
国内外药典标准分析结果显示,氨基糖苷类抗生素原料药检查包含“比旋度、酸度、溶液的澄清度与颜色、硫酸盐、有关物质/特定杂质、残留溶剂、干燥失重/水分、重金属、组分组成、可见异物、不溶性微粒、异常毒性、细菌内毒素/热源、降压物质、无菌、结晶性、抽针试验”等17个项目,限于篇幅,本文主要就药典标准中方法、限度等有较大差异的项目进行分析。

表2 主要药典中氨基糖苷类抗生素鉴别方法一览表Tab.2 List of the identification methods of aminoglycosides antibiotics in some pharmacopoeias
(1)比旋度:比旋度可以反映产品的纯度,如硫酸新霉素为新霉素B和新霉素C混合物(Ph.Eur.9.0要求新霉素C不小于15.0%),其比旋度要求在“+53.5~+59.0”;而高纯度的新霉素B(福莱霉素,framycetin sulfate,要求新霉素C不得过3.0%),其比旋度要求在“+52.5~+55.5”;有时还可以作为鉴别项的一部分,如JP17中硫酸卡那霉素(以卡那霉素A为主,卡那霉素B不得过4%)的比旋度要求在“+103~+115”,而硫酸卡那霉素B(bekanamycin sulfate,纯度不低于97%)比旋度要求为“+102~+116”。
(2)硫酸盐与酸碱度:现有药典收载的原料中,除盐酸大观霉素外,其余均为硫酸盐,氨基糖苷类抗生素分子中含有多个氨基,其可结合具体数目的硫酸根,如2分子依替米星结合5分子硫酸根;但对于发酵来源的氨基糖苷类抗生素,有些硫酸根数目不明确,如硫酸卡那霉素;还有些品种可能会出现不同硫酸盐结合率的多个产品,如阿米卡星有结合1.8分子和2分子的硫酸根的产品,因此,标准中需要控制硫酸盐的含量。传统的测定硫酸盐含量的方法采用络合滴定法,实验中发现滴定突跃往往不明显,很难判断终点,导致测定结果误差大。中国药典采用HPLC-ELSD法测定氨基糖苷类抗生素中硫酸盐含量,还有不少文献报道采用离子色谱法测定硫酸盐的含量[5],从误差的角度分析,离子色谱方法比较准确,但其检验成本相对较高,因此,在实际工作中,需要根据实验目的进行方法选择。
还有研究显示,组分单一的氨基糖苷类抗生素如核糖霉素,其硫酸盐含量与其特定溶液的pH之间呈明显的负相关[6],但是对于多组分氨基糖苷类抗生素如硫酸庆大霉素和硫酸新霉素,中国药典与欧美药典中硫酸盐限度要求一致,但pH值的限度有所差别,导致上述差异的可能原因是由于国内外菌种来源、发酵工艺等差异导致组分分布的差别。因此,在质量与疗效一致性评价过程中,不能简单比较药典的异同,而是需要通过物质基础分析来探讨导致上述差异的内在原因。另外,硫酸盐的含量还与主成分的效价或含量直接相关。
(3)溶液的颜色与澄清度:氨基糖苷类抗生素的原料药药典标准中,几乎全部有溶液的颜色与澄清度检查项,该项目是控制质量的重要环节,其对有关物质等杂质控制的重要补充。其中,溶液的颜色是用于控制有色杂质,而澄清度则是控制不溶性杂质。
溶液的颜色测定方法主要有目视比色法、紫外分光光度法及色差计法3种,但对比发现,中国药典和欧美日药典在该检测项有较大不同。而对于同一品种,国内外对该项目的要求差异还很大,以硫酸庆大霉素为例,中国药典要求“溶液应澄清无色,如显色如显浑浊,与1号浊度标准液比较,均不得更浓;如显色,与黄色或黄绿色2号标准比色液比较,均不得更深”。而欧洲药典规定“溶液应澄清无色;如显色,与合适颜色的6号标准比色液比较,均不得更深”。从字面看,二者差异很大,尤其在颜色的要求方面,但对药典相关通则研读发现,中国药典与欧美药典的标准色系完全不同(如中国药典规定几乎无色为供试品溶液颜色不深于相应色调0.5号标准比色液,欧洲药典则规定不深于相应色调的9号标准比色液),周怡[7]在其研究论文“溶液颜色检查方法”判定标准色系模型的建立与应用”中详细介绍了进行溶液颜色检查的原因,分析了方法间的差异,最后利用色差计法,建立溶液颜色色系模型分析中、欧药典各色系在模型中所处位置,确定利用色系模型进行溶液颜色判定的方法,弥补了现有结果判定方法不能统一的不足,为进行溶液颜色检查提供了新的思路。根据检验的原理,比较现有溶液颜色检查的3种方法,说明利用色差计进行检验的优势。上述研究阐明了目前在该项目国内外标准差异的原因所在,为协调解决国内外药典规定的差异提供理论和实践方面的支持。
(4)有关物质:有关物质是控制产品质量一致性的关键指标,而色谱技术是控制有关物质和组分的最有效手段,色谱技术的发展直接反映在有关物质控制水平上。但对于氨基糖苷类抗生素,由于其为强极性物质,在常用的反相色谱体系下保留很弱,而且绝大多数氨基糖苷类抗生素无特征紫外吸收基团,无法应用常规的紫外方法进行检测,这些都给该类产品有关物质和组分测定带来挑战。但是,近年来,随着色谱分离及检测技术的发展,多种分离及检测技术均得到运用,相关的研究进展已经有综述报道[1,8],但有些研究进展并没有及时体现在国内外药典标准中,药典中方法控制现状如表3。中国药典收载的14个氨基糖苷类抗生素,有11个品种的有关物质均采用HPLC-ELSD法进行控制,由于与ELSD检测器相兼容的流动相需要挥发性,这限制了流动相优化的空间,使得现有药典的色谱条件分离能力有限,部分品种的主峰中还会包裹相邻杂质,为此,中国药典借鉴欧美药典的做法,引入脉冲安培电化学检测器,并在2015年版依替米星标准中首载HPLC-PAD的四波形电位法用于有关物质和和含量测定,改善了原有标准的分离能力和检测灵敏度,四波形电位的应用还较大的改善了欧美药典普遍采用的三电位波形的耐用性[9];针对某些现有色谱流动相所有试剂昂贵等问题(如配制现有中国药典中核糖霉素有关物质检测用流动相1升,成本接近3000元人民币),袁耀佐等[10-13]对该方法进行条件优化,在保证实验效果更优的前提下,检验成本直降97%。表3显示,欧洲药典更愿意采用HPLC-PAD法进行有关物质的控制,但由于历史原因,他们标准中PAD的电位参数设置均为三电位波形,该波形下金电极表面容易损耗,影响方法的耐用性,在流动相组成方面,欧洲药典相关流动相中盐的浓度也较高,并主要使用烷基磺酸钠类离子对试剂增加色谱保留,对色谱仪器、色谱柱尤其是电极的耐用性影响较大,方法的重现性也较差,欧洲药典在执行过程也意识到这点,因此对庆大霉素有关物质检查方法进行了改进,采用与中国药典类似的三氟乙酸体系的流动相,实践中发现该流动相体系比原来的高盐及烷基磺酸钠流动相体系稳定。考虑到特殊检测器的特殊要求,中国药典利用末端紫外吸收检测阿米卡星的有关物质,但在实践中发现检测效果并不理想。而日本药典则采用柱后衍生荧光检测法测定异帕米星的有关物质,张杨慧等[14]还将该方法推广至新霉素的有关物质检查,发现效果良好。近年来还有采用LC-CAD[12]及LC-NAQD法[15]检测相应的氨基糖苷类抗生素的有关物质。但其应用于药典的可行性还需要验证。
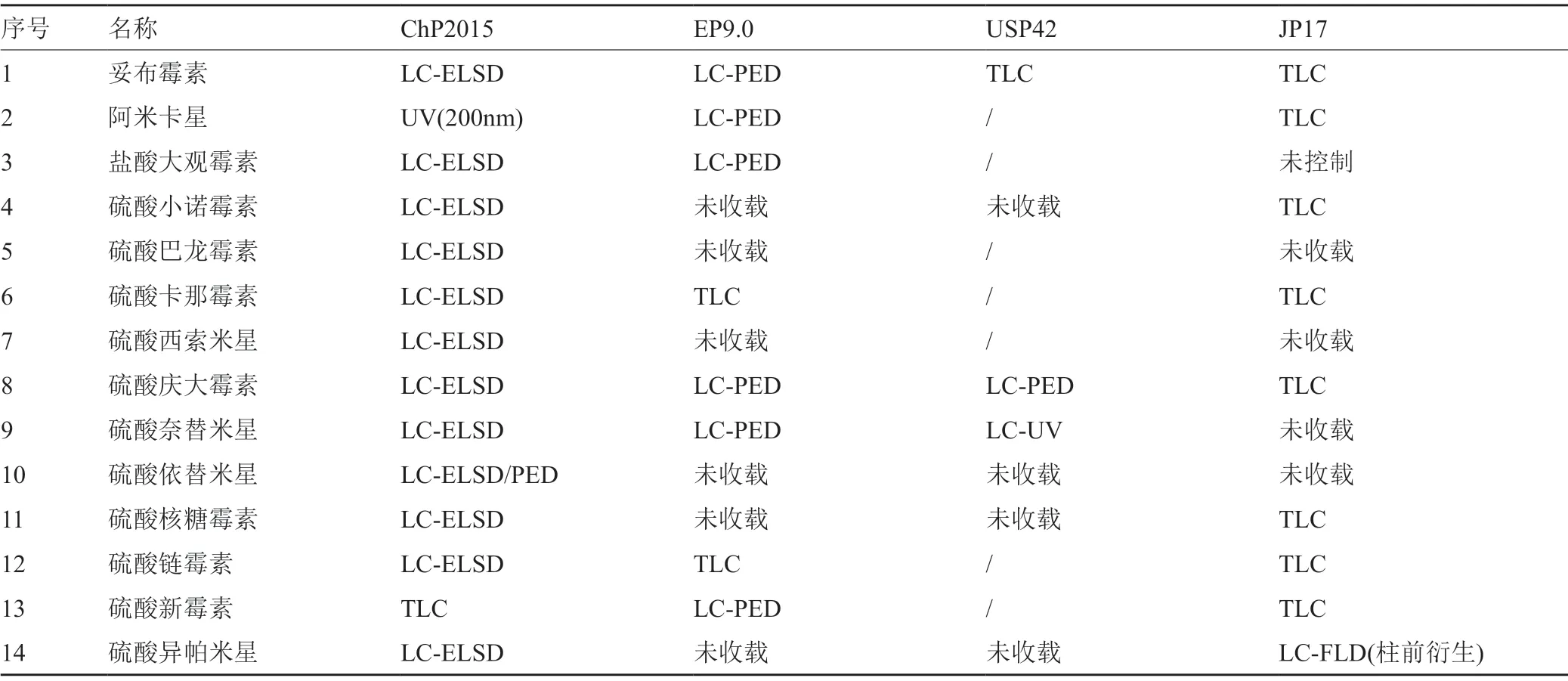
表3 主要药典中氨基糖苷类抗生素有关物质测定方法一览表Tab.3 List of the methods of related substances of aminoglycosides antibiotics in some pharmacopoeias
(5)组分组成:目前所有药典均将硫酸庆大霉素作为以庆大霉素C组分为主的多组分抗生素,中国药典和美国药典也将硫酸新霉素作为含有新霉素B和新霉素C的双组分抗生素,但欧洲药典将新霉素C作为有关物质;中国药典及美国药典中将巴龙霉素作为含有巴龙霉素I和II的双组分;欧洲药典还将盐酸大观霉中的双氢大观霉素作为有效成分,药典收载的其他品种均为单一组分。
由于生产工艺、临床研究及使用的情况不同,各药典对组分之间比例的规定也不尽相同,如硫酸庆大霉素在不同药典中庆大霉素C组分的比例要求见表4。这些要求之间的协调比较困难,这给该产品的进出口之间带来巨大的挑战,目前李继安等[16]发明了庆大霉素联产工艺很好地解决这一难题。
目前主流药典对氨基糖苷类抗生素组分之间的比例计算主要是面积归一化方法,该方法有时无法反映各组分在原料中真实含量,中国药典2015版采用外标法测定庆大霉素C组分的含量,再依据含量计算各自的比例,并且规定按外标法计算,4个组分的含量和应不少于50%,该方法在一定程度上推动了国产庆大霉素质量的提高[17-19]。
(6)干燥失重/水分:氨基糖苷类抗生素除盐酸大观霉素中含有结晶水外,其余药典收载的品种中均无结晶水的描述。本类抗生素均为引湿性,不同品种含有的吸附水差异较大,因此药典要求也不同,如硫酸庆大霉素美日韩药典要求干燥失重不得过18.0%;而硫酸卡那霉素则规定干燥失重不得过4.0%或5.0%。对于测定方法,目前主要有两种方法,即干燥失重法和卡尔费休氏法。干燥失重法还分为常压法和减压法,不同药典关于干燥失重的终点判断也不完全一致;而卡尔费休氏法中所用溶剂主要有甲醇、不同比例的甲酰胺-甲醇/乙二醇-甲醇。
实验过程发现,干燥失重法如采用中国药典常用的干燥至恒重作为实验终点,绝大多数品种需要较长的时间才能达到,考虑到本品含水量均较大,从不确定度的角度来评价,恒重与否带来的误差几乎可以忽略,综合平衡检验成本与结果准确的风险,采用特定条件下干燥一定的时间(如3h或24h)进行测定比较科学经济。但在进行方法的选择确定时应进行科学的评估。考虑到卡尔费休氏法测定的便捷快速,在方法开发时用其替代干燥失重方法是自然的想法,国内外药典中也有部分品种采用该方法,但是氨基糖苷类抗生素在常用的无水甲醇中溶解性较差,会因终点很难达到导致测定时间较长,并且往往测定结果重复性欠佳。为此,部分品种采用不同比例的甲酰胺-甲醇/乙二醇-甲醇的混合溶液替代无水甲醇作为测定溶剂,在一定程度上改善上述不足,但实际效果往往也不够理想。
(7)重金属:氨基糖苷类抗生素药典标准正文中,不少品种的规定重金属检查项目,测定方法也主要以目视比色法为主。但近年来,随着元素杂质分析技术的发展,ICH率先提出对重金属等元素杂质的精细化控制,即ICH Q3D,后来美国药典会从USP41版开始,在原料正文中删除对重金属的具体要求,但在通则<232>、<233>中规定了所有成品中元素杂质的要求。因此,制剂企业在选择生产制剂用原辅料时,就必须对他们中的重金属含量进行评估,也就是说,虽然药典正文中取消了对重金属的具体要求,并不等于对重金属没有要求,相反,有时候在企业内控标准中对相关元素的要求反而更严,这个需要注意。

表4 庆大霉素C组分在主要药典中的限度要求Tab.4 The specification setting of gentamicin C components in gentamicin sulfate in some pharmacopoeias.
2.2.4 含量测定
国内外主要药典中氨基糖苷类抗生素含量测定方法如表5所示,绝大多数品种仍采用微生物检定法控制含量,该方法为经典方法,其优势在于测定结果在一定程度上可以直接反应抗生素的抗菌活性,但是其也存在操作繁琐、测定时间长等不足。因此,很多企业在生产实际质量控制过程中,采用仪器测定方法替代微生物检定方法,美国药典于1994年在药典论坛(PF)中就发表了题为“Use of liquid chromatography for the assay of antibiotics.Stimuli to the revision process”的文章,供大家讨论采用仪器方法替代微生物检定法的测定效价的可行性及替代方法验证的内容等,经过多年的积累,最后于USP38-NF33-S2推出“<1223.1>VALIDATION OF ALTERNATIVE METHODS TO ANTIBIOTIC MICROBIAL ASSAYS”。后来,WHO也于2017年推出类似的讨论稿。中国药典尽管在通则方面落后于上述药典,但在各论方法的研究方面处于国际领先,常艳等[20-23]在这方面有较为系统的研究,并已经成功地建立两性霉素B[20]、硫酸庆大霉素[21]、万古霉素和去甲万古霉素[22]、替考拉宁[23]等HPLC替代微生物检定法测定效价的方法,其中两性霉素B的方法已经被中国药典2015年版所收载。
目前,国内外药典在含量测定方法选择的思路差异较大,以HPLC方法为例,有采用UV(利用紫外末端吸收)和ELSD/PAD方法直接检测,有利用柱前衍生紫外检测,也有利用柱后衍生法等,而盐酸大观霉素,USP和国际药典仍采用衍生化的GC-FID方法。鉴于上述现状,国家药典委于2019年特设立研究课题“氨基糖苷类抗生素的含量和有关物质检测方法的优化与应用”,其中任务之一就是开展氨基糖苷类抗生素含量测定方法的现代化。该课题的另一任务就是希望建立更经济适用的检验方法。实际检验工作中发现,现有药典中部分方法检验成本较高,如配制中国药典中硫酸核糖霉素的含量测定用流动相1L约需3000元人民币;同样,USP41中配制奈替米星含量测定方法的流动相1升也约需500元人民币。为此,很多学者开展色谱条件的优化工作,如史孙亮等[24]建立的核糖霉素测定用流动相成本仅为药典方法的3%,赵述强等[25]经过优化建立的奈替米星含量测定用色谱流动相成本也仅为USP流动相的四分之一。

表5 主要药典中氨基糖苷类抗生素含量测定方法一览表Tab.5 List of the methods of assay of aminoglycosides antibiotics in some pharmacopoeias.
3 氨基糖苷类抗生素杂质谱研究中遇到的挑战与对策
3.1 法规/指南的进展
对药物杂质谱的控制是保证药品用药安全的重要环节,仿制药一致性评价研究过程中,杂质谱的研究更是与原研制剂质量比对的重要指标。目前上市的氨基糖苷类抗生素均为发酵及半合成来源,与化学合成工艺相比,发酵工艺更具多变性,不易控制,因此与单纯使用化学合成生产的产品相比,生产工艺含有发酵步骤的活性物质的杂质分布一般比较复杂和难以预测,ICH Q3指南不适合用于此类产品的杂质谱研究。2012年6月,EMA(European Medicines Agency)正式发布了抗生素有关物质标准制订指导原则[26],这也是国际上首个针对抗生素杂质研究制订的指导原则。该指南旨在为不适用于 ICH Q3指南的发酵产品或源于发酵产品的半合成物质中杂质质量标准的设定提供指导,对于活性成分为发酵或半合成来源的抗生素制剂产品的相关杂质。该指南给出了报告、鉴定和界定阈值,在活性物质由多个密切相关的化合物混合组成(family)情况下,对其应用一般的阈值存在困难。针对此,该指南就如何设定阈值和如何论证杂质谱给出了具体指导(表6),但同时特别强调,该指南不可回顾性使用,即不适用于已完成注册上市销售的产品,但可作为欧洲药典专论修订的重要参考。
3.2 分离检测
氨基糖类抗生素在常规反相色谱柱中不保留,为了增加色谱保留,应在流动相中添加离子对试剂,目前国内外药典中常用的离子对试剂主要采用多氟酸及烷基磺酸钠两类。近年来,LC-MS是目前快速推定检出杂质结构的最有效手段,对于上述两类流动相,因高浓度的多氟酸严重抑制质谱离子化信号以及烷基磺酸钠无法挥发等因素,无法将现有的药典色谱条件直接应用于LC-MS,限制了对药典色谱条件下检出杂质的结构推定。
可能由于受当时技术的限制,早期文献更多关注的是杂质的检出以及对检出杂质的结构推定,LC-MS的色谱条件包括以下几类,(1)采用低浓度的多氟酸流动相[27];(2)在多氟酸流动相中添加醋酸铵[28];(3)采用高pH值的氨水-醋酸流动相[29-31],(4)通过衍生化增加氨基糖苷类抗生素的极性实现LC-MS的分离和检测[32]。
后来,随着监管部门对杂质谱研究要求的提高,需要推定质量标准流动相条件下检出杂质的结构,对于中国药典中的多氟酸流动相,袁耀佐等[33]采用TFA-Fix技术,消除三氟乙酸对质谱信号的抑制,再后来有巧妙的通过直接在多氟酸流动相添加微量丙酸的方法,在待测物质色谱行为无明显改变的前提下,实现将LC-ELSD的色谱条件直接应用于LC-MS[34],实践中发现,这两种方法对质谱仪器污染严重,维护成本较高,且对仪器灵敏度等也有一定的影响,后来有报道[35]通过在质谱前串接阴离子渗透膜,成功的在线去除流动相中的多氟酸离子对试剂,实现LC-ELSD与LC-MS的无缝转换,江苏省食药检院在国家评价性抽验过程也应用该项技术成功地完成了奈替米星、核糖霉素及新霉素的杂质谱研究工作。
但是对于烷基磺酸钠类流动相,其与LC-MS的无缝转换技术还未见报道,有文献报道[36],采用最传统的收集洗脱色谱峰,然后在另外的LC-MS系统中测定其质谱信息的办法,实现对欧洲药典色谱条件下庆大霉素中检出杂质的结构推定,这也可以理解为手动的柱切换。
3.3 杂质结构推定

表6 EMA抗生素有关物质标准制订指导原则中对报告、鉴定和界定的阈值Tab.6 Reporting,identification and qualification thresholds in guideline on setting specifications for related impurities in antibiotics of EMA

图6 杂质结构推定基本线路图Fig.6 Sketch paths of deduction of chemical structures of impurities
目前,推定杂质检出杂质结构思路基本如图6所示,该思路也称为“诊断碎片离子延伸推断策略(diagnostic fragment ion based extension strategy)”[37]。该策略应用的前提是通过对母体化合物及类似结构已知杂质的质谱裂解途径的分析,归纳出其裂解规律,然后按此规律,对未知杂质的质谱碎片离子可能的构成进行推测,进而推定可能的结构。对氨基糖苷抗生素质谱裂解规律的研究文献很多[38-41],对相关品种杂质结构的推定的文献更多[42-51],限于篇幅,本文不做具体展开。另外,李正义等[52]还利用同样的思路,综合运用1H NMR、13C NMR、DEPT、1H-1H COSY、HSQC和HMBC一维和二维核磁共振技术,详细对比研究了依替米星、1,3-二-N-乙基庆大霉素C1a和1,6'-二-N-乙基庆大霉素C1a的结构特点,尤其是乙基所处不同氨基位点对于邻近碳氢化学位移的影响,建立了一种快速、准确分析氨基糖苷类抗生素结构的方法。
3.4 杂质制备及结构确证
LC-MS主要用于杂质结构的快速推定,但杂质结构的最终确证,还是需要在获得一定纯度的杂质后,通过多种波谱分析来确定,如王浩等[53]采用传统的分离富集纯化等手段,成功的鉴定了依替米星中部分杂质的结构。后来,李正义等[52]采用半制备型HPLC-ELSD法(柱后分流)的方法,制备了依替米星中的4种微量杂质,采用NMR对他们的结构进行了确证。根据LC-MS推定的结构信息,利用化学反向合成的办法,是确证半合成氨基糖苷类抗生素杂质的另一重途径。蒋梦虹等[54]采用类似的方法鉴定了卡那霉素中的4个杂质。
4 展望
质量控制水平的提升,受分析技术整体发展水平及人们对质控理念变化的影响,对于氨基糖苷类抗生素也是如此。就具体质量标准的发展而言,性状描述会更严谨,不远的将来,有可能参考USP的做法,将性状项目作为产品的参考消息列入标准,不再作为强制检验项目;鉴别项下会更强调专属,因此色谱技术应该得到更加广泛的接受;检查项下,水分还是干燥失重的选择以及具体的测定条件优化应该受到重视,方法会更为科学;有关物质控制的TLC方法应该逐渐被HPLC方法所代替,分离手段会以高柱效的硅胶基质的反相色谱为主,也有可能被新的分离机制如HILIC等代替,检测技术会以直接检测为目标,但选择哪种方法会根据产品本身特点及质控目标进行,流动相的优化建议借助相关的色谱优化软件进行设计,在保证优化质量的前提下简化工作量。随着科学技术的不断进步,在质控过程中利用快速便捷的仪器分析方法替代繁琐的抗生素微生物检定效价法,采用含量替代生物效价(u/mg)作为质控指标将成为必然,为保证仪器分析替代抗生素效价测定的转换过程中抗生素临床剂量的连续性,明确抗生素中活性物质的质量(mg)与其效价单位(u)之间的量效关系成为关键。
总之,随着科学技术的发展,随着人们对产品关键质量属性认识的逐渐深入,随着标准全球化程度的提高,氨基糖苷类抗生素质量控制水平会越来越高。
致谢:感谢陈瑶、马迪和周丹等帮助收集整理相关资料。
