基于Nrf2 信号通路的电针对脑缺血再灌注模型小鼠细胞凋亡的保护作用研究
2019-12-03方晨晨金晓露徐倩倩沈梅红
方晨晨,金晓露,徐倩倩,沈 洁,李 茜,沈梅红
电针/针刺对脑血管性神经系统损伤细胞凋亡的影响受到广泛关注,有研究发现,针刺能抑制Bcl-2 家族中具有促凋亡作用的Bax 表达,并促进具有抗凋亡作 用 Bcl -2 的 表 达[1-2]。NF -E 2 p 4 5 -related factor 2( Nrf2) 信号是近年来国内外研究发现的机体抵抗体内外氧化和化学等伤害性刺激的防御性转导通路之一[3]。课题组前期研究表明,电针可调节脑缺血再灌注模型大鼠大脑皮层Nrf2 蛋白的表达[4],该因子不仅是细胞抗氧化反应的中枢调节者,相关研究认为其可降低对凋亡信号的敏感性[5-6]。电针对脑缺血再灌注损伤中细胞凋亡的保护作用是否受到Nrf2 信号通路的调节? 本研究以Nrf2 基因敲除小鼠( Nrf2 knocked out,KO) 制备脑缺血再灌注模型为研究对象,探讨Nrf2 与神经元细胞凋亡之间的关系,以期为针刺治疗缺血性脑中风提供实验依据。
1 材料与方法
1.1 实验动物 健康雄性Nrf2-/-型小鼠,体重28 ~32 g,6~8 周龄,由南京军区南京总医院提供。所有动物均饲养在清洁级环境下,光照正常,饮水自由,环境温度25 ℃,湿度50% ~60%,空间内通风良好。本实验已通过南京中医药大学动物伦理委员会批准。
1.2 主要试剂及器材 单克隆 Bax 一抗( 货号: sc-7480,Santa 公司) ; 单克隆 Bcl-2 一抗( 货号: sc-7382,Santa 公司) ; SABC 免疫组化染色试剂盒、DAB 显色试剂盒( 武汉博士德生物试剂有限公司) ; RT-PCR 反转录试剂盒( 大连TaKaRa 生物公司) 。
1.3 主要实验器材 韩氏HANS -200 型电针仪( 南京济生医疗有限公司) 、电子分析天平( 上海卓精) 、石蜡切片机RM 2145( 德国LEICA 公司) 、荧光多功能显微镜BX60( 日本OLYMPUS 公司) ; 图像分析仪( CMIAS 98A,北京航空航天大学) ; Verity 96 孔板热循环仪( 美国Applied Biosystems 公司) ; 核酸蛋白检测仪( 德国Eppendorf 公司) ; PCR 扩增仪 7500( 美国 Applied Biosystems 公司) 等。
1.4 实验方法
1.4.1 实验分组 适应性喂养1 周后,所有小鼠按照随机数字表分为假手术组、模型组和电针组,每组10 只。
1.4.2 各组处理方法 模型组和电针组小鼠在前期研究基础上根据改良Longa 线栓法采用直径0 . 128 ~0.148 mm 尼龙渔线制作脑缺血2 h 再灌注24 h 模型。电针组再灌注同时给予电针“百会”“大椎”两穴进行治疗,针刺深度为3 ~5 mm,电针波形采用疏密波,频率为2 /15 Hz,以针柄轻微颤动、穴区局部轻微抖动为度,连续治疗15 min。其余步骤与本课题组前期研究相同[7]。假手术组除不插入线栓外其余各步骤与模型组相同。
1.5 观察指标
1.5.1 神经行为学评分 缺血2 h 再灌注24 h 后采用Julio 氏18 分制评分法给予神经行为学评分。评分范围 3~18 分,18 分为正常。
1.5.2 脑含水量测定 脑含水量( %) = ( 湿重-干重) /湿重×100%。小鼠再灌注24 h 后,麻醉,取脑,摘除后脑、嗅球,使用电子分析天平秤称取大脑湿重,后将脑组织放在105℃恒温干燥箱内干燥24h,测定干重。
1.5.3 缺损侧大脑皮层还原型谷胱甘肽( GSH) 、氧化型谷胱甘肽( GSSG) 含量测定 小鼠眼眶采血后室温静置2 h,在4 ℃下4 000 r/min 离心取上清液。应用ELISA 法检测 GSH、GSSG 含量及 GSH 与 GSSG 比值。
1.5.4 缺损侧大脑皮层 Bax、Bcl-2 蛋白表达 采用免疫组化法检测[4]。小鼠经多聚甲醛灌注后快速断头取脑并将组织标本保存于4 ℃的多聚甲醛溶液中。常规脱水、透明、包埋后切片。每只动物取2 张切片按Bax、Bcl-2 蛋白免疫组化试剂盒说明书进行免疫组化染色。经脱水、透明和封片后,显微镜400 倍视野下随机选择不重叠缺损侧皮层5 个视野观察Bax、Bcl-2 阳性细胞表达,采用图像分析软件计算阳性细胞的平均光密度值( IOD) ,所得数据取平均值。
1.5.5 缺损侧大脑皮层 Bax、Bcl-2 mRNA 检测采用qRT-PCR 法进行检测[4]。小鼠缺血再灌注 24 h 后,在冰盘上迅速分离梗死侧皮层,液氮速冻后置于-70 ℃冰箱中保存。经总RNA 提取,逆转录合成cDNA 后,以甘油醛-3-磷酸脱氢酶( GAPDH) 为内参,进行PCR扩增40 个循环,最后读取荧光强度。
1.6 统计学处理 采用SPSS 23.0 进行统计分析。计量资料以均数±标准差( x ±s ) 表示,各组数据采用单因素方差分析 AVONA 检验方法,其中方差齐性采用LSD 检验,方差不齐采用Tamhane ' s 检验。以P <0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠神经行为学功能评分比较 与假手术组比较,模型组和电针组神经功能评分均显著降低( P <0.01) 。详见表 1。

表1 各组小鼠神经行为学功能评分比较( x ±s ) 分
2.2 各组小鼠脑缺血再灌注脑含水量比较 与假手术组比较,模型组和电针组脑含水量均显著升高( P <0.01) 。详见表 2。

表2 各组小鼠脑缺血再灌注脑含水量比较( x ±s ) %
2.3 各组小鼠脑缺血再灌注后血清GSH 和GSSG 含量比较 与假手术组比较,模型组及电针组GSH 含量、GSH/GSSG 比值均下降( P <0.01) ,GSSG 含量均上升( P <0.01) 。详见表 3。
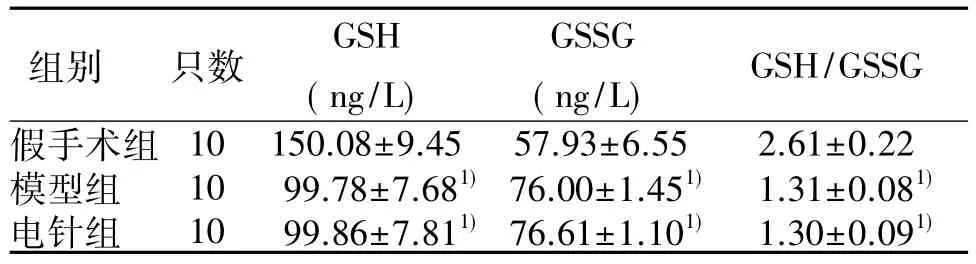
表3 各组小鼠脑缺血再灌注后血清GSH 和GSSG 含量表达比较( x ±s )
2.4 小鼠缺血侧大脑皮层Bax、Bcl-2 阳性细胞数及蛋白表达情况 400 倍显微镜下观察免疫组化染色结果发现,Bax、Bcl-2 阳性细胞胞浆呈黄色或棕黄色,非阳性细胞则呈现淡蓝色( 见图1) 。与假手术组比较,模型组和电针组Bax 、Bcl -2阳性细胞数均升高( P <0.05 或P <0.01) 。详见表 4、表 5。

图1 小鼠右侧大脑皮层Bax 及Bcl-2 免疫组化染色图( ×400)

表4 各组小鼠Bax 阳性细胞数和阳性细胞光密度值比较( x ±s )
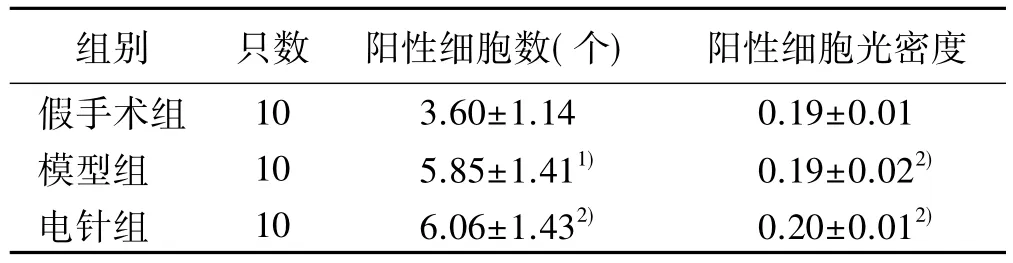
表5 各组小鼠Bcl-2 阳性细胞数和阳性细胞光密度值比较( x ±s )
2.5 各组小鼠脑组织Bax、Bcl-2 mRNA 表达情况比较与假手术组比较,模型组和电针组Bax mRNA 表达均显著增多( P <0.05 或P <0.01) 。详见表 6。

表6 各组小鼠脑组织Bax、Bcl-2 mRNA表达情况比较( x ±s )
3 讨 论
细胞凋亡是一种在生理或病理条件下,受多种基因调控,主动、程序化的死亡过程。关于细胞凋亡,目前研究较多的是Bcl-2 和Bax 基因。其中,Bcl-2 基因被认为是抗凋亡基因的成员代表,定位于线粒体外膜上的该基因被通过抑制机体氧化还原状态从而阻止细胞凋亡发生[7]。Bax 基因可破坏线粒体膜的完整性,并与Bcl-2 基因对抗,从而发挥其凋亡作用。生理状态下,Bax 和Bcl-2 蛋白在机体内维持一个相对平衡状态,使机体保持活跃的新陈代谢。脑缺血再灌注早期由于脑部组织瞬时缺血缺氧,机体发生氧化应激反应,定位于线粒体膜上的Bcl-2 和Bax 基因调控紊乱,Bax基因大量表达,Bcl-2 受到抑制,从而诱导神经元细胞凋亡[8]。脑组织因缺血缺氧产生过量的活性氧( reactive oxygen species,ROS) ,损伤细胞内线粒体,也能诱导凋亡发生[9-11],导致脑缺血早期神经细胞损伤。
GSH 是一种天然存在的三肽,主要作用是清除自由基,维持组织细胞内氧化还原体系,其合成需要γ-谷氨酰半胱氨酸合成酶( γ-GCS) 限速酶[12]。GSSG 是GSH 清除自由基后产生的氧化还原产物,GSH/GSSG比值是判断抗氧化能力强弱的重要因素[13]。有研究证实,脑缺血再灌注后GSH 含量下降,神经元呈现明显的自由基损伤状态[14],因此调节GSH 合成可有效控制脑缺血再灌注后脑损伤程度。故本实验在缺血2 h 再灌注24 h 后,检测小鼠血清 GSH、GSSG 含量及GSH/GSSG 比值,结果表明,电针对模型小鼠缺血性损伤无明显治疗作用。
Nrf2 是机体内重要的对抗氧化应激的因子[15]。正常生理状态下,Nrf2 与Keap1 蛋白( Kelch-like ECH associated protein) 呈静息状态存在于细胞浆中,后者通过泛素化和解体蛋白酶抑制Nrf2 活性。当机体受到氧化应激产物刺激时,Keap1 蛋白构象发生改变,Nrf2 和Keap1 发生解偶联,转位至细胞核后与Maf 结合形成异二聚体,致使细胞核内的抗氧化反应元件( antioxidant response element,ARE) 被激活,进而促进细胞内一系列抗氧化酶如血红素加氧酶( heme oxygenase-1,HO-1) 、谷胱甘肽过氧化物酶( Glutathione Peroxidase,GLU-Px) 等表达增加,这些酶类保证机体不受氧化应激产物的影响[16]。当机体缺乏Nrf2 基因或Nrf2基因被抑制时,体内Nrf2 /Keap1 /ARE 通路被阻断,机体无法产生上述反应[17],导致炎症反应发生,从而导致细胞DNA 发生变异、凋亡。已有研究表明,给脑缺血模型大鼠注射Nrf2 激动剂,可增强机体抗氧化应激能力,增强其神经保护作用[18]。
电针/针刺对 Bcl-2、Bax 有一定的调节作用[19]。本课题组前期研究已证实,电针可能通过下调促凋亡基因 Bax mRNA 表达、升高 Bcl-2 mRNA/Bax mRNA 比值,从而形成以Bcl-2 占优势的Bax /Bcl-2 二聚体,以此减轻脑缺血再灌注损伤,从而达到保护受损的神经元的目的[20]。Nrf2 是机体内关键的抗损伤因子,具有对抗氧化应激,进而起到抗细胞凋亡的作用。在此基础上,采用Nrf2-/-小鼠制备脑缺血再灌注模型,对比观察发现电针百会、大椎穴可改善小鼠神经评分,减轻脑水肿程度,但对Nrf2-/-小鼠作用不明显,表明Nrf2信号通路在电针对脑缺血再灌注损伤的神经保护可发挥重要作用。
较多研究表明,电针/针刺从抗氧化应激[21]、对抗细胞凋亡[19]、抑制炎症反应[22]、促血管再生、抑制兴奋性氨基酸的神经毒性等多方面、多途径对脑缺血再灌注损伤进行综合调理。中医将该病归属于 “中风”范畴,本质为虚,只因五脏六腑之气推动无力,血液运行不畅致瘀、痰等病理因素阻滞脑络。脑又为“元神之府”,从而导致中风偏瘫、半身不遂等症。百会、大椎为最常用腧穴之一,因二穴均位于督脉,督脉入脑,与足太阳经相联系,统领一身之阳气。大椎又为全身阳气总会,联系手足三阳经穴,且“百会”位于颠顶,为感觉及运动中枢范围内,并接近Wills 环。功能磁共振成像证明临近选穴的优势[23-24]。结合前期本课题组数据挖掘[25]和实验研究[26],结果发现,与模型组比较,电针组神经行为学评分、脑水肿程度、Bcl -2、Bax 蛋白及mRNA 表达比较,差异无统计学意义( P >0.05) 。说明电针对脑缺血再灌注损伤的脑保护作用可能与Nrf2信号途径有关,推测机制可能是电针通过Nrf2 信号通路,调节机体内抗氧化应激能力,降低Bax 表达,升高Bcl-2 表达,从而抑制细胞凋亡的发生,减小梗死区域,提高神经功能评分,从而发挥电针对脑缺血再灌注损伤的脑保护作用。
