放疗+唑来磷酸治疗恶性肿瘤骨转移的效果研究
2019-12-02吕欣
吕 欣
( 辽宁省营口市中心医院肿瘤科 , 辽宁 营口 115000 )
晚期恶性肿瘤已发生远处转移,而骨骼为其最常见的转移部位之一,在恶性肿瘤发生的所有远处转移中,骨骼转移占比为50%左右[1],且原发疾病主要为肺癌、胃癌、乳腺癌、前列腺癌等。一旦发生骨转移,很多患者会出现程度不同的疼痛,或出现病理性骨折、高血钙、骨髓压迫等,患者生活质量可明显下降[2]。对于恶性肿瘤骨转移患者,放疗是经典治疗方法,其可有效减轻患者疼痛,防止病理性骨折[3]。唑来磷酸是最强效的抗骨吸收的双磷酸盐类药物,其对于高钙血症、多发性骨髓瘤、恶性肿瘤骨转移患者均可发挥一定治疗效果[4]。我科近年来在为恶性肿瘤骨转移患者治疗时,尝试为部分患者在放疗基础上加入唑来磷酸治疗,结果发现这一方案有更明显的止痛效果,现报告如下。
临床资料
1 一般资料:选取我院2017年1月-2018年1月收治的86例恶性肿瘤骨转移患者,经医院伦理委员会批准后,将之随机分为2组,各43例。对照组男26例,女17例,年龄42-78岁,平均(58.96±4.27)岁;原发疾病为:乳腺癌5例,肺癌15例,鼻咽癌5例,胃癌14例,前列腺癌与宫颈癌各2例;骨转移病灶:单发11例,多发32例。观察组男28例,女15例,年龄41-77岁,平均(58.85±4.19)岁;原发疾病为:乳腺癌6例,肺癌15例,鼻咽癌4例,胃癌15例,前列腺癌1例,宫颈癌2例;骨转移病灶:单发10例,多发33例。2组患者基本资料无显著差异(P>0.05),可对比。纳入标准:(1)患者伴随程度不同的骨痛,经MRI检查或ECT骨扫描明确诊断;(2)原发病灶被病理诊断所证实;(3)患者存在溶骨性改变;(4)近4周内无放疗或化疗史;(5)对本研究内容已经完全知情,经衡量利弊后自愿参与本研究。排除标准:(1)存在精神疾病病史、意识障碍或理解能力正常;(2)无法配合医护人员指导完成疼痛情况评定;(3)存在严重的肝肾功能障碍;(4)预计生存期不足3个月;(5)临床资料不完整,有后期失访风险。
2 方法:对照组行放射治疗,应用直线加速器6MeV X线实施照射,于模拟定位机下,借助X线、MRI、CT等定位。每次放疗照射剂量是3Gy,每周实施5次放疗,连续放疗2周,总照射剂量30Gy。观察组行放疗联合唑来磷酸治疗,其中放疗方法和对照组相同。在放射治疗的前1天,给予唑来磷酸(国药集团国瑞药业有限公司,国药准字H20041955)4mg+100ml生理盐水快速静脉滴注,在5分钟内滴完,用药20天后再给予1次唑来磷酸滴注,共用药2次。
3 观察指标:(1)根据WHO推荐标准评价治疗后骨痛改善效果[5],完全缓解:经治疗疼痛完全消失。部分缓解:经治疗疼痛显著减轻,对睡眠基本无影响,患者可正常生活。轻度缓解:与治疗前比患者疼痛有所减轻,但仍对睡眠造成影响。无效:患者疼痛未见改善。以完全缓解、部分缓解为治疗有效。在治疗前后,用数字模拟量表(VAS)评定患者的疼痛程度评分,总分10分,分值越低说明疼痛越轻。(2)所有患者均未失访,统计2组患者止痛起效时间(达到部分缓解所需要的时间)、疗效维持时间(从止痛起效到疼痛恢复到治疗前水平的时间)。(3)统计2组治疗期间的不良反应发生情况。
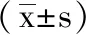
5 结果
5.1 2组治疗效果及疼痛程度评分对比:经分析,2组治疗总有效率差异显著(P<0.05)。2组疼痛程度评分:治疗前对照组(8.05±1.03)分,观察组(8.11±1.02)分,组间差异不显著(t=0.271,P=0.393)。治疗后对照组(3.25±0.62)分,观察组(1.74±0.50)分,组间差异显著(t=12.432,P=0.000)。见表1。

表1 2组治疗效果对比(n,%)
5.2 2组止痛起效时间和疗效维持时间对比:2组患者止痛起效时间、疗效维持时间分别为:对照组(6.63±1.04)天、(132.54±13.67)天,观察组(4.91±0.42)天、(165.88±15.29)天,观察组止痛起效时间明显短于对照组,疗效维持时间明显长于对照组(t=10.056、10.660,P=0.000、0.000)。
5.3 2组不良反应发生情况对比:对照组17例出现不良反应,其中恶心、呕吐8例,白细胞减少2例,发热2例,骨痛一过性加重3例,食欲减退2例,不良反应发生率39.53%;观察组19例出现不良反应,其中恶心、呕吐9例,白细胞减少3例,发热3例,骨痛一过性加重2例,食欲减退2例,不良反应发生率44.19%;2组不良反应发生率差异不显著(x2=0.191,P=0.662)。2组患者不良反应均较轻微,未影响继续治疗,2组患者均完成预期疗程的治疗。
讨 论
恶性肿瘤骨转移患者以疼痛为最常见、最主要临床症状,其发生机制是生物、代谢等因素共同造成的。一旦癌细胞向骨细胞中转移,导致骨破坏之后,微小的骨折片可对疼痛神经受体造成刺激,或因骨骼形态改变、骨质过度增生而对这一神经受体造成刺激,让患者感受到疼痛。另外,在恶性肿瘤转移过程中,会释放一些炎性因子、细胞因子,对神经受体造成刺激,或造成周围组织水肿,压迫到周围神经,进而可引发疼痛。恶性肿瘤骨转移后的疼痛可严重影响患者的身体健康,同时可给患者造成巨大心理负担,导致患者在最后的生命期间承受更多痛苦,致使其生活质量下降[6]。对此类患者而言,采取有效方法减轻疼痛、使得患者生活质量得以提高,是符合人道主义精神的,也是医疗领域不断探索的研究热点。
目前对于恶性肿瘤骨转移患者主要采取姑息性治疗,尽可能减轻骨破坏,减轻疼痛,只有少量患者可通过综合治疗达到治愈效果。放射治疗是治疗恶性肿瘤骨转移的经典方法,具有确切的止痛效果,统计显示,其止痛率可达到85%[7]。放疗止痛的作用机制为:通过放射治疗,可将患者体内的肿瘤细胞杀死或对其发挥抑制作用,对肿瘤细胞生长予以控制,进而阻止肿瘤细胞给周围组织及神经等造成干扰或浸润;同时,放疗可促使机体内胶原蛋白合成量大幅增加,形成大量血管纤维基质,使得成骨细胞活性增强,进而形成新骨。然而放射治疗也有一定局限,主要体现在这一方法只能对照射野中的骨转移病灶发挥作用,而无法对新骨转移灶发挥效果,且长期应用放疗可引发较多副作用,导致患者耐受性不佳,影响患者治疗依从性。双磷酸盐为临床常用的全身性骨转移抑制剂,其中唑来磷酸的抗骨吸收能力最强,且起效迅速,作用维持时间较长,患者对该药物具有良好的耐药性。唑来磷酸的作用机制为:该药物和骨组织具有高度亲和性,可在骨骼中不断凝聚,经破骨细胞吸收之后,可对破骨细胞溶骨过程发挥抑制作用,同时抑制骨小梁的破坏,使骨转移的疼痛减轻;该药物还能抑制肿瘤细胞生长,延缓疾病进展,可通过阻断肿瘤细胞诱导钙离子释放的过程,进而对高钙血症的发生发挥预防作用。体外研究[8]发现,唑来磷酸可抑制破骨细胞活动性,促进破骨细胞凋亡,同时可与骨结合,将软骨吸收、骨的矿化过程阻断,且可有效抑制肿瘤细胞分泌的刺激因子导致破骨细胞活动性增强的过程,抑制骨钙释放。将放射治疗和唑来磷酸联合起来应用,相当于是将局部疗法和全身疗法配合应用,可借助2种治疗方法的治疗优势,充分发挥2种疗法的协同作用,有效改善患者的疼痛症状,并可抑制新骨转移瘤的出现。本次研究中,对照组单独应用放射治疗,观察组则实施放射治疗联合唑来磷酸治疗。结果发现,观察组治疗总有效率90.70%,明显高于对照组的74.42%(P<0.05),治疗后观察组疼痛程度评分明显低于对照组,组间比较差异显著(P<0.05)。由此可见,观察组联合治疗方案具有更为显著的止痛效果。另外,观察组止痛起效时间明显短于对照组,疗效维持时间明显长于对照组(P<0.05),这一结果说明,放疗联合唑来磷酸能够更为迅速的发挥止痛作用,尽快减轻恶性肿瘤骨转移给患者造成的疼痛,缩短患者不适体验时间,同时又可在较长时间内维持止痛效果,让患者获得更良好的治疗体验。另外,对照组、观察组不良反应发生率39.53%、44.19%,组间差异不显著(P>0.05),这一结果说明,虽然观察组多应用了唑来磷酸,但并没有导致不良反应风险增加,患者仍可耐受不良反应,故而这一方案可以在临床推广。本研究还存在一定局限,主要体现在以下几方面:(1)选取的样本量较少,后期可扩大样本量,展开更大范围的临床试验,以便获得更全面的结果;(2)本研究未对2组患者的疼痛耐受程度、学历水平、经济状况、心理状态等可能会影响疼痛认知的因素进行分析,后期可进一步细化研究。
综上所述,放疗联合唑来磷酸治疗恶性肿瘤骨转移效果明显,可尽快发挥止痛效果,且止痛效果维持时间较长,患者对不良反应均可耐受。
