腹腔镜下保留脾脏的全胰腺切除术1例报告并文献复习
2019-11-29覃勇辉徐邦浩王继龙滕艳娟黄振兴彭民浩
覃勇辉,徐邦浩,王继龙,滕艳娟,黄振兴,郭 雅,彭民浩,文 张
(广西医科大学第一附属医院,广西 南宁,530021)
近年,腹腔镜手术在胰腺外科领域发展迅速,越来越多的胰腺外科手术都能在腹腔镜下完成。腹腔镜全胰腺切除术(laparoscopic total pancreatectomy,LTP),由于解剖复杂,技术条件要求高,并发症发生率高,成为胰腺外科具有挑战性的手术之一。2019年8月笔者为1例慢性胰腺炎合并癌变的患者施行腹腔镜保留脾脏全胰腺切除术,术后患者恢复良好,现将结果报道如下。
1 资料与方法
1.1 临床资料 患者女,62岁,因“右腹隐痛3个月,检查发现胰头占位2 d”入院。查体:T:36.6℃,P:64次/分,R:20次/分,BP:169/94 mmHg。神志清楚,皮肤巩膜无黄染,全身淋巴结未扪及肿大。腹壁柔软,腹部无压痛、反跳痛及肌紧张,肝脾肋缘下未触及,未触及腹部包块、波动感;无移动性浊音,未闻及血管杂音。入院检查:血清胆红素、CA19-9均正常,CT提示:胰头钩突增大,密度不均,内见囊实性灶,边界不清,增强扫描病灶不均匀强化,囊壁轻度强化;胰腺内见扩张胰管走行迂曲,扩张胰管最宽约1.8 cm,扩张胰管内未见异常密度灶,胰体及胰尾结构清晰,未见异常密度灶及异常强化灶,诊断:胰腺头部肿瘤(胰腺囊性假乳头状瘤?胰腺癌?)并胆道梗阻、胰管扩张;胆囊小结石;CT血管造影示胰头由肝固有动脉及肠系膜上动脉分支供血。MRI+MRCP:胰头部肿瘤:囊腺瘤?并低位胆道梗阻、胰管扩张;胆囊小结石。术前诊断:胰头占位性病变(胰腺囊性假乳头状瘤?胰腺癌?),患者无明显手术禁忌证,拟行腹腔镜下胰十二指肠切除术。
1.2 手术方法 患者取仰卧、头高足低大字位,脐部切口置入腹腔镜,分别于左、右侧锁骨中线肋缘下及左、右腋前线脐水平附近置入腹腔镜操作器械。打开胃结肠韧带,显露胰腺,见胰腺头部增大,胰腺质地变硬(图1)。结扎切断胃网膜右静脉,打开小网膜囊,用切割闭合器距胃窦部约5 cm处切断胃壁,悬吊肝总动脉,分离出胃十二指肠动脉,予以结扎留置。寻找肠系膜上静脉,用分离钳小心分离肠系膜上静脉上方无血管区域,贯通至胰腺上方(图2)。于肝总管水平并切断胆总管,向下游离至十二指肠水平;距Treitz韧带远端15 cm处用切割闭合器离断空肠,用超声刀切开胰腺,剪开胰管;离断胰腺钩突,分离缝扎切断胰腺钩突系膜;完成标本移除(图3)。剩余胰腺断端及胰腺头部分别送术中冰冻,病理提示癌浸润。廓清第一肝门淋巴组织,分离“骨骼化”脾动脉、脾静脉(图4),同时用血管吊带悬吊脾动、静脉,离断胰体尾部与脾血管的粘连,遇脾静脉小属支的出血,用腔镜血管阻断夹阻断脾动脉,钛夹夹闭脾静脉出血部位,完成保留脾脏的胰体尾部切除术(图5)。将空肠通过肠系膜根部,送至肝门处;胆肠吻合口进行连续缝合关闭(图6);采用切割闭合器行胃空肠吻合,胃肠吻合口前壁连续缝合关闭,浆肌层缝合加固(图7、图8)。
2 结 果
手术过程顺利,手术时间11 h,术中出血量300 mL。术中冰冻病理学检查:胰腺断端组织内癌浸润。术后予以保护胃黏膜、预防感染、营养支持等对症支持治疗。禁食期间采用胰岛素泵控制血糖,维持血糖在8~12 mmol/L,术后5 d进食,改为短效胰岛素3餐前半小时皮下注射及甘精胰岛素睡前皮下注射维持血糖。每日监测空腹、三餐前、餐后2 h、睡前血糖,根据患者血糖调节胰岛素用量,维持空腹血糖水平在6~8 mmol/L,餐后2 h血糖在8~10 mmol/L。补充胰酶制剂,提供胰腺外分泌功能支持,术后患者无胃瘘、胆漏及腹腔感染等并发症发生。术后病理结果提示:胰腺中分化导管腺癌,未见脉管癌栓及神经侵犯。胃、十二指肠及胆管未见癌累及,胃切缘、十二指肠切缘、胰腺切缘及胆总管切缘未见累及。全胰腺取材制片,镜下胰腺组织萎缩,癌性腺体弥漫浸润硬化间质,紧贴胰腺切缘,但尚未突破被膜。淋巴结情况:No5、6、8、9、10、11、12、13、14、16、17未见转移。住院25 d。出院后继续按住院胰岛素使用方案控制血糖,口服胰酶制剂,术后随访1个月,患者一般情况好,血糖控制良好,无其他并发症发生。
3 讨 论
美国外科医生Rockey完成了世界上第一例全胰腺切除,患者的原发疾病为胰腺癌[1]。由于技术条件及围手术期治疗手段的限制,全胰腺切除术后并发症发生率高,文献报道未出院死亡率高达27%[2]。近年,随着外科技术,尤其腹腔镜技术的不断发展,以及胰腺功能替代治疗的进步,全胰腺切除术后患者并发症发生率及死亡率降低,90 d内可降至2%[3]。
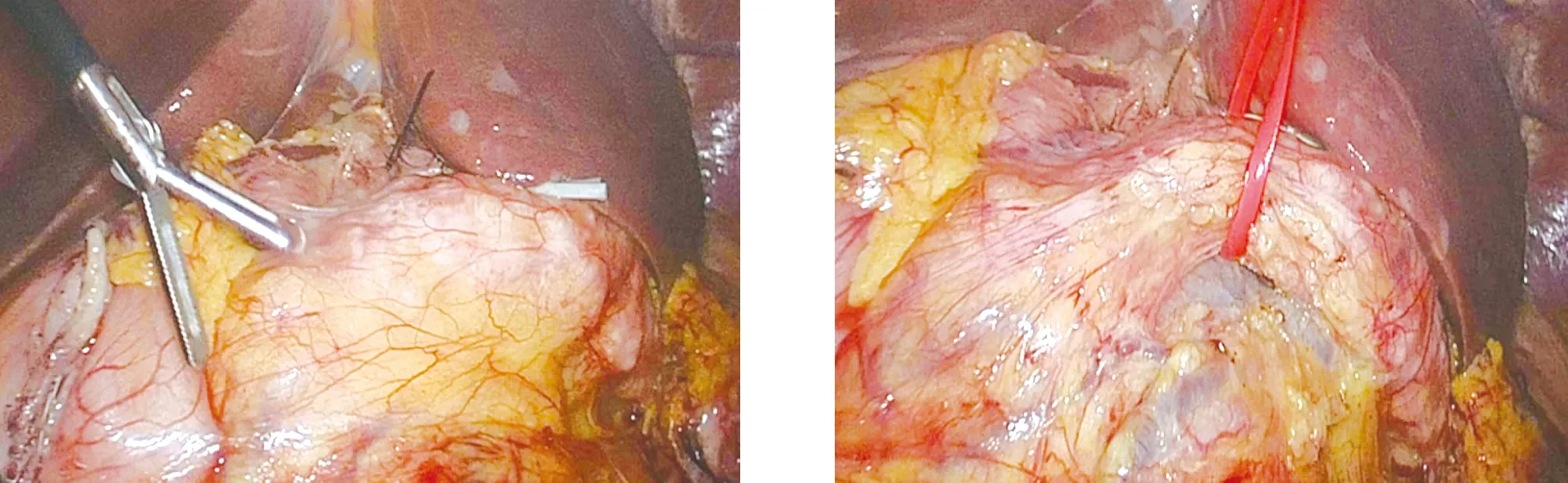
图1 胰腺大体病理 图2 中央入路切除胰十二指肠
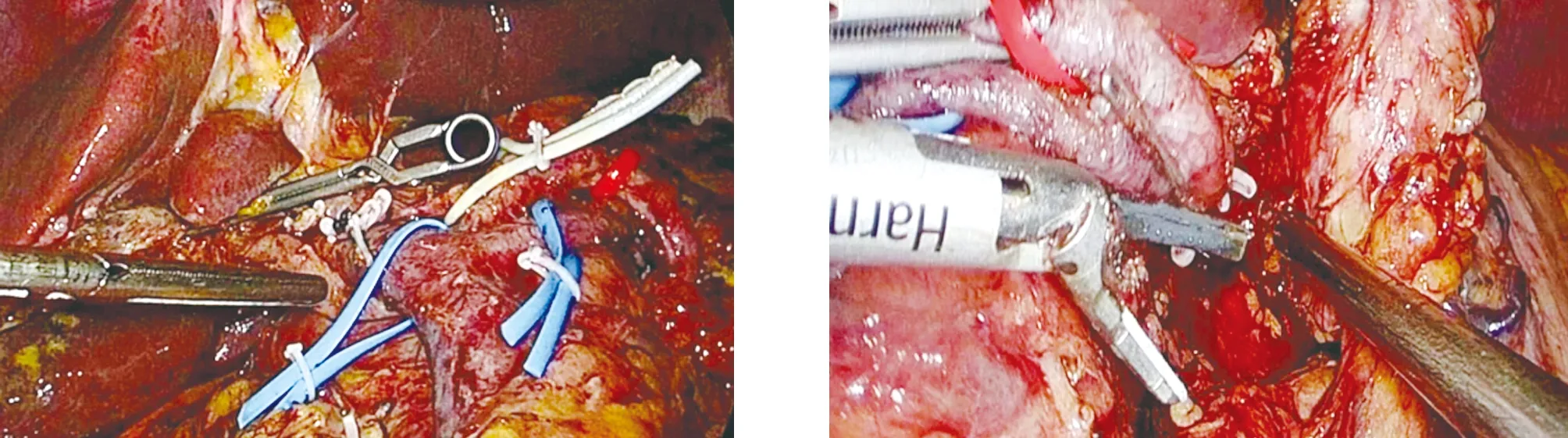
图3 切除胰十二指肠完毕 图4 阻断脾动脉,切除胰体尾部(保留脾动静脉)
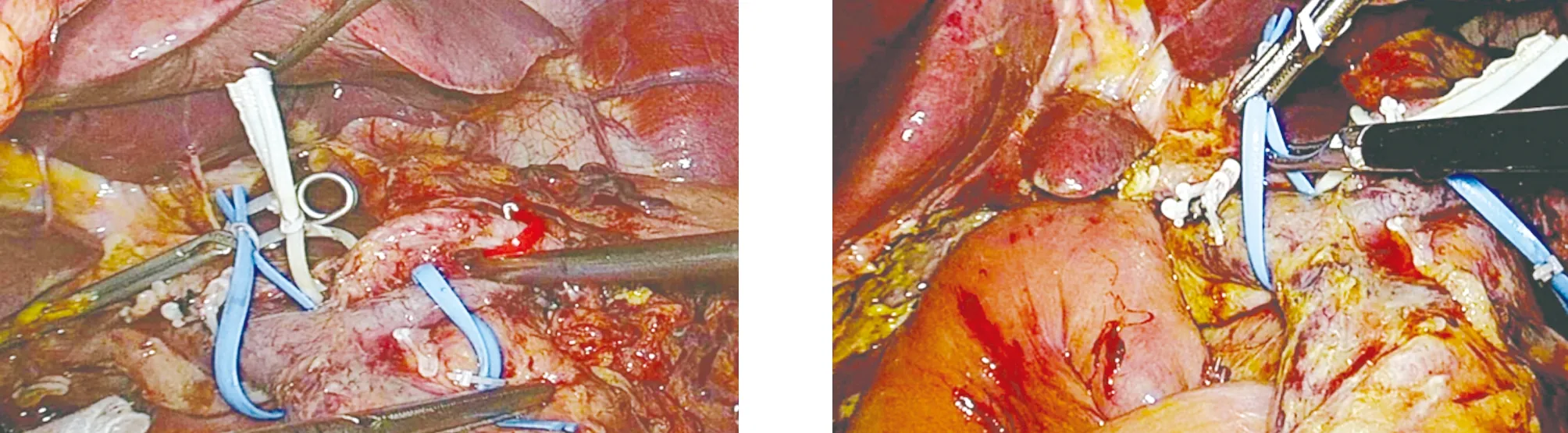
图5 全胰腺切除完毕 图6 胆管空肠吻合
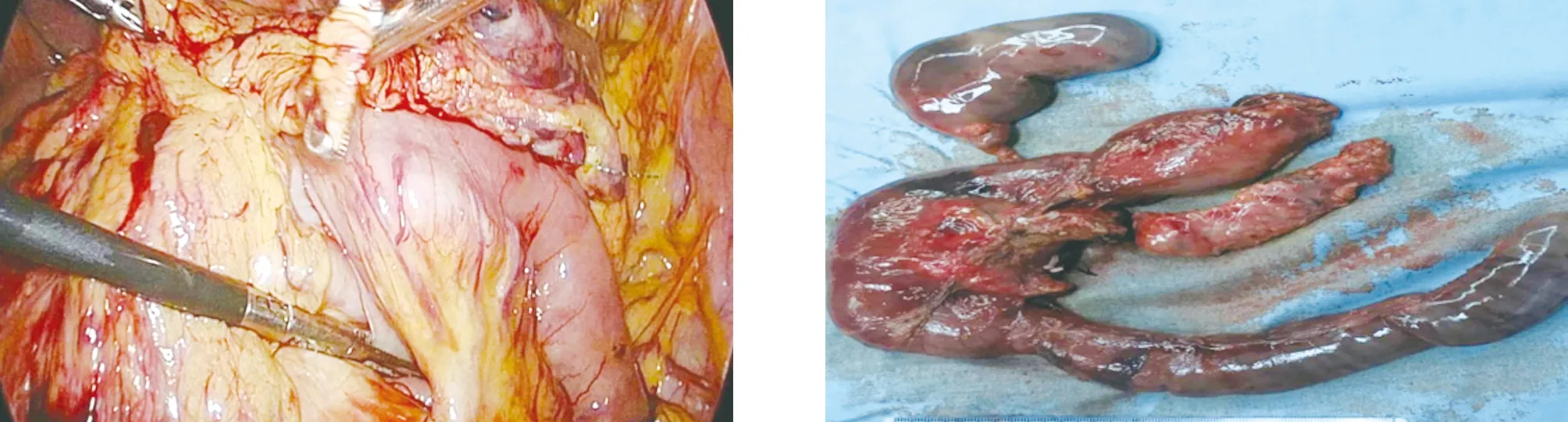
图7 胃空肠吻合 图8 全胰腺及十二指肠切除标本
全胰腺切除术的适应证主要包括:多发胰腺癌、弥漫性胰腺导管内乳头状黏液性肿瘤、多灶性的神经内分泌肿瘤、转移性肿瘤、家族性胰腺癌癌前病变、胰肠吻合口破裂伴感染出血、慢性胰腺炎内、外科(内引流)治疗手段无效等[4-6]。LTP的手术入路主要包括:(1)胰腺颈部切断,沿肠系膜上静脉切开胰腺颈部,随后行胰十二指肠及保留或不保留胰腺体尾部的肿瘤切除术。消化道重建:行胃空肠吻合及肝总管-空肠吻合;本例患者采用此入路,主要依据术前评估考虑胰腺头部肿物(胰腺导管内黏液腺瘤?胰腺癌?),术前考虑在切除病变的基础上,进一步保留胰腺实质;但术中探查及胰腺体尾断面病理考虑存在胰腺恶变可能,最终行全胰腺切除术。(2)由左侧向右侧,依次探查胰腺肿瘤及其周围血管关系后,沿脾脏方向开始向右侧游离切除胰腺,离断肝总管、十二指肠。消化道重建:胃空肠吻合及胆管空肠吻合。(3)由右侧向左侧,探查肿瘤及胰腺周围血管关系后,行Kocher切口由右侧向左侧分离,切断十二指肠及肝总管。消化道重建:胃空肠吻合及肝总管空肠吻合[7-8]。
LTP术中是否保留脾脏目前仍值得商榷,由于脾脏具有储存血液、抗肿瘤、免疫等功能,大多数学者建议尽可能保留[9-10]。然而合并慢性炎症的胰腺组织与脾脏血管粘连,保留脾脏可增加出血风险,同时增加了手术难度,尤其处理胰腺背部与脾静脉之间的小静脉属支时,极易引起大出血。因此,国外文献报道的胰腺切除多联合脾脏切除[11-14]。本例在处理胰腺体尾部的脾静脉小属支时遇脾静脉出血,随后将预留脾动脉的悬吊带提起,使用腹腔镜下血管阻断夹阻断脾动脉,减少了脾静脉出血,用连发钛夹夹闭脾静脉出血部位。
LTP术后并发症发生率较高,常见并发症为吸收功能障碍与糖尿病,其中术后难以控制的糖尿病,为特殊类型的糖尿病,美国糖尿病协会于2010年糖尿病的诊断与分类中将其分至ⅢC型[15],是既往全胰腺切除术后患者死亡的主要原因,随着胰岛素制剂及血糖控制方法的发展进步,致死性糖尿病的发生率明显降低,针对围手术期血糖水平波动大的疾病特点,采用胰岛素泵进行动态调节使用胰岛素,可良好控制血糖水平,加快全胰腺切除患者术后康复进程[16]。本例患者围手术期血糖水平平稳,未出现血糖相关并发症。出院后根据饮食情况,采用皮下注射胰岛素,获得较好的血糖控制,生活质量良好。此外,针对全胰腺切除术后胰腺外分泌功能缺失,加用胰酶制剂补充相关酶类,可减少胰腺外分泌功能障碍的发生[17]。近年的围手术期治疗方法,使得全胰腺切除术由高并发症发生率与死亡率,变为安全、可行。
综上所述,LTP(保留脾脏)治疗全胰腺病变是安全、可行的,围手术期应注意胰腺内外分泌功能的支持,远期效果尚需进一步的病例积累。
