IL-6与GATA-6在肺动脉高压大鼠肺组织中的表达及意义
2019-11-29廖剑雄张一驰王炳今刘维佳
廖剑雄,张一驰,王炳今,张 谦,刘维佳
(1.遵义医科大学 研究生院,贵州 遵义 563099 ;2.贵州省人民医院 烧伤整形科,贵州 贵阳 550002;3.贵州省人民医院急诊内科,贵州 贵阳 550002;4.贵州省人民医院 呼吸与危重症医学科 贵州 贵阳 550002)
肺动脉高压(Pulmonary hypertension,PH)是以肺动脉压力和肺小血管阻力进行性增加为特征的临床-病理生理综合征,主要表现为肺血管过度收缩、肺小动脉重构,从而引起肺血管阻力的增加来实现肺动脉压力的逐渐升高,最终导致右心衰死亡。PH的形成中以肺小动脉重构是主要环节,而在肺血管重构过程中又以炎症反应及肺动脉平滑肌细胞(Pulmonary artery smooth muscle cell,PASMC)异常增殖为中心环节[1],然而近年来IL-6及GATA-6在炎症反应及肺动脉平滑肌细胞异常增殖中的作用受到高度关注。目前全球约有1亿人受到PH的威胁,由于治疗效果差和疾病不可逆性的迅速进展,其死亡率居高不下[2-3]。所以进一步研究PH的发病机制,探讨其治疗新靶点具有重要意义。为此本研究采用野百合碱(MCT)成功诱导大鼠肺动脉高压模型,探讨IL-6与GATA-6在肺动脉高压中表达及意义,为确定肺动脉高压的发生机制和新的治疗靶点提供理论基础。
1 材料与方法
1.1 主要试剂 MCT购于美国MCE公司(批号:Lot#35488);IL-6一抗(山羊抗大鼠)购于美国R&D公司(批号:AF506);二抗(兔抗山羊)购于康为世纪(批号:CW0105s);PageRulerTMPlus Prestained Protein Ladder购于美国THERMO公司(批号:00459134);PCR引物合成由生工生物工程(上海)股份有限公司提供;Ultrapure RNA Kit购于康为世纪公司(批号50250);HiScript II One Step qRT-PCR SYBR Green Kit购于美国Vazyme公司(批号7E220E8);酚:氯仿:异戊醇25∶24∶1购于Solarbio公司生产(批号:P1012)。
1.2 实验动物及分组 健康成年清洁级雄性Sprague-Dawley大鼠54只,体重250~300 g,第三军医大学动物实验室提供,动物饲养由第三军医大学动物实验室负责,本研究已通过贵州省人民医院伦理委员会审核(编号:2018-001),所有操作均遵守实验动物伦理规范。大鼠笼盒饲养,保持环境温度25℃,湿度60%~70%,自由进食、饮水。采用随机数字表法将动物分为3组,分别是生理盐水对照组(A组,n=18),空白对照组(B组,n=18),MCT组(C组,n=18只)。 所有动物实验均在贵州医科大学动物实验中心进行(实验动物使用许可证号:SYXK(黔)2018-0001)
1.3 动物实验模型建立及检测时间点确认 上述大鼠自由饲养1周后于造模前1天取无水乙醇:生理盐水2∶8比例将MCT溶解稀释配置成1%MCT溶液37℃过夜,C组18只大鼠于造模当天取配置完成的MCT按60 mg/kg单次腹腔内注射。 A组18只大鼠于造模当天将0.9%NaCl按60mg/kg单次腹腔内注射。B组18只大鼠不做任何处理。记造模当天为第一日,于造模后第7天(T1)、第14天(T2)、第21天(T3)共3个时间点每次分别从A组、B组、C组大鼠中各随机取6只做实验检测。
1.4 右心导管法测右心室压力 根据文献右心室平均压力可反映肺动脉平均压力[4]。于造模后T1、T2、T3分别取各组大鼠6只,手术前禁食8h,10%水合氯醛(0.04 mL/kg)腹腔注射麻醉,将PE10管预充肝素盐水采用右心导管法经右侧颈外静脉插管至右心室,用BL-420S生物信号采集分析系统(成都泰盟软件有限公司生产)检测右心室压力,并计算右心室平均压力。
1.5 称重法计算右心室肥厚指数 大鼠分别于每个时间点测完右心室压力后均断头处死开胸后完整取出心脏,剪去左右心房及心耳,在肺动脉出口处剪开右心室游离壁组织(RV),其余则为左心室(LV)+室间隔组织(S),洗去血污,吸干水分,然后分别称重,按公式右心肥厚指数=RV/[LV+S]计算。
1.6 肺组织病理学检测 检测右心室压力后,取肺组织用生理盐水通过肺动脉冲洗剩余的血液,放入4%多聚甲醛固定,常规脱水、石蜡包埋、切片、HE染色、封片。在数码三目摄像显微镜(BA400Digital,麦克奥迪实业集团有限公司)下对切片进行图像采集及分析。
1.7 Western Blot检测肺组织IL-6蛋白表达水平 称取适量肺组织,RIPA裂解液与PMSF体积比按99∶1混匀,充分裂解组织,冰上孵育20 min后,12 000 rpm离心10 min,收集上清。根据BAC蛋白试剂盒测各样本蛋白浓度,垂直电泳后,转膜2h,封闭20 min,IL-6一抗4℃过夜(稀释度1∶1 000),兔抗山羊为二抗室温孵育2 h(稀释1∶2 000),设β-actin为内参(稀释度1∶5 000),ECL发光液化学发光,胶片曝光。采用Gel-Pro analyzer4图像分析软件测定各条带的灰度值做定量分析。
1.8 Real-time PCR检测肺组织GATA-6表达水平 Trizol 法提取样本肺组织细胞总RNA,引物设计:上游5'CCCAGCGCAGACCTGTTGGAGGACC3',下游5'TGTGACAGTTGGCACAGGACAG3';β-actin:上游5'TTGCTGACAGGATGCAGAAG3',下游5'TAGAGCCACCAATCCACACA3';按照HiScript II One Step qRT-PCR SYBR Green Kit步骤操作,50℃逆转录3 min,95℃预变性5 min,95℃变性10 s, 60℃退火30 s, 72℃ 延伸30 s,40 个循环。计算2-△△CT值。
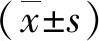
2 结果
2.1 各组大鼠肺组织病理变化见图1。

A、B:A组和B组大鼠肺组织:可见组织小动脉管壁结构清晰,小动脉周围未见炎性细胞浸润;1C:C组T1大鼠肺组织:可见组织小动脉壁厚薄不均,平滑肌细胞胞核形状不规则,小动脉周围水肿;2C:C组T2大鼠肺组织:可见组织小动脉形状不规则,周围炎性细胞浸润成环,小动脉壁被炎性细胞侵蚀;3C:C组T3大鼠肺组织:平滑肌细胞胞核固缩深染,小动脉周围可见淋巴细胞、浆细胞浸润成环,肺水肿明显,肺泡腔内可见大量炎性细胞;HE×100。图1 肺组织HE染色
2.2 MCT诱导SD大鼠右心室平均压增高 与A组和B组比较,C组T1~T3右心室平均压力明显增高(P<0.05);A组与B组比较差异无统计学意义(P>0.05);C组中T1~T3右心室平均压力呈递增性变化,于T3达到最高峰(P<0.05,见表1)。
2.3 MCT诱导SD大鼠右心室肥厚指数增高 与A组和B组比较,C组T1~T3右心室肥厚指数明显增高(P<0.05);A组与B组比较差异无统计学意义(P>0.05);C组中T2与T1比较无明显差异(P>0.05),与T2和T1比较,T3明显增高且达到最高峰(P<0.05,见表2)。


组别T1T2T3A12.41±2.8212.66±2.8712.93±0.63B11.71±2.4913.20±1.5211.47±1.50C18.72±0.77ab24.50±1.81abc34.28±3.55abcdF19.2348.3096.42P0.0010.0000.000
a:与A组比较,P<0.05;b:与B组比较,P<0.05;c:与T1比较,P<0.05;d:与T2比较,P<0.05。
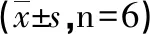
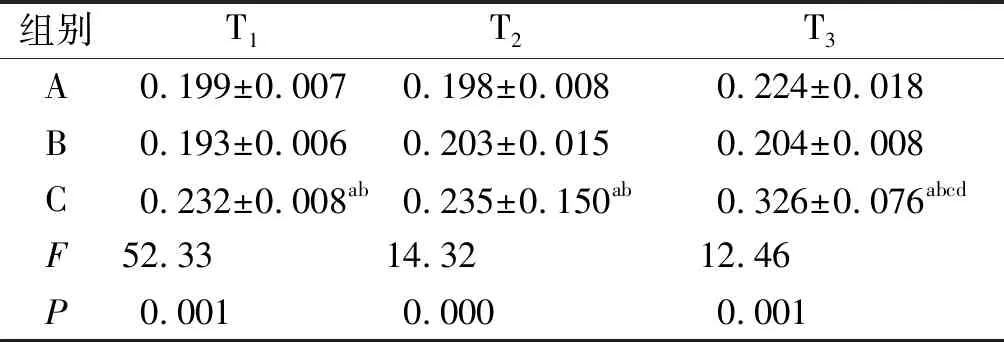
组别T1T2T3A 0.199±0.0070.198±0.0080.224±0.018B 0.193±0.0060.203±0.0150.204±0.008C 0.232±0.008ab0.235±0.150ab0.326±0.076abcdF 52.3314.3212.46P 0.0010.0000.001
a:与A组比较,P<0.05;b:与B组比较,P<0.05;c:与T1比较,P<0.05;d:与T2比较,P<0.05。
2.4 MCT诱导SD大鼠肺组织IL-6水平增高 与A组和B组比较,C组IL-6表达在T1~T3时明显增高(P<0.05);A组与B组比较差异无统计学意义(P>0.05);C组中T2与T1比较差异无统计学意义(P>0.05),与T2和T1比较,T3明显增高且达到最高峰(P<0.05,见表3、图2)。
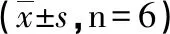
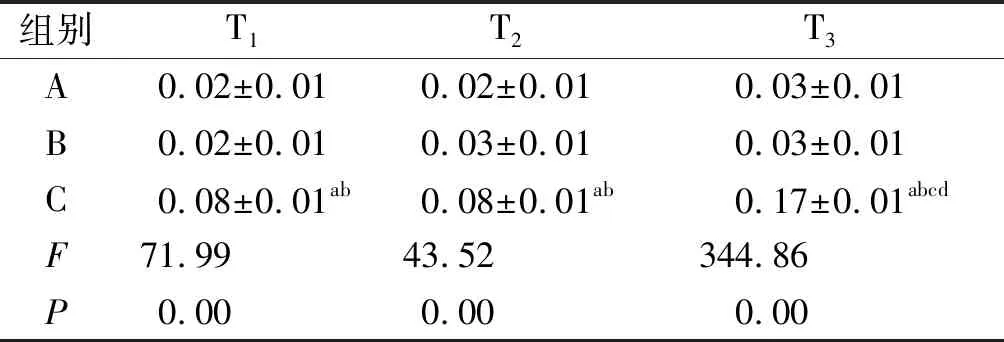
组别T1T2T3A 0.02±0.010.02±0.010.03±0.01B 0.02±0.010.03±0.010.03±0.01C 0.08±0.01ab0.08±0.01ab0.17±0.01abcdF 71.9943.52344.86P 0.000.000.00
a:与A组比较,P<0.05;b:与B组比较,P<0.05;c:与T1比较,P<0.05;d:与T2比较,P<0.05。
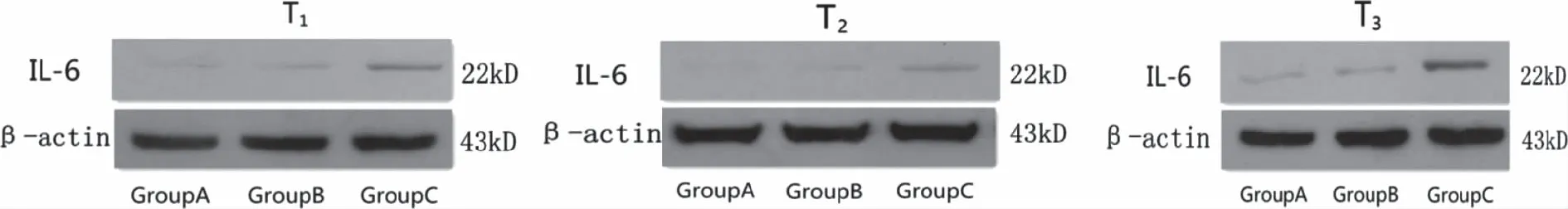
图2 各时间点蛋白免疫印迹法检测结果
2.5 MCT诱导SD大鼠肺组织GATA-6 mRNA水平降低 与A组和B组比较,C组GATA-6的表达在T1~T3时明显降低(P<0.05);A组与B组比较差异无统计学意义(P>0.05);C组中T2与T1比较差异无统计学意义(P>0.05),与T2和T1比较,T3明显降低且达到最小峰(P<0.05,见表4)。
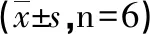

组别T1T2T3A 1.02±0.091.01±0.071.03±0.08B 0.98±0.051.03±0.061.01±0.07C 0.54±0.05ab0.48±0.04ab0.30±0.02abcdF 92.90165.42279.64P 0.000.000.00
a:与A组比较,P<0.05;b:与B组比较,P<0.05;c:与T1比较,P<0.05;d:与T2比较,P<0.05。
2.6 C组中IL-6与GATA-6相关分析 C组中IL-6与GATA-6呈显著负相关(r=-0.887,P<0.05,见图3)。

肺组织中IL-6表达水平图3 IL-6与GATA-6相关分析
3 讨论
PH发生时 PASMC周围的免疫细胞不断积累,导致大量的炎症介质释放,其中IL-6被认为是炎症介质中最重要的靶点之一[5]。在人体通过检测 PH患者肺组织中IL-6的表达发现其水平显著升高,且单核巨噬细胞产生IL-6越多,动脉重构越迅速[6]。在未经肺动脉高压造模的小鼠中,IL-6 的过表达可导致小鼠形成PH[7],而IL-6基因敲除鼠在低氧诱导下未能形成肺动脉压力升高和肺血管重构[8]。既往研究发现TGF-β1/Smad2信号通路对维持血管正常结构及调节炎症反应平衡起到重要作用,而该通路任意一个环节异常均可促进肺血管重构,其机制与在TGF-β1及Smad2刺激下PASMC内IL-6增加有关[9-10]。最新研究显示,在PH的形成中细胞外信号调节激酶1/2(ERK1/2) 对促进炎症反应起到重要作用,一方面活化的ERK1/2可以通过ERK1/2-NF-κB信号通路激活NF-κB来促进炎症介质的释放,另一方面IL-6又可以通过ERK1/2信号通路激活钙离子依赖性的半胱氨酸蛋白酶(calpain)来促进肺小动脉重构[11-12]。本研究结果显示在给予MCT后,肺HE染色可见T1~T3,C组大鼠肺组织逐步出现小动脉壁厚薄不均,平滑肌细胞胞核固缩深染,肺水肿,肺泡腔内大量炎性细胞浸润,而A组和B组未见明显改变,同时与A组、B组相比C组大鼠在T1~T3右心室平均压力及右心室肥厚指数均明显增高,且在C组中T1~T3右心室平均压力及右心室肥厚指数呈递增性变化并在T3达到最高峰,提示本研究PH模型建立成功,在此基础上本研究发现与A组、B组相比C组大鼠IL-6表达在T1~T3明显增高且C组中IL-6表达于T3明显增高并达到最高峰。证实了IL-6在PH形成中发挥着至关重要的作用,同时提示其表达的强弱可以作为评估PH病情程度的一个重要指标。
GATA-6是唯一表达于血管平滑肌细胞的GATA家族转录因子,在肺组织其作用为抑制PASMC进入细胞周期,维持静止期PASMC表型的稳定[13],所以推测GATA-6通过稳定细胞表型来抑制PASMC异常增殖可能具有重要意义。在一项肺癌细胞的研究中观察到,刺激GATA-6的高表达能提高细胞存活率,而抑制GATA-6的表达可以明显减低细胞的存活率[14],进一步证实GATA-6可以抑制细胞进入细胞周期,能保持静止期细胞表型的稳定性。现有研究发现,GATA-6的下调能明显提高肺动脉压力,在MCT大鼠模型中观察到损伤后第3天起肺中的GATA-6 表达便迅速下降,表明GATA-6的低表达可能是引起肺动脉高压中血管重构的早期病理过程[15]。本研究显示,随着PH的进展,与A组、B组比较C组大鼠GATA-6的表达在T1~T3明显降低且C组中GATA-6的表达于T3明显降低并达到最小峰。与上述研究结果趋势一致,表明GATA-6在PH的发生发展中起到重要作用。同时本研究发现,随着PH的逐步进展,IL-6的表达呈持续性升高,而GATA-6的表达呈持续降低,将C组中IL-6与GATA-6行相关分析结果显示呈显著负相关,提示IL-6与GATA-6在PH的发生发展中具有明显相关性。
综上所述,在肺动脉高压大鼠肺组织中IL-6的表达明显增高,GATA-6的表达明显减低,且两者在PH的发生发展过程中发挥着重要作用,并推测IL-6与GATA-6有明显的相关性,但其机制还需进一步研究探讨。
猜你喜欢
杂志排行
遵义医科大学学报的其它文章
- 两种手术方式对单侧完全性唇腭裂患者上颌骨发育影响的对比研究
- Phylogenetic characteristics and population genetic diversity of 15 autosomal STR loci in Tujia population of Guizhou of China
- PAX1甲基化与蛋白检测在宫颈鳞癌及上皮内病变中的应用价值分析
- Effects of icariside II on hepatic cytochrome P450 expression in mice
- 过表达Nrf2对氧化应激状态下骨髓间充质干细胞凋亡的保护作用
- 九香虫水提液对锰中毒大鼠睾丸损伤的抗凋亡作用
