咪喹莫特长期刺激诱发小鼠银屑病样皮损及骨丢失
2019-11-28王玉丹卑明健张兰邵李涛张燕飞田发明李政霄
王玉丹 卑明健 张兰 邵李涛 张燕飞 田发明 李政霄
1华北理工大学医学实验研究中心,河北唐山 063000;2西安交通大学第二附属医院皮肤病院 710000
银屑病是一种常见的慢性炎症性疾病,除皮肤损害外,银屑病病程的长短与骨质疏松呈正相关[1]。一项对美国成年人7 年的随访研究显示,银屑病患者发生骨质减少、骨质疏松、骨软化、强直性脊柱炎和病理性骨折的概率明显升高[2]。然而,目前尚缺乏银屑病伴相关骨丢失的动物模型,这也在一定程度上阻碍了相关防治措施和治疗方案的进一步研究。
目前多采用咪喹莫特乳膏局部涂药1 周左右[3-5]诱导构建银屑病模型,然而短期应用咪喹莫特并不能造成骨量的改变,因此无法用于银屑病合并骨丢失的研究。我们拟通过长期应用咪喹莫特刺激小鼠背部,观察其能否在诱导皮肤炎症的同时,造成骨量丢失和微观结构改变,以期建立相关动物模型,为相关后续研究奠定基础。
材料与方法
一、材料
5%咪喹莫特乳膏(商品名艾达乐),来自英国3M Health Care Limited 公司,批号H20160079。骨保护素(osteoprotegerin,OPG)、破骨细胞分化因子(receptor activator of nuclear factor kappa-β ligand,RANKL)抗体来自北京博奥森生物技术有限公司。肿瘤坏死因子α(TNF-α)、白细胞介素17(IL-17)ELISA 检测试剂盒来自上海鑫乐生物科技有限公司。OPG、RANKL 基因引物由生工生物工程(上海)有限公司合成。微计算机断层扫描(微CT)仪(比利时SkyScan 公司),生物力学机(日本SHIMADZU公司)。
二、方法
1.动物分组及处理:12 只 10 周龄 20 ~ 25 g SPF 级健康雌性昆明小鼠产自北京华阜康生物科技股份有限公司,动物合格证号SCXK(京)2014-0004,动物实验许可证号SYXK(冀)2015-0038。小鼠分笼饲养,每笼6只,饲养室室温21 ~23 ℃,湿度30%~40%。小鼠自由进食饮水,每日更换高压消毒后的干燥无菌垫料,实验期间禁用一切与实验无关的药剂和物品。所有实验行为均依据动物实验伦理委员会制定的动物福利和伦理标准操作。将12 只小鼠适应性饲养1 周后,按照随机数字表法随机分为两组,每组6 只,提前1 d 将背部剃除约2 cm×3 cm区域的毛发,因咪喹莫特乳膏诱导银屑病模型的常用剂量为 62.5 mg[6]和 50 mg[7],予实验组小鼠背部每日涂抹50 mg咪喹莫特乳膏,对照组同部位每日涂抹等体积凡士林软膏,每日观察背部皮肤表现,10周后处死小鼠,处死前观察小鼠皮肤红斑、鳞屑及皮损增厚情况,测量体重并于麻醉后取眼球血,处死后取背部皮损组织,苏木精-伊红(HE)染色后观察组织学改变;取小鼠胫骨进行微CT 测定胫骨近端松质骨骨量及微观结构;取小鼠股骨做三点弯曲实验,检测其生物力学性能。
2.大体观察:记录小鼠背部红斑、鳞屑、肥厚等银屑病的特征性表现,计算银屑病面积和严重程度指数(PASI)评分。小鼠PASI 评分标准:对皮肤红斑、鳞屑、肥厚3个方面进行评分,每种表现按严重程度由低到高分为5个等级:无皮损为0分,皮损轻度为1分,中度为2 分,重度为3分,极重度为4分。
3.HE 染色及组织学观察:将小鼠背部皮损标本固定、脱水、石蜡包埋、切片,HE 染色后光镜下观察。
4.免疫组化染色:取小鼠左侧胫骨近端骨组织标本常规固定、脱钙、脱水、透明、石蜡包埋,制成6 μm厚切片,经烤片、脱蜡、梯度乙醇脱水、抗原修复后,分别滴入OPG 和RANKL 一抗孵育过夜,第2 天孵育二抗,经二氨基联苯胺显色后,再进行复染、盐酸分化,最后脱水、中性树胶封片。光镜下观察胫骨近端松质骨OPG 和RANKL 表达情况并采集图像,用Image-Pro Plus 6.0对图像量化分析。
5.微CT 扫描:取小鼠左侧胫骨,应用微CT 扫描,工作条件为40 keV,250 μA,扫描完成后,应用配套软件对扫描图像进行三维重建及结果分析。对生长板下1 mm 松质骨进行分析,指标包括骨小梁体积比、骨小梁厚度、骨小梁数量(生长板下1 mm松质骨中骨组织与非骨组织交点数量的平均值)、骨小梁分离度(生长板下骨小梁之间髓腔平均宽度)、骨小梁连接密度(生长板下每立方毫米体积中骨小梁网状结构之间的连接数量)。
6.生物力学分析:取小鼠左侧股骨进行三点弯曲试验,支点跨距(L)为8 mm,以股骨后面向下、内侧髁和外侧髁同时接触底座为标准确定标本位置,中央垂直(股骨与载荷成90°角)施加载荷,速率5 mm/min,直至股骨断裂,记录并分析最大压缩载荷及弹性模量。
7.血清TNF-α、IL-17水平分析:参照试剂盒说明,ELISA法检测血清中TNF-α、IL-17的水平。
8.实时 PCR 检测 OPG 和 RANKL mRNA 的表达:取右侧胫骨组织研碎后,按Trizol试剂盒说明书提取RNA,经反转录合成第一链cDNA 后,进行实时荧光定量PCR,以3-磷酸-甘油醛脱氢酶(GAPDH)基因作为内参照。引物序列:OPG 正向引物5′-GGCCTTCTTCAGGTTTGCTGTTCC-3′,反向引 物 5′-GCAGGTCTTTCTCGTTCTCTCAATC-3′;RANKL 正向引物 5′-GATGGAAGGCTCATGGTTGG ATGT-3′,反向引物5′-CGAAAGCAAATGTTGGCGT ACAGG-3′。PCR 反应体系:总体积 50 μl,包括实时 PCR MasterMix 25 μl,cDNA 模板 5 μl,引物(10 μmol/L)各2 μl。OPG和RANKL PCR反应条件相同,即95 ℃ 5 min;95 ℃ 10 s,69 ℃ 30 s,45个循环;72 ℃5 min。以目的基因和内参照基因相对表达量的比值表示目的基因的表达量。实验重复3次。
9.统计学方法:采用SPSS 23.0 进行统计学处理。独立样本t检验比较分析两组指标间差异。P<0.05表示差异有统计学意义。
副词作为一个成员庞杂的词类,其成员分类也较为复杂,但对否定副词的定义和归类学界观点一致,否定副词就是表示否定意义的一类,在句子中修饰谓语。根据否定副词内部语义功能的不同,将其分为四类:一般性否定、己然性否定、判断性否定、祈使性否定[2]。各否定副词在两文献中所占的比例如表1所示:
结 果
一、银屑病小鼠模型的建立
实验组小鼠用药3 ~4 d 后背部皮肤开始出现红斑及少许鳞屑,5 ~7 d 后出现浸润性斑块,表面鳞屑增多,刮屑后可见点状出血现象;8 ~10 d时皮肤红斑加重,浸润增厚明显,随后鳞屑略有减少并稳定在一定水平;第10 周时,红斑范围扩大,皮损增厚甚至出现皲裂。见图1。
10周后,对照组PASI评分为0,实验组PASI评分为9.167± 1.722,两组间差异有统计学意义(t=13.31,P< 0.001)。
二、小鼠体重比较
实验前,对照组小鼠体重(24.84 ± 1.04)g,实验组为(24.98 ± 1.72)g,两组差异无统计学意义(t=-0.16,P=0.881)。诱导10 周后,对照组小鼠体重为(32.22±1.43)g,实验组为(27.10±1.85)g,实验组显著低于对照组(t=4.89,P=0.001)。
三、组织学改变
HE 染色显示,对照组小鼠皮肤正常。实验组小鼠表皮棘层肥厚,表皮突延长,真皮浅层炎症细胞浸润,海绵水肿,血管扩张,充血明显,并可见毛囊增多。见图2。
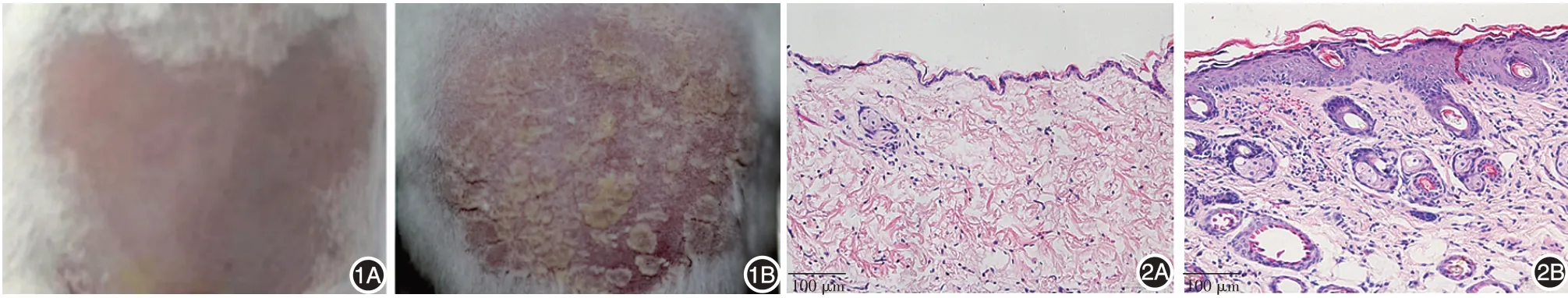
图1 银屑病样小鼠皮肤表现 1A:对照组小鼠皮肤正常;1B:实验组(银屑病样模型组)小鼠皮肤出现红斑、鳞屑、增厚 图2 银屑病样小鼠皮肤组织病理(图中标尺=100 μm) 2A:对照组皮肤未见异常;2B:实验组(银屑病样模型组)小鼠表皮棘层肥厚,表皮突延长,真皮浅层炎症细胞浸润,血管扩张,充血明显
四、OPG、RANKL表达比较
OPG、RANKL 于胫骨近端松质骨中表达。免疫组化染色显示,对照组OPG 和RANKL 表达水平分别为3 307.00 ± 1 158.72、13 644.67 ± 4 764.61,实验组分别为 16 021.33 ± 1 954.61、35 433.33 ±1 197.95,两组间差异均有统计学意义(t值分别为9.692、7.682,均P< 0.01)。见图3。
五、微CT检测结果
实验组胫骨近端松质骨骨小梁体积比、骨小梁厚度均显著低于对照组(P< 0.01 或 < 0.05),骨小梁分离度显著高于对照组(P<0.05),但骨小梁数量和骨小梁连接密度差异无统计学意义(均P>0.05)。见图4、表1。
六、生物力学检测结果
三点弯曲实验检测显示,实验组小鼠弹性模量和断裂能量与对照组差异均无统计学意义(P>0.05)。见表2。
七、ELISA检测结果
实验组小鼠血清中TNF-α、IL-17 水平与对照组差异均无统计学意义(P>0.05)。见表2。
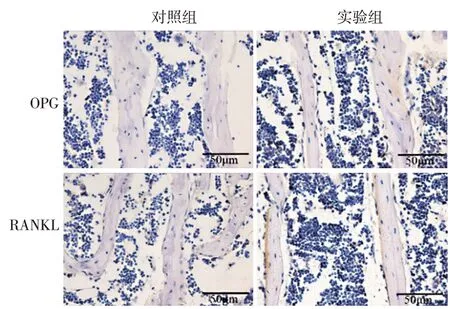
图3 免疫组化染色检测银屑病样小鼠模型胫骨中骨保护素(OPG)、破骨细胞分化因子(RANKL)的表达(图中标尺 = 50 μm)实验组OPG、RANKL表达水平均显著高于对照组
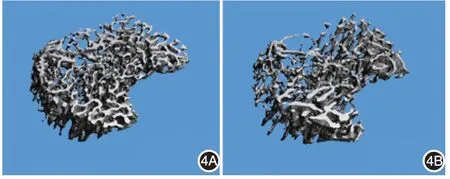
图4 银屑病样小鼠模型胫骨近端松质骨微计算机断层扫描重建图(图中标尺=1 μm) 实验组(4B)骨小梁体积比和骨小梁厚度均显著低于对照组(4A)
表1 微计算机断层扫描分析银屑病样小鼠模型骨量和微结构()
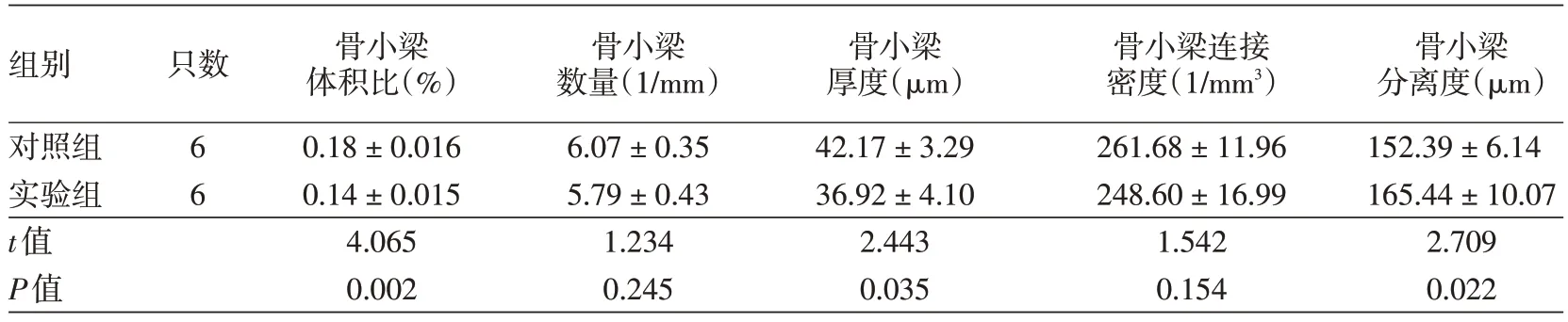
表1 微计算机断层扫描分析银屑病样小鼠模型骨量和微结构()
组别对照组实验组t值P值只数6 6骨小梁体积比(%)0.18±0.016 0.14±0.015 4.065 0.002骨小梁数量(1/mm)6.07±0.35 5.79±0.43 1.234 0.245骨小梁厚度(μm)42.17±3.29 36.92±4.10 2.443 0.035骨小梁连接密度(1/mm3)261.68±11.96 248.60±16.99 1.542 0.154骨小梁分离度(μm)152.39±6.14 165.44±10.07 2.709 0.022
表2 银屑病样小鼠弹性模量、断裂能量和血清TNF-α、IL-17及骨组织中OPG mRNA及RANKL mRNA表达水平比较()
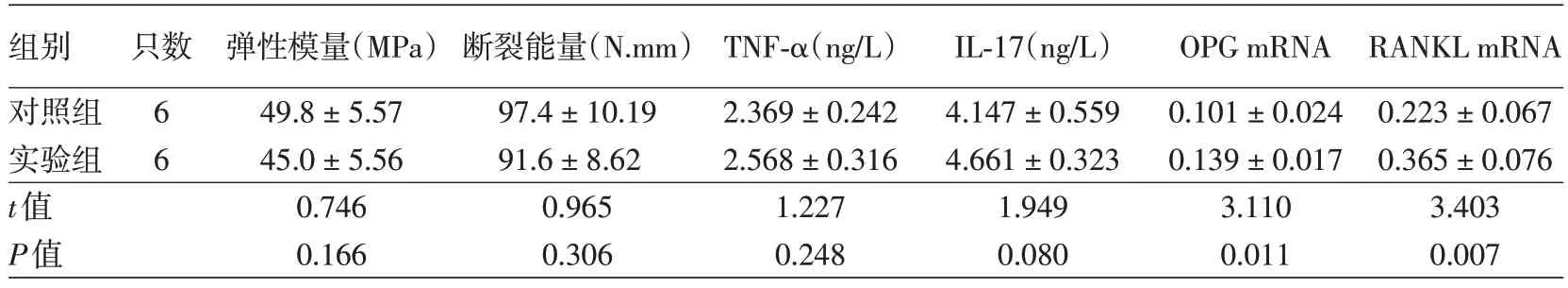
表2 银屑病样小鼠弹性模量、断裂能量和血清TNF-α、IL-17及骨组织中OPG mRNA及RANKL mRNA表达水平比较()
注:TNF-α,肿瘤坏死因子α;IL-17,白细胞介素17;OPG,骨保护素;RANKL,破骨细胞分化因子
组别对照组实验组t值P值只数6 6弹性模量(MPa)49.8±5.57 45.0±5.56 0.746 0.166断裂能量(N.mm)97.4±10.19 91.6±8.62 0.965 0.306 TNF-α(ng/L)2.369±0.242 2.568±0.316 1.227 0.248 IL-17(ng/L)4.147±0.559 4.661±0.323 1.949 0.080 OPG mRNA 0.101±0.024 0.139±0.017 3.110 0.011 RANKL mRNA 0.223±0.067 0.365±0.076 3.403 0.007
八、实时PCR检测结果
实验组小鼠OPG和RANKL mRNA表达水平均显著高于对照组(P<0.05)。见表2。
讨 论
虽然目前尚存争议,但大多数研究证实银屑病可合并骨丢失[6-7]。为建立银屑病合并骨丢失相关模型,我们连续10 周给予小鼠局部咪喹莫特刺激后,发现小鼠在表现出银屑病表型的同时,松质骨骨量减少,微观结构发生退变。这为银屑病合并骨质减少乃至骨质疏松等相关骨丢失疾病提供了动物模型,为研究该疾病相关防治措施及进一步改进治疗方案提供依据。
咪喹莫特诱导的银屑病样小鼠模型是目前应用最为广泛的动物模型,一般7 d 左右即可成模。我们经过长期刺激发现,该方法可使小鼠皮肤长期处于慢性炎症状态,包括典型的鳞屑、红斑、增厚等表现,以及棘层增厚、炎症细胞浸润、血管增生等典型组织学改变。同时,对小鼠胫骨松质骨骨量和微结构分析发现,小鼠并发了骨量下降和微结构的退变。我们曾发现,合并银屑病性关节炎的患者往往因为活动受限而发生骨丢失[7]。此外,银屑病和骨丢失有着共同的炎症介质,包括TNF-α和IL-17,两者既参与银屑病的发生发展[8-9],又在骨质疏松发病机制中扮演重要角色[10],其中IL-17 是银屑病诱发骨丢失的重要介质[11],过表达IL-17 的小鼠表现出银屑病性关节炎、皮肤损害及骨丢失[12]。进一步研究发现,针对IL-17 的抗体也具有治疗两种疾病的潜在作用[13-14]。本研究中,ELISA 检测结果虽然提示TNF-α 和IL-17 在实验组小鼠有升高趋势,但与对照组相比,差异并无统计学意义,其原因有待进一步深入研究。
此外,虽然本研究显示,小鼠模型的胫骨近端松质骨骨量下降和微观结构退变,但生物力学性能与对照组无显著差异,可能因为皮质骨在股骨抗压中占据主导地位,仅松质骨发生改变尚不足以显著改变其抗压性能。另外,临床研究显示,虽然银屑病患者骨密度有所降低,但是骨折发生的风险并未显著增加[6]。这也在临床水平支持我们的推测,即当骨量丢失尤其是松质骨骨量丢失的程度较轻时,丢失的松质骨骨量不足以造成力学性能的显著退变。
OPG 和RANKL 是骨代谢调控相关因子,OPG可通过拮抗RANKL对抗破骨细胞分化的刺激作用而抑制骨吸收,进而发挥骨保护作用。以往研究显示,两者在很多影响骨代谢的慢性炎症性疾病中表达异常,并且是介导免疫细胞与骨代谢功能细胞相互作用的重要媒介[15-17]。研究证实RANKL 有促进破骨细胞在银屑病关节炎和骨质疏松骨折中骨吸收的作用[18],并且银屑病骨质疏松风险增加主要与持续的慢性炎症过程有关[19]。本研究中,我们通过免疫组化染色和 PCR 检测发现,OPG 和 RANKL 在实验组小鼠均显著高于对照组小鼠,提示该模型小鼠骨形成和骨吸收均有所增加。实验组血清TNF-α和IL-17表现出升高趋势,可能是OPG和RANKL高表达的潜在刺激因素。有研究表明,IL-17A可以通过促进RANKL和巨噬细胞集落刺激因子表达激活破骨细胞形成,促进骨丢失[20-21]。而TNF通过促进单核细胞破骨细胞分化因子受体表达从而将单核细胞转化为破骨细胞前体细胞,并可以上调成骨细胞谱系细胞RANKL的表达[22]。而在TNF及TNF受体1(P55)敲除小鼠中,卵巢切除后并未出现骨丢失[23]。TNF 及 IL-17 等促炎症细胞因子与 RANKL在破骨细胞增殖分化中具有协同作用,并且以IL-23/IL-17 为轴心的免疫反馈系统与T 细胞密切相关。活化的T 细胞释放RANKL,更好地揭示了炎症性骨病和骨丢失的发病机制[24]。结合上述研究结果及皮肤表现,我们推测,皮肤炎症刺激导致小鼠体内炎症反应,相关炎症介质进一步刺激免疫细胞释放相关因子,在参与皮肤损害发生发展的同时,对骨代谢也产生一定的影响,并首先刺激RANKL 介导的破骨细胞骨吸收活性,进而诱发机体保护性产生更多OPG,但由于骨吸收活性大于骨形成,最终导致骨量丢失。故我们推测咪喹莫特长期刺激导致的慢性炎症及活化的免疫细胞与RANKL 间的反馈环路是诱发骨丢失的重要环节和主要机制。
综上,我们通过咪喹莫特长期局部刺激小鼠皮肤,在造成小鼠银屑病样皮损表现的同时,也导致其骨代谢状态的改变,并最终造成松质骨骨量丢失。因此,背部皮肤长期接受咪喹莫特刺激的昆明小鼠可以作为银屑病合并骨丢失相关研究的动物模型。
利益冲突所有作者均声明不存在利益冲突
