基于高通量RNA转录组测序技术分析特应性皮炎患者皮损与非皮损组织差异表达基因
2019-11-28陈丽洁梁景耀张锡宝邵蕾潘清丽何素玲刘玉梅王建琴
陈丽洁 梁景耀 张锡宝 邵蕾 潘清丽 何素玲 刘玉梅 王建琴
广州医科大学皮肤病研究所 广州市皮肤病防治所 510095
特应性皮炎(atopic dermatitis,AD)是一种常见的慢性遗传相关性炎症性皮肤病,发病机制尚未完全明确。多认为AD 发病与遗传易感性、环境因素以及免疫因素密切相关[1]。目前对AD分子表型的认识多基于基因芯片或者实时定量聚合酶链反应测定等方法,而基于新一代RNA测序(RNA-seq)的研究很少。自2001年他克莫司及吡美莫司外用制剂上市以来,暂未见其他可以广泛使用的安全高效治疗AD的药物[2]。提高对AD分子表型的认识,有助于其新疗法,特别是靶向治疗的研发。RNA-seq能够弥补表达谱芯片研究的不足,它不依赖于预设计,允许对整条基因组进行分析,更大范围地准确检测基因表达水平。转录组(transcriptome)指特定组织或细胞在某一功能状态下所有转录本的总和,包括编码RNA(mRNA)和非编码RNA(ncRNA),它们能够反映细胞的生长、发育、凋亡等一系列重要的生理过程。以Illumina 为基础的转录组测序RNA-Seq,具有通量更高、运行时间更短、测序片段更长、分析成本更低等优点。本研究运用RNA-seq技术筛选AD 皮损及非皮损组织的差异表达基因,从功能基因组水平揭示AD 的发病机制,为AD 的分子诊断、药物治疗、预防和新型药物研发提供新的契机。
对象与方法
一、对象
选取2016年7-10月于广州市皮肤病防治所/广州医科大学皮肤病研究所门诊就诊的5 例汉族AD患者,男3例,女2例,年龄9 ~ 23岁。
纳入标准:①符合Williams诊断标准;②SCORAD评分>25的中重度患者[3];③切取皮损组织前1周没有局部外用药物治疗,2 周内未口服治疗AD 的药物。排除标准:患药疹、高IgE综合征、恶性嗜酸性粒细胞增多、皮肤感染、结缔组织病及肿瘤性疾病等。选取腹部(2例)、背部(2例)或大腿处(1例)皮损及非皮损部位(在皮损边缘取材,离皮损区约1.5 cm)皮肤组织,分别装入有RNAlater 保存液(德国,Qiagen公司)的5 ml冻存管,-80 ℃冰箱保存,用于后续总RNA提取。
本研究经过广州市皮肤病防治所/广州医科大学皮肤病研究所医学伦理委员会批准(批件号:201611),取材前受试者或其监护人均签署知情同意书。
二、方法
1.RNA 提取及转录组测序:按照Trizol(美国Invitrogen 公司)法提取总RNA,构建文库,使用Agilent 2100 Bioanalyzer(RNA 6000 Nano Kit,美国Agilent 公司)检测总 RNA 浓度、RIN 值、28S/18S 和片段大小。qRT-PCR 对文库的有效浓度进行准确定量,以保证文库质量。基于边合成边测序(sequencing by synthesis,SBS)技术,利用 BGISEQ-500(深圳华大基因)平台进行高通量测序,得到100 bp的测序读长。
2.测序数据过滤:将测序所得的原始数据(即raw reads)中低质量、接头污染以及未知碱基N 含量过高的reads 过滤掉,得到有效reads(即clean reads),以保证结果的可靠性。
3.基因差异分析、功能注释及生物学通路分析:使用DEseq2和PossionDis方法进行差异检测分析,DEseq2方法基于负二项分布原理,本研究根据既往文献[4-5]描述的方法进行差异表达基因检测。对差异检验得到的P值做多重假设检验校正[6],通过控制错误发现率(false discovery rate,FDR),用于控制多重试验中的Ⅰ型错误率[7]来决定P值的阈值。不同样品之间表达水平变化倍数超过2 倍(|log2FC| ≥ 1)且FDR 校正P< 0.05 表示差异有统计学意义。根据差异基因检测结果,使用R软件中的pheatmap 函数进行层次聚类分析。利用基因本体 论(gene ontology,GO)数 据 库(http://www.geneontology.org/)对差异表达基因进行功能注释,采用 COG(cluster of orthologous groups of proteins)对差异表达基因进行分类统计,P≤0.01的功能视为显著富集。利用KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库(http://www.genome.jp/kegg)对差异表达基因进行pathway 功能分析,P≤0.01的通路视为显著富集。

表1 候选基因引物序列
4.qRT-PCR 验证候选基因:为验证AD 患者转录组测序结果的准确性,选取转录组测序结果中的5条基因,在NCBI上检索目的基因CXCL1、KRT6A、IL36A、SERPINB4、PSAPL1 的 mRNA,用 Primer Premier5 设计引物,见表 1。另外选取 5 例 2018 年5-7月在广州市皮肤病防治所/广州医科大学皮肤病研究所门诊就诊的中重度汉族AD 患者,排除和纳入标准同前,男4例,女1例,年龄17 ~25岁。患者或其监护人签署知情同意书后,每例取皮损、非皮损部位组织各1 份,分别提取总RNA,逆转录为cDNA,使用ChamQ SYBR qPCR Master Mix 试剂盒(南京诺唯赞生物科技有限公司),参照说明书进行qPCR 扩增,依据Real-time Quantitative PCR(美国ABI公司,StepOne Plus)系统说明书进行qRT-PCR。每份样品重复检测3次,采用2-△△Ct法进行相对表达量计算。
结 果
一、RNA-seq数据分析
通过RNA-seq分析,每份样品平均获得10.96 Gb数据,clean reads Q30 都在84.4%以上。共检测到基因21 729 条,其中已知的基因为19 268 条,预测新基因为2 545 条。检测出23 153 个新转录本,其中18 889 个属于已知蛋白编码基因的新的可变剪接亚型,2 545个属于新的蛋白编码基因的转录本,其余1 719个属于长链非编码RNA。
二、差异表达基因检测
RNA-seq 分析显示,AD 患者皮损与非皮损组织相比,78 条基因表达差异有统计学意义,其中67 条在皮损中高表达,11 条低表达,包括已知与AD 炎症(CXCL1/2/8、IL6/IL1β、MMP1、SERPINB4、S100A2、GZMB、OASL、OSM)、屏障功能(KRT16、FABP5、CYP1A1)、角质形成细胞分化(IL-20)等相关的基因。见图1、表2。在类聚分析热图中,皮损和非皮损表达的基因可以明显的区分出来,见图2,表明皮损和非皮损有各自特征的表达谱,有不同的病理生理学发病机制。
三、差异表达基因的GO分析
对这些差异表达基因进行GO 分析显示,在生物过程分类中,数量最多的是参与细胞过程(53 条)的基因,第2、3 位分别是参与单组织过程(47条)和代谢过程(45条)的基因。在分子功能分类中,催化活性(46 个)和结合整合功能(27 个)的基因数量最多。在细胞组分分类中,细胞(43个)、细胞组分(43 个)、细胞膜(30 个)基因数位居前三。此外,34条基因参与刺激反应,27条参与多细胞生物过程,还有其他较多基因参与生物调控、定位和信号传递相关功能。见图3。
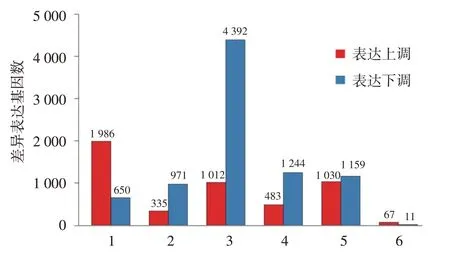
图1 5 例特应性皮炎皮损与非皮损组织差异基因表达量比较 1 ~5:分别为病例1 ~5的皮损与非皮损比较;6:5例合计的皮损与非皮损比较

表2 特应性皮炎皮损与非皮损组织相比差异表达基因及差异倍数
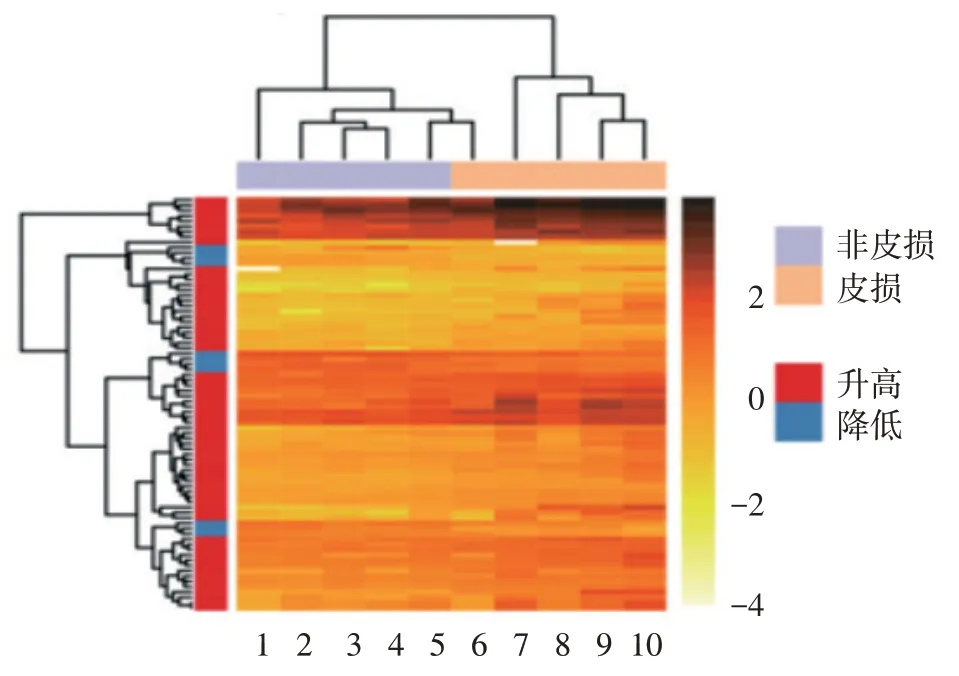
图2 特应性皮炎皮损与非皮损基因表达聚类分析 1 ~5:分别为病例4、5、1、3、2 的非皮损;6 ~ 10:分别为病例1、2、4、5、3 的皮损
四、差异表达基因Pathway功能分析
78 条差异表达基因富集于132 条通路,其中13条通路显著富集,包括白细胞介素17信号通路、NOD 样受体信号通路、Toll 样受体信号通路、肿瘤坏死因子信号通路、细胞因子受体、胞质DNA-传感通路、沙门菌感染相互作用通路等。见图4。
五、qRT-PCR验证基因表达变化
结果显示,CXCL1、KRT6A、IL36A、SERPINB4在皮损中的mRNA 表达明显高于非皮损组织,而PSAPL1在皮损中的mRNA表达明显低于非皮损组织,与转录组测序结果趋势一致(图5)。
讨 论
目前AD转录组的研究主要利用传统的基因芯片技术,只能检测已知基因的转录本表达量,不能发现未知的新转录本,基因组覆盖面较狭窄。RNASeq 测定差异基因的准确率显著高于基因芯片[8]。了解患者皮损和非皮损差异表达基因对于探讨AD的发病机制及寻找更精确的诊断方法及生物学标志物均具有重要意义。
我们首次运用新一代高通量测序技术对汉族中重度AD患者皮损和非皮损组织的转录组进行测序和功能分析。样品比对显示,基因组的平均比对率为 92.26%,clean reads Q20 都在95.34%以上,说明此次序列的质量满足转录组分析的要求。共筛选得到21 729 条基因,其中19 268 条为已知基因,2 545条为预测的新基因。对皮损及非皮损组织进行差异表达基因分析,并对差异表达转录组基因进行功能分析,发现差异表达基因可能通过调节相关基因mRNA的表达进而影响AD炎症的病理生理学改变。根据KEGG 数据库分析发现,这些差异基因涉及132 个具体的代谢途径分支,影响IL-17 信号通路、NOD样受体信号通路、Toll样受体信号通路、肿瘤坏死因子信号通路、细胞因子受体、胞质DNA-传感通路等,为进一步大量挖掘AD 发病过程中的重要基因,开展AD 靶点治疗及功能验证等提供了基础数据。
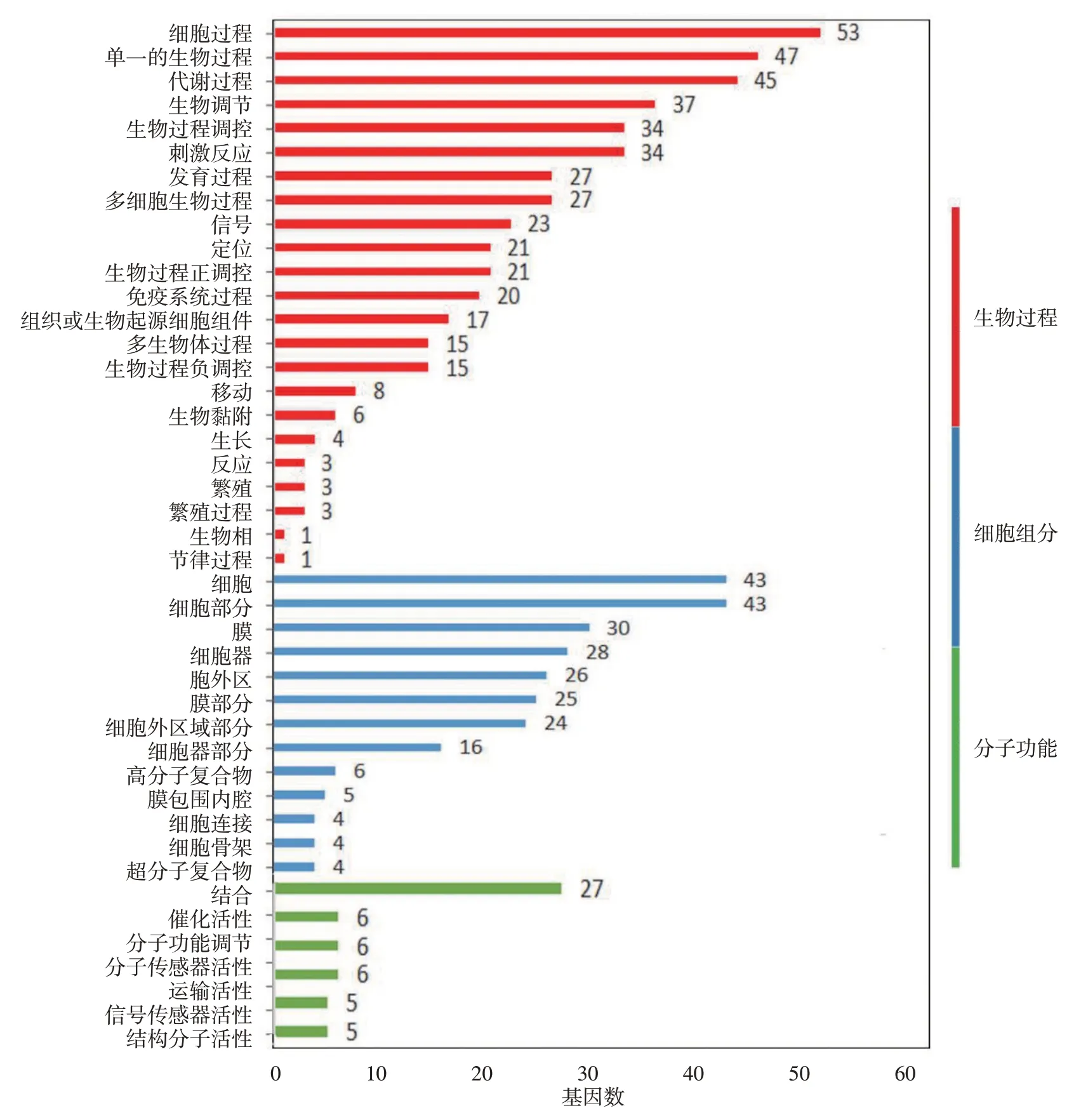
图3 特应性皮炎皮损差异表达基因GO功能分类图
本研究发现的78 条显著差异表达基因,其中27 条目前已有报道和AD 相关,包括CXCL128、IL61β、MMP1、SERPINB4、S100A2 等。我们随机选取5个候选基因用qRT-PCR进行验证,结果与转录组测序趋势一致,表明本研究结果可靠。在78条显著差异表达基因中,上调倍数较高的6条基因与IL-17通路中中性粒细胞趋化、对外界病原的免疫、炎症宿主的自身免疫防御调节相关。有研究显示,IL-17 在亚裔AD 患者的发病机制中起非常关键的作用[9],本研究结果与上述研究相符。已发现银屑病和AD 皮损中IL-17 过表达,而且有研究表明,IL-17C 作为炎症的主要介质在这两种疾病中具有致病性[10-11],因而提示抗IL-17 的生物制剂有可能用于治疗亚裔AD。一项抗IL-17c 的单克隆抗体MOR106 的Ⅰ期临床试验结果令人鼓舞,研究组80%的AD 患者达到EASI50,相比之下,安慰剂组比例不到20%,而且MOR106还显示出良好的安全性[12]。2018年Sanyal等[10]运用免疫组化、RNA-Seq等发现,非洲裔美国AD 患者具有Th2/Th22 偏向性,Th2 和Th22 标记物及IgE 与疾病严重程度显著相关,但其Th1和Th17轴较欧洲裔美国AD患者衰减[13]。2015年一项运用RNA-seq对18例中重度美裔AD患者皮损和非皮损组织差异表达基因的研究发现,髓系细胞表达的触发受体TREM-1(triggering receptor expressed on myeloid cells 1)通路和IL-36因子基因在患者皮损中高表达[14]。本研究中发现的差异表达基因与该研究有很多重合,但本研究显示,汉族AD的差异表达基因具有以IL-17为主的模式特点。
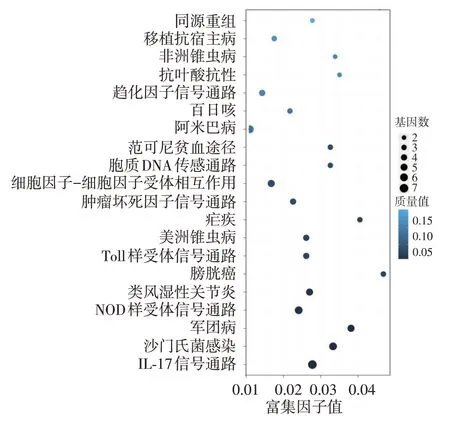
图4 特应性皮炎皮损差异表达基因Pathway富集结果
本研究显示,炎症相关基因CXCL1、IL-1β、CXCL8、IL1RL1、OSM 等在皮损处显著高表达。Jung 等[15]发现用异泽兰黄素 eupatilin 治疗 AD 小鼠,IL-1β 水平会相应降低。Khattri 等[16]用生物制剂ustekinumab 治疗中重度成人AD,4 周后CXCL1水平降低。在哮喘患者痰细胞中CXCL8的表达水平和巨噬细胞的百分比呈负相关[17],在严重的哮喘患者中 OSM 主要来源是中性粒细胞[18]。IL-33 和IL1RL1 变异与巴西人群中哮喘和过敏性哮喘有关,而RA50、IL-33 和 IL1RL1 多态性与中国人群特应性哮喘有关[19]。
本研究显示,屏障功能相关的SERPINB3/B4、KRT16 基因在汉族AD 患者皮损处显著高表达。已经有研究证实,SERPINB3/B4和小鼠早期炎症和屏障功能障碍相关,且用于构建小鼠AD 模型[20]。有学者汇总5 项独立研究分析AD 差异表达基因[21],总共127个样本,89条基因表达有显著差异,功能注释显示这些基因参与免疫反应(如防御素、原蛋白)、角质形成细胞分化、表皮发育(如FLG、CORIN、AQP、LOR、KRT16)、炎 症(如 IL-37、IL27RA、CCL18)和脂质代谢(如AKR1B10、FAD7、FAR2)。本研究发现,角质形成细胞分化相关基因IL-20 在皮损处显著高表达。促炎细胞因子IL-20和IL-24 对FLG 表达有一定影响,并参与FLG 的终末分化[22]。
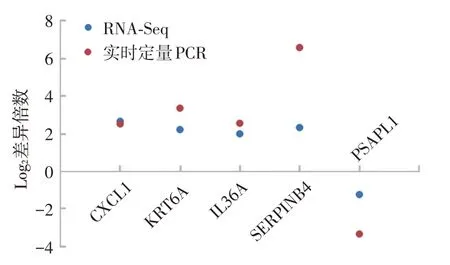
图5 特应性皮炎(5例)皮损与非皮损组织差异表达基因的实时定量PCR 验证 选取5 个转录组测序所得的差异表达基因CXCL1、KRT6A、IL36A、SERPINB4、PSAPL1 进行实时定量 PCR 验证,结果与转录组测序显示的表达趋势一致
综上,本研究通过新一代高通量转录组测序技术筛选出汉族中重度AD皮损和非皮损间差异表达基因,为进一步探索AD 的病理生理学机制和个性化治疗提供了依据。
利益冲突所有作者均声明不存在利益冲突
