重组人脂蛋白相关磷脂酶A2的原核表达及单克隆抗体制备
2019-11-27欧兰香王佳颖解光宁朱之炜
欧兰香,陈 振,王佳颖,解光宁,王 岩 ,朱之炜△
(1.山东莱博生物科技有限公司,山东济南 250100;2.山东省体外诊断用免疫原料制备与标记工程技术研究中心,山东济南 250100)
脂蛋白磷脂酶A2(Lp-PLA2)是近年来一种被广泛关注的新型炎症标志物。Lp-PLA2蛋白包含441个氨基酸,相对分子质量为45.5×103[1],由PLA2G7基因编码[2],该基因由12个外显子组成,位于人类6号染色体的6p12-p21.1区段。Lp-PLA2是一类不依赖于钙离子的磷脂酶,能够降解氧化磷脂,并将它们降解为溶血磷脂及氧化游离脂肪酸等。这些降解产物会刺激机体分泌细胞因子和黏附因子,进而导致血管内皮功能异常[3-4],最终形成早期动脉硬化斑块。检测血液中的Lp-PLA2水平,能够帮助预测冠心病或缺血性卒中的发生[5-6]。本研究通过构建Lp-PLA2原核表达载体,通过诱导、纯化获得人Lp-PLA2重组蛋白,并通过重组抗原免疫得到Lp-PLA2的单克隆抗体,为后续Lp-PLA2免疫检测试剂盒的开发奠定基础。现报道如下。
1 材料与方法
1.1材料
1.1.1质粒、菌株 质粒pET32a(+)、大肠杆菌DH5α、Rosetta(DE3)菌株由本实验室保存。
1.1.2主要试剂 人单核细胞(THP-1)cDNA表达文库为本实验室前期构建;pEASY-T1 Cloning Kit购自北京全式金生物技术有限公司,Prime STAR高保真Taq酶,T4 DNA连接酶,限制性内切酶NotⅠ、SalⅠ,DNA凝胶回收试剂盒购自大连宝生物工程有限公司;弗氏完全佐剂与不完全弗氏佐剂、降植烷、PEG4000、HAT条件培养基购自Sigma公司;Protein A购自美国GE公司;小鼠单抗Ig类/亚类鉴定试剂盒购自洛阳佰奥通实验材料中心;酶标板购自厦门云鹏科技发展有限公司。
1.1.3实验动物 Balb/c小鼠购自济南朋悦实验动物繁育有限公司。
1.2方法
1.2.1Lp-PLA2基因的获得 在美国国立生物技术信息中心(NCBI)上检索得到人Lp-PLA2基因序列,并设计特异性引物在上、下游两端分别添加NotⅠ、SalⅠ酶切位点,引物序列见表1。以人类cDNA文库为模板,对PLA2G7基因进行扩增。反应程序如下:95 ℃ 5 min;95 ℃ 60 s,55 ℃ 40 s,72 ℃ 80 s,35个循环;72 ℃ 5 min。通过电泳,回收1 275 bp的目的片段,与pEASY-T1中间载体进行连接,转化大肠杆菌DH5α感受态细胞,将菌液涂布于含有卡那霉素的LB固体培养基上,37 ℃培养过夜。挑取单克隆,扩大培养后提取质粒,进行PCR和酶切鉴定,将筛选得到的阳性克隆送济南博尚生物有限公司进行测序。

表1 PLA2G7基因扩增引物序列
1.2.2原核表达质粒pET32-PLA2G7的构建 使用NotⅠ、SalⅠ分别对pEASY-PLA2G7与pET32a(+)进行双酶切,回收目的基因片段与原核表达载体片段,按照摩尔比3∶1的比例进行混合,16 ℃连接3 h,转化大肠杆菌DH5α感受态细胞,将菌液涂布于含有卡那霉素的LB固体培养基上,37 ℃培养过夜。挑取单克隆,扩大培养后提取质粒,进行PCR和酶切鉴定,阳性克隆送济南博尚生物有限公司进行测序鉴定。提取质粒后,再转化大肠杆菌Rosetta(DE3)感受态细胞。
1.2.3重组人Lp-PLA2蛋白的表达 将保存于-80 ℃的pET32a(+)-PLA2G7菌液取出,接种于LB培养基中,37 ℃培养过夜。按照万分之一的比例将菌液集中于诱导培养基(NaCl 9 g,蛋白胨11 g,酵母提取物22 g,甘油4 mL,卡那霉素0.1 mg/mL)中,37 ℃培养3 h,至吸光度(A)600在0.5~0.8时,加入异丙基硫代半乳糖苷(IPTG)诱导蛋白表达,30 ℃继续高速振荡培养7 h。5 000 r/min离心10 min收集菌体,经超声破碎后再离心,分离获得上清液,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测蛋白表达情况。
1.2.4重组人Lp-PLA2的纯化和鉴定 使用亲和镍柱层析法对含有Lp-PLA2的上清液进行初步纯化。洗脱缓冲液:Tris 20 mmol/L,NaCl 100 mmol/L,咪唑500 mmol/L,甘油 10%,CHAPS 0.6% W/V,pH 8.5。初纯液通过经GE-DEAE柱进行NaCl梯度洗脱,收集洗脱组分,再经过P-6DG柱进行脱盐,收集洗脱组分。将得到的重组蛋白进行SDS-PAGE电泳,通过半干法将蛋白转移到硝酸纤维素膜上;5%脱脂奶粉室温封闭3 h后;与兔抗人Lp-PLA2抗体(1∶1 500倍稀释)进行杂交,28 ℃孵育3 h;取出硝酸纤维素膜,漂洗后,加入辣根过氧化物酶标记的羊抗兔IgG(1∶5 000倍稀释),室温孵育1 h;漂洗后使用ECL进行显色。
1.2.5Lp-PLA2单克隆抗体的制备 将制备得到的重组人Lp-PLA2与等体积的完全弗氏佐剂充分混合,对Balb/c小鼠进行皮下多点注射(50 μg抗原/只)。4周后测定血清效价,选择免疫反应好的个体加强免疫,将抗原与不完全弗氏佐剂充分混合后,通过皮下多点注射(25 μg抗原/只),连续进行6次再免疫,细胞融合前连续加强免疫2次;之后取脾细胞与Sp2/0骨髓瘤细胞进行融合。融合细胞在37 ℃培养9~11 d,待培养孔中生长出较大的细胞克隆后,进行酶联免疫吸附试验(ELISA)筛选;将阳性克隆进行有限稀释后,进行4次克隆化培养,保存细胞。按照0.5 mL/只的剂量使用降植烷处理小鼠,1周后在腹腔内接种杂交瘤细胞(2×106细胞/只),饲养10 d后收集腹水。腹水经硫酸铵沉淀后,使用Protein A进行亲和纯化。
1.2.6重组人Lp-PLA2单抗隆抗体的鉴定 用pH 9.6的碳酸盐缓冲液将重组人Lp-PLA2稀释到0.25 μg/mL,包被酶标板,4 ℃过夜。第2天取出酶标板,按照小鼠单抗Ig类/亚类鉴定试剂盒说明书流程,对纯化得到的不同单克隆抗体进行亚类鉴定。为了挑选包被抗体和检测抗体的最佳组合,将不同单克隆抗体分别包被酶标板和酶(HRP)标记,进行两两配对的ELISA检测,筛选最佳抗体组合。用稀释液将纯化后的抗体进行倍比稀释,通过ELISA法检测抗体效价,对照为10 000倍稀释后的小鼠免疫前血清。用pH 9.6的碳酸盐缓冲液将人Lp-PLA2单克隆抗体稀释,包被酶标板,4 ℃过夜。第2天取出酶标板,TSBT洗涤1次,5%BSA溶液37 ℃封闭2 h;每孔分别加入纯化后的Lp-PLA2及C反应蛋白、纤维蛋白酶原的标准品,37 ℃孵育1 h。孵育完成后取出酶标板,TBST洗涤3次,分别加入标记了HRP的人Lp-PLA2单克隆抗体100 μL(1∶4 000稀释),37 ℃孵育1 h。TBST洗涤5次,加入TMB底物,37 ℃显色20 min。取出后加终止液,在酶标仪上测定A450读数,分析所制备的单克隆抗体的特异性。
2 结 果
2.1原核表达质粒的鉴定 以人THP-1 cDNA文库为模板,利用特异性引物扩增得到PLA2G7基因片段,见图1。与pEASY-T1连接后送公司进行测序;确定片段正确后,用于构建pET32a(+)-PLA2G7质粒。使用NotⅠ、SalⅠ对已构建的重组质粒pET32-PLA2G7电泳后分离得到5.4 kb的载体片段及1 257 bp的目的序列片段,见图2。经测序,PLA2G7片段无碱基突变,与NCBI已公布的基因编码序列一致,说明载体构建成功,可用于后续实验。

注:M表示DL2000 DNA marker
图1 PLA2G7基因PCR扩增图
2.2重组人Lp-PLA2的表达、纯化与鉴定 经过条件摸索,在本研究中,重组Lp-PLA2优化表达体系如下:37 ℃培养条件下,A600为0.5~0.8时,加入0.2 mmol/L的IPTG,30 ℃培养7 h,重组人Lp-PLA2能够在DE3中以可溶蛋白的形式大量表达。经SDS-PAGE电泳检测,重组蛋白约为47×103,与理论值基本一致,蛋白在上清中表达量最高,占菌体总蛋白的50%左右,见图3。这表明重组蛋白能够在大肠杆菌中稳定表达,能够用于后续实验。将纯化后的重组人Lp-PLA2通过SDS-PAGE电泳将蛋白分离,通过半干法转印至硝酸纤维素膜上,与商业化的Lp-PLA2抗体杂交,显色后在47×103处出现特异性条带,见图4,这表明纯化后的重组人Lp-PLA2具有较好的免疫学活性。

注:M表示DL2000 DNA marker;1~2表示pET32a(+)-PLA2G7质粒NotⅠ与SalⅠ双酶切产物
图2 pET32-PLA2G7酶切电泳图

注:A图中M表示蛋白分子量标准,1表示未经IPTG诱导菌液,2表示IPTG诱导后的菌液,3表示沉淀,4表示上清;B图中M表示蛋白分子量标准,Lp-PLA2表示纯化后的重组人Lp-PLA2
图3重组人Lp-PLA2的表达和纯化

图4 重组人Lp-PLA2的蛋白免疫印迹检测
2.3重组人Lp-PLA2单克隆抗体的鉴定 经过一系列筛选,共得到5株单克隆抗体(1D7、2A3、2E6、5F1和6H12),经过蛋白免疫印迹验证,它们都能特异性识别Lp-PLA2蛋白,见图5。使用抗体分型试剂盒对所述单克隆抗体进行亚型鉴定,其中1D7、2E6、5F1和6H12为IgG2b亚型,轻链为κ链,2A3为IgG2a亚型,轻链为λ链。对5株抗体进行两两配对的双抗体夹心ELISA检测分析显示,使用2E6作为包被抗体、5F1为检测抗体时,具有较高的检测灵敏度,见表2。通过间接ELISA法检测,本实验所制备得到的Lp-PLA2抗体效价可达1∶2×106以上,见图6。将该抗体包被酶标板,对Lp-PLA2蛋白、纤维蛋白原、C-反应蛋白进行ELISA检测,发现抗体不会与纤维蛋白原、C-反应蛋白等发生交叉反应,具有较好的特异性,见图7。

表2 单克隆抗体的配对筛选
注:—表示未进行此组检测
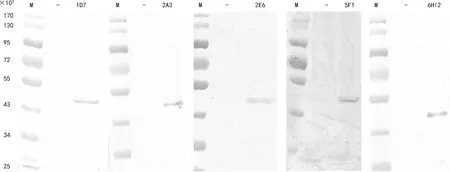
注:M表示蛋白分子量标准;-表示:pET32a(+)空白质粒阴性对照
图5 Lp-PLA2单克隆抗体的蛋白免疫印迹检测

图6 Lp-PLA2抗体效价分析
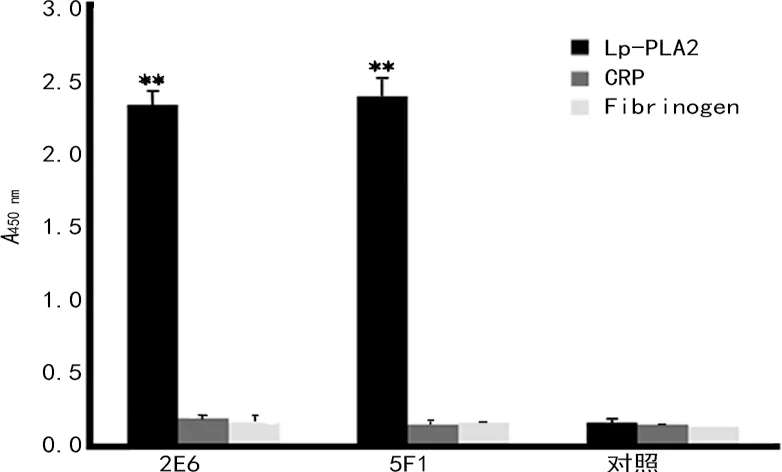
图7 Lp-PLA2单克隆抗体与其他心血管标志物的交叉反应性
3 讨 论
心血管疾病是一种在全球范围内危及人类生命安全的疾病,其发生、发展与动脉硬化的产生具有密不可分的关系,而Lp-PLA2在动脉硬化斑块形成过程中又发挥了重要作用[7-9]。在体内,Lp-PLA2与高密度脂蛋白和载脂蛋白A1呈负相关[10]。Lp-PLA2能够水解磷脂酰胆碱、磷脂酰乙醇胺等甘油酸脂的sn-2位磷脂键[11],产生游离型氧化脂肪酸和溶血卵磷脂。因此,又被称为血小板活化因子乙酰水解酶(PAF-AH)[12]。Lp-PLA2的水解产物很多都能够刺激炎性因子,如细胞黏附因子、细胞因子等的产生,引发血管内皮损伤,使得黏附在内皮细胞上的单核细胞数量增加,血管内皮通透性改变,当单核细胞通过受损内皮进入血管内膜后,会形成巨噬细胞并吞噬氧化型低密度脂蛋白,产生动脉粥样硬化斑块;巨噬细胞分泌的炎性因子也会加速动脉硬化斑块的形成。2005年美国食品药品管理局已批准将Lp-PLA2作为动脉硬化和缺血性卒中的风险评价因素[5]。
目前,已有课题组利用DNA重组技术在不同生物(如大肠杆菌、昆虫、酵母)中进行过Lp-PLA2的表达研究,但存在不表达或表达量较低的情况[13]。在本研究的前期实验过程中发现Lp-PLA2主要以包涵体的形式被分泌出来。通过使用含有硫氧还蛋白(trxA)和便于蛋白生产、纯化的双融合伴侣原核表达载体pET32a[14],从而增加重组Lp-PLA2的可溶性。使用相对较低的温度(30 ℃)诱导蛋白表达,并在培养基中适当提高抗菌药物水平(0.1 mg/mL的卡那霉素),这些方式也有助于提高外源蛋白表达水平[15]。
4 结 论
本研究获得大量高纯度的人Lp-PLA2重组蛋白,并通过该蛋白免疫得到对应的具有高特异性的单克隆抗体,为后续Lp-PLA2检测试剂盒的开发奠定了基础。
