非小细胞肺癌PD-L1蛋白表达、EGFR基因突变状态及二者相关性研究
2019-11-27兰建云邵伟伟胥传海
邹 琳,兰建云,宋 曙,邵伟伟,胥传海△
(盐城市第一人民医院:1.转化医学中心;2.病理科,江苏盐城 224001)
肺癌位居全球总人口癌症致死率排行之首,占癌症总患者的18.4%[1]。大多数肺癌患者在确诊时已为晚期,治疗难度大,病死率高。随着分子生物学和精准医疗的飞速发展,肿瘤药物治疗已从传统的放化疗发展到分子靶向治疗。近年来,表皮生长因子受体酪氨酸激酶抑制剂治疗晚期非小细胞肺癌患者(NSCLC)已成熟应用于临床,患者获益明显,但是耐药问题限制了药物的治疗效果[2-3]。为延长患者的寿命,亟需研发新的治疗方法或药物,目前以程序性死亡因子1(PD-1)/程序性死亡因子配体1(PD-L1)单抗为代表的封锁免疫检查点治疗是治疗晚期NSCLC最有希望的方法之一[4],成为医学肿瘤界研究的热点。临床研究已证实,对患者进行PD-L1蛋白水平的检测,有利于患者选择药物。2018年第6版美国国立综合癌症网络临床实践指南(NCCN)推荐对肿瘤患者进行更广谱的驱动基因检测,这其中就包括对PD-L1蛋白表达和EGFR基因状态进行检测。目前,国内关于PD-L1与EGFR基因突变相关性研究的文献报道较少。本文旨在研究93例NSCLC组织中PD-L1蛋白的表达、EGFR突变状态及二者的相关性,以便进一步研究肺癌的发生机制,更高效筛选PD-L1蛋白检测对象,协助指导临床,为患者提供最合适的治疗方案。现报道如下。
1 资料与方法
1.1一般资料 收集2017年6月至2019年1月盐城市第一人民医院病理科存档,经病理证实的93例NSCLC患者的蜡块组织。93例患者中男51例,女42例;年龄39~80岁,中位年龄62岁;无吸烟史60例,有吸烟史33例;病变部位:左侧40例,右侧53例;肿瘤大小:≤3 cm 59例,>3 cm 34例;淋巴结转移:无转移者71例,有转移者22例;组织学类型:腺癌82例,鳞癌11例;临床TNM分期:Ⅰ期61例,Ⅱ期18例,Ⅲ期14例。组织学分化类型:低分化25例,中分化29例,高分化39例。临床分期参照2017年国际肺癌研究中心(IASLC)第8版肺癌TNM分期解读。组织学分析参照2006年WHO肺肿瘤组织学分类标准。
1.2试剂与仪器 PD-L1(28-8)购自美国abcam公司;内源性过氧化物酶、乙二胺四乙酸(EDTA)抗原修复液、HRP标记抗鼠/兔二抗、DAB增强显色系统均购自福建迈新公司;FFPE石蜡组织DNA提取试剂盒(56404)购自美国凯杰公司;人类EGFR29基因突变检测试剂盒(ADx-EG01)购自厦门艾德公司。仪器包括德国蔡司Zen显微数字成像系统,国产海尔生物安全柜,美国科威尔(Quawell 6000)超微量分光光度计,德国艾本德(Eppendorf)离心机及移液器,国产宏石全自动荧光定量PCR仪(SLAN96S)。
1.3方法
1.3.1免疫组织化学 (1)石蜡包埋组织4 μm切片,贴于涂胶片上,60 ℃烤片2 h。二甲苯脱蜡、梯度乙醇水化组织切片,EDTA高压锅抗原修复4 min,阻断内源性过氧化物酶10 min,滴加一抗 PD-L1(1∶100,Abcam公司)室温孵育1 h,HRP标记的二抗(迈新公司)室温孵育15 min。DAB显色2~5 min,苏木素复染1 min,流水冲洗,1%盐酸-乙醇快速分化,大量流水冲洗,梯度乙醇水化,二甲苯透明,中性树胶封片,显微镜下观察判读并采图。(2)结果判断:由3位高年资医师采用盲法判读结果,意见不统一时,讨论到结果一致。用正常扁桃体组织作为PD-L1蛋白染色的阳性对照(上皮隐窝着色)和阴性对照(内皮、成纤维细胞无着色)。光镜下观察结果,每片观察5个高倍视野(×200倍),计数100个细胞。无论着色是淡黄色、棕黄色还是黄褐色,计数肿瘤细胞中呈部分或者完整的胞膜着色的阳性百分比<5%为阴性,≥5%为阳性[5]。
1.3.2EGFR基因突变检测 (1)将患者的肺癌组织蜡块,对照HE切片用金刚石刻字笔划出肿瘤区域,连续切5~10张4 μm切片,除去非肿瘤组织,将蜡片放入1.5 mL离心管(EP管)中,盖好管盖,做好标记。在样本制备区生物安全柜内,按凯杰公司(Qiagen)的福尔马林固定石蜡包埋(FFPE)组织DNA抽提试剂盒说明书(56404)提取肿瘤组织DNA。提取完毕,立即用超微分光光度计检测DNA的浓度和纯度,确保达到质控标准(A260/A280∶1.8~2.0)。按试剂盒说明书用双蒸水稀释样本DNA浓度至2 ng/μL,吸取42.3 μL DNA,加入2.7 μL TaqDNA聚合酶,震荡混匀后瞬时离心;将混合好的DNA、酶混合物依次吸取5.0 μL,沿着上管壁加入8联管反应条(反应条中的试剂包括引物、探针、dNTPs、Buffer)中,盖好管盖,离心15 s。(2)将8连管反应条通过传递窗移入PCR扩增区,上机扩增。PCR程序为第1阶段:95 ℃ 5 min,1个循环;第2阶段:95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,15个循环;第3阶段:93 ℃25 s,60 ℃ 35 s(收集FAM和VIC荧光信号),72 ℃ 20 s,31个循环。检测完毕取出反应条,用一次性手套包好扔进垃圾桶,保存实验结果,按说明书判读结果。(3)每个样本的检测条为8个孔。 1~7号孔分别检测Exon18 G719X(G719A、G719S、G719C)、Exon19 Del(19种)、Exon20 T790M、Exon20 S768I、Exon20 Ins、Exon21 L858R、Exon21 L861Q位点,8号孔为DNA质控孔。外控由FAM信号指示,内控由VIC信号指示,每次实验均设阴、阳性对照。
1.4统计学处理 将数据导入SPSS15.0和Stata 7.0软件进行统计学分析。计数资料以[n(%)]表示,采用χ2检验;采用Logistic回归模型分析EGFR基因突变状态的危险因素比值比(OR);采用Spearman等级相关分析PD-L1蛋白表达与 EGFR基因突变状态的相关性。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1PD-L1蛋白与患者临床病理特征的关系 PD-L1蛋白表达以肿瘤细胞完整或部分薄膜出现棕黄色颗粒为阳性,着色深浅不一,见图1。巨噬细胞浸润时也会有阳性表达,可以作为阳性内对照。本研究中93例肺癌组织中有52例观察到PD-L1蛋白表达的阳性信号(55.9%,52/93),而癌旁组织中完全无PD-L1蛋白表达。同时,PD-L1蛋白表达与TNM分期相关,在不同TNM分期的NSCLC表达存在明显差别,其中TNMⅡ(83.3%,15/18)、Ⅲ期(57.1%,8/14)肺癌的阳性率显著高于Ⅰ期(47.5%,29/61),差异有统计学意义(P<0.05)。PD-L1蛋白表达与患者性别、年龄、吸烟史、病变部位、肿瘤大小、淋巴结转移、组织学类型及分化类型差异无统计学意义(P>0.05),见表1。
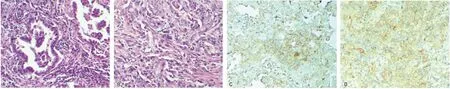
注:A表示肺腺癌石蜡组织HE染色;B表示肺鳞癌石蜡组织HE染色;C表示PD-L1(28-8)蛋白在肺腺癌中的阳性表达(En Vision两步法);D表示PD-L1(28-8)蛋白在肺鳞癌中的阳性表达(×200,En Vision两步法)
图1 PD-L1(28-8)蛋白在NSCLC中的表达

表1 PD-L1蛋白表达、 EGFR基因突变状态与患者临床病理特征的关系
2.2EGFR突变状态与患者临床病理特征的关系 93例NSCLC中EGFR突变型46例,野生型47例,突变率为49.5%,其中包含Exon19 Del突变19例,Exon21 L858R突变26例,Exon20 S768I突变1例,Exon20 T790突变1例,Exon20 Ins突变3例,Exon19 Del、Exon20 T790双突变1例。由于Exon20 T790M和Exon20 Ins为酪氨酸激酶抑制剂(TKI)耐药位点,这5例耐药位点突变占总例数的5.37%,提示患者可能对1代TKI耐药,含有T790 M突变的患者可以使用3代TKI抑制剂奥希替尼(AZD9291)。为便于数据统计分析,将包含这2个位点的突变组和无突变组合并为野生型组。由表2可以看出,EGFR突变状态与患者的性别、吸烟史、肿瘤大小和组织学类型相关,女性患者的突变率(73.8%,31/42)显著高于男性患者(29.4%,15/51),差异有统计学意义(P<0.05);无吸烟史(61.7%,37/60)、肿瘤大小≤3 cm(57.6%,34/59)、腺癌(54.9%,45/82)的患者突变率高于有吸烟史(27.3%,9/33)、肿瘤大小>3 cm(35.3%,12/34)、鳞癌(9.09%,1/11)的患者(P<0.05);而与患者年龄、病变部位、淋巴结转移、分化类型和临床分期无关(P>0.05)。
为进一步分析影响EGFR基因突变状态的独立因素,通过Logistic回归模型对EGFR基因突变状态进行多因素分析发现,在控制性别、吸烟史、肿瘤大小和组织学类型后,患者性别可显著影响EGFR基因突变状态(P<0.05),而吸烟状态、肿瘤大小和组织学类型与EGFR基因突变状态无相关性(P>0.05)。 见表2。

表2 EGFR基因突变预测的多因素分析
2.3PD-L1蛋白表达与EGFR基因突变状态的相关性 Spearman 等级相关分析显示,PD-L1蛋白表达与EGFR基因突变状态无相关性(r=-0.161,P>0.05),见表3。

表3 PD-L1蛋白表达与 EGFR基因突变状态的相关性
3 讨 论
肿瘤的发生、发展与人类免疫系统关系密切。正常情况下,免疫系统会通过T细胞杀伤肿瘤细胞,T细胞过度激活会引起炎症损伤,误伤正常细胞等[6]。T细胞通过免疫检查点抑制剂保护免疫系统,类似“刹车”的作用,而这一特点也会被肿瘤细胞所利用,抑制免疫系统的肿瘤免疫功能。免疫检查点抑制剂是指共同抑制T淋巴细胞信号通路的分子,包含细胞毒性T细胞(CTL)、PD-1及其配体PD-L1等[6-7]。当T细胞表面的PD-1蛋白与肿瘤细胞表面的PD-L1蛋白结合时,PD-1/PD-L1信号通路被激活,戴上面具的PD-L1蛋白的肿瘤细胞和正常细胞混在一起,躲避CTL的识别和攻击,从而在人体内繁衍生息[7-8],这提示PD-1/PD-L1结合可能在抗肿瘤免疫过程中参与了免疫逃逸,发挥负调控作用。科学家们由此获得启发,只要能阻断二者的结合,就能充分激活T细胞,重新识别和杀伤肿瘤细胞,起到抗肿瘤的作用。基于这一特性,研究者研发了2种人源性单克隆抗体PD-1、PD-L1,用来阻止PD-1/PD-L1结合,从而使机体恢复肿瘤免疫功能。目前,封锁免疫检查点PD-1/PD-L1的肿瘤免疫靶向疗法,在NSCLC、恶性黑色素瘤、淋巴瘤、膀胱癌、胃癌、肾细胞癌等多种类型肿瘤患者的治疗中取得卓越的疗效[4]。随着国内首个PD-1抑制剂欧狄沃(纳武利尤单抗注射液)被批准上市,中国正式开启免疫治疗时代。
关于PD-L1蛋白在NSCLC的表达及其与临床病理特征的关系的研究结果截然不同[9-12]。来自中国台湾的YANG等[9]报道PD-L1表达的阳性率为39.9%,在高分化肿瘤中的阳性率较高;来自韩国首尔CHA等[10]报道,323例肺癌中有60例(18.6%)PD-L1表达阳性,以前或现在的吸烟者中较高的PD-L1表达(≥50%)更为普遍,并且与吸烟者年龄增加相关;来自日本福冈的TAKADA等[11]采用免疫组织化学检测497例肺腺癌组织中PD-L1蛋白的表达,临界值为5%时的阳性率为20.4%(85例),临界值为1%时的阳性率为43.5%(144例),PD-L1蛋白倾向于在男性、吸烟者、高级别临床分期、淋巴结转移中高表达。本研究中PD-L1蛋白表达的阳性率为55.9%,这与来自韩国首尔的KOH等[12]研究结果接近;PD-L1蛋白表达与TNM分期相关,TNMⅡ(83.3%)、Ⅲ期(57.1%)肺癌的阳性率显著高于Ⅰ期(47.5%),差异有统计学意义(P<0.05),这与TAKADA等[11]的研究一致;而PD-L1蛋白表达与患者性别、年龄、吸烟史、病变部位、肿瘤大小、淋巴结转移、组织学类型及分化类型差异无统计学意义(P>0.05)。这可能是由于种族、组织学类型、临床分期、样本量大小的差异造成的。此外,目前检测PD-L1蛋白的生产厂家、克隆号、配套的检测仪器、检测条件、判读时的临界值尚无统一标准也会得出不同的结果。
EGFR基因位于人类7号染色体,包含28个外显子,其酪氨酸激酶编码区为18~24号外显子。EGFR定位于细胞膜,通过RAS/RAF/MEK/MAPK、PI3K/AKT/mTOR途径传进细胞核。当该通路的信号传导异常时,EGFR突变引发其自身磷酸化,激活酪氨酸激酶,并进一步激活下游信号通路,促进肿瘤的发生。NSCLC中19号外显子缺失和21号外显子L858R点突变是目前最常见的突变方式[13]。与传统的化疗相比,口服TKI毒性更低,能显著改善患者的生活质量,延长患者生存期,治疗效果更持久[14]。DEARDEN等[15]报道亚洲NSCLC患者EGFR突变率为47.9%。THATCHER等[16]首次报道EGFR基因突变率在女性、无吸烟史、腺癌或东亚患者中更高,此类人群更易从EGFR-TKI治疗中获益。而随后SHI等[17]研究发现,EGFR基因突变的独立影响因素为吸烟史、病理类型。本研究93例NSCLC中EGFR突变率为49.5%,这与DEARDEN等[15]的研究一致。本研究还发现,女性(73.8%)、无吸烟史(61.7%)、肿瘤大小≤3 cm(57.6%)、腺癌(454.9%)的患者突变率高于男性(29.4%)、有吸烟史(27.3%)、肿瘤大小>3 cm(35.3%)、鳞癌(9.09%)的患者(P<0.05);而与患者年龄、病变部位、淋巴结转移、分化类型和临床分期无关(P>0.05)。Logistic回归分析发现,患者性别可独立影响EGFR基因突变状态(P<0.05),这与SHI等[17]研究结果不一致,可能原因是样本人群来源地区的差异、回顾性样本选择的偏倚和不同检测方法的灵敏度不同。
关于PD-L1蛋白表达与EGFR基因突变状态的关系,目前尚不清楚,仍是当前的研究热点。本研究通过Spearman等级相关分析发现,PD-L1蛋白表达与EGFR基因突变状态无相关性(P>0.05),这与YANG等[4]报道一致;而TAKADA等[11]报道PD-L1蛋白倾向于在EGFR野生型中高表达;AZUMA等[18]发现PD-L1的表达在EGFR突变型中要显著高于EGFR野生型。
鉴于目前PD-L1检测标准和判读标准不统一,本研究使用的PD-L1抗体克隆号为28-8,在未来的研究中可以使用其他一些克隆号,如22C3、SP142、SP263等进一步深入研究。此外,除了在蛋白水平运用免疫组织化学检测PD-L1,已有文献报道在多种癌症中通过外周血中循环肿瘤RNA检测PD-L1基因的表达水平[19],随着2代测序技术的不断发展和普及,以后可以通过检测肿瘤突变负荷更高效地筛选免疫治疗患者,在基因水平以更好地指导患者用药。
4 结 论
检测PD-L1蛋白表达、EGFR基因突变状态有助于高效筛选免疫治疗和靶向治疗的检测对象,为临床用药提供理论依据。
