右美托咪定对蛛网膜下腔出血大鼠早期脑损伤的影响及机制
2019-11-27崔雪皎苏林冯磊李凤丽霍小君于宝臣
崔雪皎,苏林,冯磊,李凤丽,霍小君,于宝臣
(1天津市宁河区医院,天津301500;2天津医科大学总医院;3天津市第三中心医院)
蛛网膜下腔出血(SAH)是临床上常见的一种脑血管危重症疾病,病死率和致残率高达50%[1]。早期脑损伤是指SAH后72 h内由多因素造成的脑组织的整体性损伤。目前研究认为,早期脑损伤可通过脑水肿、血脑屏障紊乱、炎症、氧化应激和凋亡等多种途径影响预后[2]。右美托咪定(Dex)是一种高度选择性的肾上腺素2受体激动剂,在镇静和镇痛方面有极好的效果,临床上常用作辅助麻醉。研究表明,Dex在成年动物创伤性脑损伤和脑缺血后具有神经保护作用,参与抗炎、氧化应激、血脑屏障修复及抗凋亡等多种病理生理的调控过程[3]。Wang等[4]报道,Dex可通过激活细胞外信号调节激酶,为SAH后的大鼠提供神经保护作用。2018年3~12月,我们通过制作SAH大鼠模型,观察Dex对SAH大鼠神经功能的影响,并探讨其作用机制。
1 材料与方法
1.1 动物与试剂 雄性SD大鼠50只,体质量250~300 g,购自中国医学科学院放射医学研究所。Dex购自美国Sigma-Aldrich公司,Iba1抗体、CD86抗体、CD206抗体、山羊抗鼠的IgG、Occludin抗体、ZO-1抗体均购自美国Abcam公司,caspase-3(激活型)抗体、Bax抗体、Bcl-2抗体、β-actin抗体、辣根过氧化物酶标记山羊抗大鼠IgG、极超敏ECL化学发光试剂盒、DAPI、荧光防淬灭剂、大鼠IL-4、IL-1、IL-6、TNF-α ELISA试剂盒以及BCA试剂盒购自上海碧云天公司,IL-13 ELISA试剂盒购自上海Bio-Techne公司。
1.2 动物分组、造模及干预 将大鼠随机分为假手术组10只、SAH组20只、SAH+Dex组20只,采用颈内动脉刺破法建立SAH模型[5]。向大鼠腹腔内注射水合氯醛麻醉,仰卧位固定。于颈部正中线偏右侧做长约2 cm的斜切口,暴露并分离颈总动脉、颈外动脉及颈内动脉。用动脉钳夹住颈总动脉和颈内动脉,用尼龙缝线将颈外动脉结扎并在结扎处近端切开。移开颈内动脉上的动脉钳,将脑中动脉闭塞单纤维丝通过颈外动脉推入颈内动脉,当感到一定阻力时,将单纤维丝再向前推进1~2 mm,使血管穿孔。移除单纤维丝,完成结扎,移开颈总动脉的动脉钳,缝合伤口。SAH组和SAH+Dex组建立SAH模型,假手术组仅进行手术操作但不穿孔。术后2 h,SAH+Dex组腹腔注射1 mg/mL Dex溶液500 μL,SAH组腹腔注射等体积生理盐水,假手术组不干预。
1.3 观察指标
1.3.1 神经功能评分 术后24 h,采用Garcia 18分评价法进行神经功能评分。包括自主运动、提住鼠尾悬空时四肢活动对称性状况、提住鼠尾放置桌面边缘观察前爪伸展、攀爬和抓持铁笼能力、身体感觉反应、对触碰胡须的反应6个项目,总分最高18分、最低3分。
1.3.2 脑水分含量 采用干-湿法检测术后24 h脑水分含量。神经功能评分结束后,每组各取4只大鼠,麻醉后取脑组织,移除小脑和脑干,剩余部分称重,记为湿重。将其置于100 ℃炉内干燥24 h,重新称重,记为干重。脑水分含量=(湿重-干重)/湿重×100%。
1.3.3 SAH分级评分 取剩余大鼠麻醉后处死,暴露脑组织基底池。将基底池分为6个部分,按以下方法对各部分进行评分:蛛网膜下腔没有血液为0分,蛛网膜下腔有少量血液为1分,中度凝血并有可识别的动脉为2分,血块覆盖所有动脉为3分。将6部分得分总和作为SAH分级评分。
1.3.4 脑组织小神经胶质细胞及其亚型含量 采用免疫荧光双标法。取大鼠脑组织,加入4%多聚甲醛固定,经脱钙液脱钙后,连续切6 m厚切片,加入胎牛血清封闭30 min。加入一抗(Iba1抗体1∶500,CD86抗体1∶200,CD206抗体1∶200),37 ℃孵育过夜,PBS冲洗。加入荧光二抗(1∶100),37 ℃避光孵育2 h,PBS洗2次。加入DAPI染料,常温染色5 min后,PBS洗3次。滴加荧光防淬灭剂封片,荧光显微镜下观察并采集图像。Iba1用于标记小神经胶质细胞,阳性细胞呈绿色荧光;CD86和CD206分别用于标记小神经胶质细胞M1、M2型,阳性细胞呈红色荧光。采用Image Pro Plus软件计数Iba1/CD86双阳性细胞数、Iba1/CD206双阳性细胞数、Iba1阳性细胞数。M1型含量(%)=Iba1/CD86双阳性细胞数/Iba1阳性细胞数100%,M2型含量(%)=Iba1/CD206双阳性细胞数/Iba1阳性细胞数100%。每只大鼠随机取10个视野(400),求平均值。
1.3.5 脑组织IL-4、IL-13、IL-1、IL-6、TNF-α含量 采用ELISA法。取大鼠脑组织,置于含蛋白酶抑制剂的组织蛋白裂解液中,在冰块上手动匀浆,10 000 g/min离心5 min。取上清液1 mL,采用ELISA试剂盒检测IL-4、IL-13、IL-1、IL-6、TNF-α含量。
1.3.6 血脑屏障相关蛋白Occludin、ZO-1及凋亡相关蛋白caspase-3、Bax、Bcl-2表达 采用Western blotting法。取大鼠脑组织,加入RIPA裂解液提取总蛋白,用BCA试剂盒定量总蛋白。取20 g总蛋白加入上样缓冲液中,用10%的SDS-PAGE凝胶分离总蛋白,转膜后用3%的胎牛血清室温封闭45 min,加入一抗(Occludin 1∶50 000、ZO-1 1∶800、caspase-3 1∶1 000、Bax 1∶1 000、Bcl-2 1∶1 000),4 ℃孵育过夜。加入二抗(1∶10 000),室温摇床孵育45 min,ECL暗室发光。采用美国Bio-Rad公司的凝胶成像系统及Quantity One4.6.2软件统计分析条带。以目的条带与内参GAPDH光密度的比值作为蛋白的相对表达量。
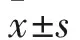
2 结果
2.1 三组神经功能评分、脑水分含量、SAH分级评分比较 假手术组无大鼠死亡,SAH组死亡8只,SAH+Dex组死亡5只。与假手术组比较,SAH组神经功能评分降低,脑水分含量和SAH分级评分增加(P均<0.05)。与SAH组比较,SAH+Dex组神经功能评分增加、脑水分含量降低(P均<0.05),SAH分级评分无明显变化(P>0.05)。见表1。
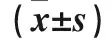
表1 各组神经功能评分、脑水分含量及SAH分级评分比较
注:与假手术组比较,*P<0.05;与SAH组比较,#P<0.05。
2.2 三组脑组织小神经胶质细胞及其亚型含量比较 SAH组小神经胶质细胞形态较圆,SAH+Dex组小神经胶质细胞形态呈长型、纺锤样形态。与假手术组比较,SAH组小神经胶质细胞数及M1型含量均增加(P均<0.05),M2型含量无显著变化(P>0.05)。与SAH组相比,SAH+Dex组小神经胶质细胞数和M1型含量降低,M2型含量增加(P均<0.05)。见表2。
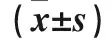
表2 三组脑组织小神经胶质细胞及其亚型含量比较
注:与假手术组比较,*P<0.05;与SAH组比较,#P<0.05。
2.3 三组脑组织炎症因子水平比较 与假手术组比较,SAH组IL-13含量降低,IL-1、IL-6、TNF-α含量升高(P均<0.05),IL-4含量无显著变化(P>0.05);与SAH组比较,SAH+Dex组IL-4、IL-13含量升高,IL-1、IL-6、TNF-α含量降低(P均<0.05)。见表3。
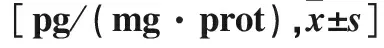
表3 三组脑组织炎症因子含量比较
注:与假手术组比较,*P<0.05;与SAH组比较,#P<0.05。
2.4 三组脑组织血脑屏障相关蛋白表达比较 与假手术组比较,SAH组Occludin、ZO-1蛋白表达降低;与SAH组比较,SAH+Dex组Occludin、ZO-1蛋白表达增加(P均<0.05)。见表4。
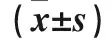
表4 三组Occludin、ZO-1蛋白表达比较
注:与假手术组比较,*P<0.05;与SAH组比较,#P<0.05。
2.5 三组脑组织中细胞凋亡相关蛋白表达比较 与假手术组比较,SAH组caspase-3、Bax蛋白表达及Bax/Bcl-2升高,Bcl-2蛋白表达降低;与SAH组比较,SAH+Dex组caspase-3、Bax蛋白表达及Bax/Bcl-2降低,Bcl-2蛋白表达升高(P均<0.05)。见表5。
3 讨论
研究显示,早期脑损伤可能是SAH后24~72 h内高病死率的重要原因,此外早期脑损伤也参与迟发性缺血损伤和持续性神经损伤的发病[1]。早期脑损伤的病理生理学过程非常复杂,涉及多种分子机制,包括炎症、血脑屏障破坏和神经细胞凋亡等[6]。这些机制促进了早期脑损伤的病情进展,是临床治疗的潜在靶标。Dex作为一种麻醉剂,具有较好的镇痛、镇静、抗焦虑作用。研究显示,Dex用于急性脑损伤患者的手术麻醉,可有效降低脑组织损伤及炎症反应[7]。动物实验表明,Dex可降低大鼠体温并减轻继发性脑损伤,对创伤性脑损伤和脑缺血也具有神经保护作用[8]。但是Dex对SAH后早期脑损伤的影响以及机制尚未完全阐明。
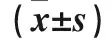
表5 三组脑组织细胞凋亡相关蛋白表达比较
注:与假手术组比较,*P<0.05;与SAH组比较,#P<0.05。
本研究采用神经功能评分、脑水分含量及SAH分级评分评估Dex对SAH大鼠神经功能、脑水肿及SAH严重程度的影响。结果表明,造模24 h内,假手术组无大鼠死亡,SAH组死亡8只,SAH+Dex组死亡5只,表明SAH导致大鼠病死率增加。与假手术组比较,SAH组神经功能评分显著降低,脑水分含量和SAH分级评分显著增加,表明SAH后24 h内大鼠的神经功能受损,发生脑水肿,且蛛网膜下腔出血严重,提示造模成功。与SAH组比较,SAH+Dex组神经功能评分显著增加,脑水分含量显著降低,SAH分级评分无显著变化,表明Dex可降低SAH导致的神经神经损伤,缓解脑水肿,虽然对SAH的程度并没有显著的改善作用,但是已经遏制住了SAH的进展。
炎症反应在SAH后早期脑损伤的发病机制中起着至关重要的作用,包括炎症细胞的活化和促炎因子的释放。SAH后,许多免疫细胞通过受损的血脑屏障进入大脑,尤其是巨噬细胞和中性粒细胞。在数小时内,这些细胞到达损伤区域,持续激活固有细胞,释放大量炎症因子,导致中枢神经系统中毒,造成继发性脑损伤[9]。小神经胶质细胞是大脑中的固有免疫细胞,在SAH及神经退行性疾病等病理条件下,小神经胶质细胞会发生形态、基因表达及功能上的一系列变化,成为激活状态。激活后的小神经胶质细胞有M1和M2两种亚型。M2型小神经胶质细胞可释放抗炎因子(如IL-4、IL-13)、神经营养因子、吞噬损伤的神经细胞、促进组织修复及神经元再生等,发挥神经保护作用。但是当其被过度刺激激活时,则会转为M1型,释放大量炎症因子(如IL-1、IL-6、TNF-α、ROS等),对神经细胞产生毒性作用[10]。本研究结果显示,与假手术组比较,SAH组Iba1阳性细胞数和M1型含量均显著增加,M2型含量无显著变化;SAH组抗炎因子IL-13水平降低,而促炎因子IL-1、IL-6、TNF-α水平升高。提示SAH可激活小神经胶质细胞且维持M1型,进而释放大量促炎因子,对脑组织产生毒性作用。而与SAH组相比,SAH+Dex组Iba1阳性细胞数和M1型含量均显著降低,M2型含量显著增加;抗炎因子IL-4、IL-13水平升高,促炎因子IL-1、IL-6、TNF-α水平降低。提示Dex可诱导SAH状态下的M1型向M2型转化,进而降低M1型释放的促炎因子,增加M2型释放的抗炎因子,缓解炎症。因此推测,Dex对SAH后早期脑损伤的保护作用可能与其诱导小神经胶质细胞M1型向M2型转化、进而降低促炎因子的释放、增加抗炎因子的释放有关。
血脑屏障受损可引起脑水肿、脑肿胀和神经元死亡,是导致SAH后早期脑损伤的重要原因。血脑屏障破坏后,血液中的免疫细胞可通过受损的血脑屏障迁移到受伤区域,这可能会加重脑损伤。紧密连接蛋白包括Occludin、ZO-1和claudin-5,是血脑屏障重要的组成部分,能够连接内皮细胞、周细胞、神经元、星形胶质细胞和细胞外基质[11]。紧密连接蛋白表达异常是血脑屏障损伤的重要标志。本研究结果显示,与假手术组比较,SAH组Occludin及ZO-1蛋白表达显著降低,表明SAH后24 h大鼠血脑屏障受到破坏;与SAH组比较,SAH+Dex组Occludin及ZO-1蛋白表达显著增加,表明Dex可缓解SAH后24 h的血脑屏障损伤,增加血脑屏障的完整性,从而阻止免疫细胞进入脑组织诱发炎症。这可能是Dex缓解SAH后神经损伤及脑水肿的机制之一。
细胞凋亡是细胞程序性死亡的过程,在脑卒中后神经元细胞死亡中起重要作用。caspase-3是半胱氨酸蛋白酶家族的成员之一,是一种细胞凋亡的执行蛋白,其表达量可以反映细胞凋亡程度。Bcl-2是Bcl-2家族的抗凋亡蛋白,Bax是Bcl-2家族的促凋亡蛋白。Bcl-2家族中促凋亡和抗凋亡成员之间的平衡调控细胞凋亡过程,常用Bax/Bcl-2来反映细胞凋亡情况[12]。本研究结果显示,与假手术组比较,SAH组caspase-3、Bax蛋白表达及Bax/Bcl-2显著增加,Bcl-2蛋白表达显著降低,表明SAH后24 h可增加脑组织中的细胞凋亡。与SAH组比较,SAH+Dex组caspase-3、Bax蛋白表达及Bax/Bcl-2显著降低,Bcl-2蛋白表达显著增加,表明Dex可降低caspase-3、Bax表达以及Bax/Bcl-2,增加Bcl-2表达,这为Dex的抗凋亡作用提供了证据。我们推测,Dex可能通过调整小神经胶质细胞的亚型,调控炎症因子(如TNF-α)的释放,进而降低细胞凋亡。炎症反应可加重细胞凋亡,研究认为TNF-α参与促凋亡过程[13]。因此,Dex降低SAH后TNF-α水平可能也是Dex抗凋亡的机制之一。
已有研究证实,交感神经系统(SNS)的激活与炎症反应有关,而抑制SNS可降低炎性因子的释放[14]。Dex作为肾上腺素2受体激动剂,其抗炎作用与抗交感神经系统活性有密切关系。一方面,Dex可与突触后2肾上腺素能受体(2AR)结合,终止疼痛信号的释放,抑制SNS血压和心率升高,产生镇静、抗焦虑和镇痛作用[15]。另一方面,Dex与突触前2AR结合可抑制去甲肾上腺素的释放,进而抑制免疫系统活性,阻止炎症因子释放,产生抗炎作用[16]。由于2AR广泛分布于中枢和周围神经系统以及其他器官组织,因此Dex可调控机体各个部分的炎症反应,对全身具有麻醉、镇静、镇痛作用。这可能也是Dex保护SAH后早期脑损伤的机制之一,但具体途径还有待进一步研究。
综上所述,本研究结果表明Dex对SAH后大鼠具有神经保护作用,其机制可能与修复血脑屏障,调整小神经胶质细胞的亚型,抑制促炎因子释放,降低细胞凋亡有关。
