水通道蛋白9在结肠癌组织中的表达变化及其过表达对结肠癌细胞侵袭和迁移的影响
2019-11-27轩福明范仁根苏凤连查文章邹琳秦呈林
轩福明,范仁根,苏凤连,查文章,邹琳,秦呈林
(徐州医科大学盐城临床学院,江苏盐城224000)
结直肠癌是常见的消化道恶性肿瘤,其发病率高、病死率高,严重威胁人们的生存质量。手术及新辅助化疗作为治疗的主要手段,有效降低了结直肠癌的局部复发率,在一定程度上提高了患者生存期,但很多存在腹腔转移的患者治疗效果不佳,合并腹腔转移者的5年生存率明显低于未转移者[1]。肿瘤的高侵袭转移潜能是肿瘤难以根治的重要原因,研究显示,上皮细胞间充质转化(EMT)在肿瘤的侵袭转移过程中具有重要作用[2]。水通道蛋白(AQP)是一组广泛存在于真核和原核生物细胞膜上的选择性高效转运水分子的特异性孔道,参与细胞内外水分子的转运。文献报道,AQP9参与了癌症的发生发展和转移[3,4],并可在一定程度上影响结肠癌的化疗效果[5]。AQP9在结肠黏膜中表达,但其在结肠癌转移中的研究鲜有报道。2018年1月~2019年1月,我们观察了AQP9在结肠癌组织中的表达,并分析AQP9过表达对结肠癌细胞侵袭和转移的影响,探讨其与EMT的关系。
1 材料与方法
1.1 材料
1.1.1 结肠癌组织标本来源 选择盐城市第一人民医院2018年1月~2019年1月收治的33例结肠癌患者,男16例、女17例,年龄(65.0±10.7)岁。左半结肠癌24例、右半结肠癌9例。患者均接受全系膜结肠癌根治术(术前未行辅助化疗),取手术切除的肿瘤组织及癌旁组织,固定于4%甲醛溶液中,用石蜡包埋。术后病理检查证实肿瘤组织为结肠腺癌、癌旁组织为正常肠组织。本研究经医院伦理委员会审核,患者及家属均签署知情同意书。
1.1.2 细胞与试剂 结肠癌HCT116细胞株购自南京凯基生物公司,羊抗小鼠IgG、抗AQP9兔多克隆抗体购自中国上海Sangon Biotech公司,pcDNA3.1购自武汉转导生物公司,Anti-Vimentin、Anti-E Cadherin、GAPDH购自中国Abcam公司,Transwell小室、基质胶购自美国Corning公司、0.25% Tripsin-EDTA购自南京端粒公司、PVDF膜购自美国Millipore公司,ECL Plus发光试剂盒、SDS-PAGE蛋白上样缓冲液(5×)、Western及IP细胞裂解液、PMSF、BCA蛋白浓度测定试剂盒购自碧云天公司。
1.2 结肠癌组织与癌旁正常组织中AQP9表达检测 采用免疫组化IHC法。取结肠癌组织及癌旁正常组织蜡块,连续切3~5 μm厚切片,每个蜡块切5张备用。置于65 ℃烘箱中1 h。加入二甲苯脱蜡,无水乙醇脱水,柠檬酸盐缓冲液中煮沸10 min进行抗原修复,加入内源性过氧化物酶封闭。加入一抗(抗AQP9兔多克隆抗体,稀释浓度为1∶150),4 ℃孵育过夜;加入二抗(山羊抗小鼠IgG-HPR)25 ℃孵育1 h。PBS冲洗,DAB显色,苏木精复染,梯度乙醇、二甲苯脱水,中性树脂封片。使用Image-Pro Plus软件(Msdia Cyber netics, Rockville,MD,USA)随机选择3个高倍镜(×400)视野,对阳性细胞百分比和染色强度进行评分。AQP9主要表达在结肠上皮细胞的细胞膜,染色后呈棕黄色。阳性细胞百分比评分:<10%计1分,10%~50%计2分,50%~80%计3分,>80%计4分;阳性着色强度评分:无色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。两项评分相乘<3为阴性、≥3为阳性。
1.3 AQP9过表达对结肠癌细胞侵袭和迁移能力的影响观察
1.3.1 细胞培养 HCT116细胞采用含10%的胎牛血清、1×105U/L青霉素、100 mg/L链霉素的DMEM高糖培养基培养,常规培养于37 ℃、5% CO2的细胞培养箱中。取对数生长期细胞用于实验。
1.3.2 细胞分组与转染 将细胞分为空白组、AQP9过表达组和空质粒组。AQP9过表达组:取对数生长期细胞,按5×104/孔接种于24孔板,37 ℃孵育24 h;当细胞融合度在50%左右时,将0.8 μg过表达AQP9的质粒和2 μL Lipo2000分别溶于50 μL Opti-mem无血清培养基中稀释,静置5 min,将两管溶液混合,放置20 min。将24孔培养板中培养基更换成无血清培养基,每孔400 μL,并将配置的混合溶液加入24孔板中对应位置,6 h后更换成有血清培养基继续培养24 h。空质粒组:采用pcDNA3.1代替过表达AQP9的质粒,通过Lipo2000转染至HCT116细胞,步骤与AQP9过表达组相同。空白组正常培养,不进行转染。
1.3.3 细胞侵袭能力观察 采用Transwell小室实验。将Matrigel基质胶加入无血清培养基按1∶4稀释,取50 μL包被Transwell小室底部膜的上室面,37 ℃静置4 h,使Matrigel聚合成凝胶。收集各组细胞,加入0.25%胰酶(含EDTA)消化,离心弃培养液,PBS冲洗,用含0.2% BSA的无血清培养液调整细胞密度为5×105/mL。取细胞悬液200 μL加入Transwell小室;下室加入600 μL含10% FBS培养基,37 ℃、5% CO2培养箱培养48 h。取出Transwell小室,PBS冲洗,甲醇固定30 min,0.1%结晶紫染色20 min。擦去上层未迁移的细胞,PBS冲洗。200倍显微镜下随机选择3个视野,计数穿膜细胞数,结果取平均值。
1.3.4 细胞迁移能力观察 采用细胞划痕实验。收集各组细胞,加入0.25%胰酶(含EDTA)消化,调整细胞密度为1×105/mL,培养过夜。用Marker笔在6孔板背后均匀划横线,每隔0.5~1 cm一道,横穿过孔,每孔穿过3条线。加入细胞约5×105/孔,铺满过夜。用枪头垂直于背后的横线划痕,PBS冲洗,加入无血清培养基,37 ℃、5% CO2培养箱培养24 h。于0、24 h取样、拍照。随机选取3个标记点,测量24 h时细胞迁移的剩余面积,取平均值。
1.3.5 细胞EMT相关蛋白E-cadherin、Vimentin表达检测 采用Western blotting法。收集各组细胞,加入裂解液提取总蛋白,用BCA法测定蛋白浓度。取30 μg蛋白上样,经10%的SDS-PAGE凝胶电泳,电转移至PVDF膜,5%脱脂奶粉封闭,室温孵育2 h。加入一抗(Anti-E-cadherin按1∶1 000稀释、Anti-Vimentin按1∶2 000稀释),4 ℃孵育过夜。洗膜,加入二抗(HPR-山羊兔抗IgG按1∶2 000稀释),室温孵育1 h,洗膜。用ECL发光法显色,Quantity One软件进行灰度值分析。以GAPDH为参照,计算目的蛋白的相对表达量。
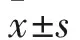
2 结果
2.1 结肠癌及癌旁正常组织中AQP9表达比较 AQP9在结肠癌组织中的阳性表达率为33.33%(11/33),在癌旁正常组织中的阳性表达率为69.70%(23/33),AQP9蛋白在结肠癌组织中的阳性表达率低于癌旁正常组织(χ2=8.735,P<0.05)。
2.2 AQP9过表达对结肠癌细胞侵袭和迁移能力的影响
2.2.1 三组细胞侵袭能力比较 AQP9过表达组、空质粒组、空白组的穿膜细胞数分别为(213±19)、(410±30)、(412±30)个,AQP9过表达组穿膜细胞数少于空质粒组和空白组(P均<0.05)。
2.2.2 三组细胞迁移能力比较 AQP9过表达组、空质粒组、空白组24 h细胞迁移剩余面积分别为(27 940±373)、(13 103±499)、(13 723±1 257)μm2,AQP9过表达组细胞迁移剩余面积少于空白组、空质粒组(P均<0.05)。
2.2.3 三组细胞中EMT相关蛋白表达水平比较 AQP9过表达组E-cadherin表达较空白组、空质粒组升高,Vimentin表达较空白组、空质粒组降低(P均<0.05)。见表1。
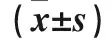
表1 三组细胞中AQP9、E-cadherin、Vimentin表达水平比较
注:与空白组、空质粒组比较,*P<0.05。
3 讨论
结肠癌是常见的恶性肿瘤之一,其发病率和病死率逐年上升。手术是目前治疗结肠癌的主要手段,手术切除技术的进步依赖于更新手术的设备和概念,但手术切除的范围是有限的,据最近一项美国国立癌症研究所SEER数据库分析,对于晚期结直肠癌,随着手术方式的改进对患者的存活率的影响有限,化疗方案的进展是CRC患者生存率提高的主要原因[6]。生物治疗作为治疗结直肠癌等恶性肿瘤的新的治疗模式,运用生物技术和生物制剂影响肿瘤的发生、生长、分化、凋亡、侵袭、转移和复发,促进机体免疫系统重建,从而激发机体对肿瘤细胞的应答,达到控制和消灭体内微小残留病灶甚至使晚期肿瘤得到部分或完全缓解。生物治疗不仅没有任何不良反应,降低了患者术后复发和转移的概率,一定程度上提高了患者对放化疗的敏感性和耐受性。因此,寻找结肠癌的生物标志物一直是临床肿瘤学的热点。
AQP是一种跨膜的膜孔通道蛋白,目前已经在哺乳动物中鉴定出15种水通道蛋白基因,即AQP0~AQP14[7]。AQP9位于15号染色体(15p22),由6个外显子和5个内含子组成。AQP9蛋白对水、甘油、尿素以及一些中性小分子通透,参与细胞内外水分子的转运,被认为与结肠水运动有关[8]。在结肠,AQP9主要分布在肠黏膜的杯状细胞的细胞膜,参与肠道系统的水代谢活动[9,10]。已经证实,AQP1、AQP5、AQP8与结肠癌有关[11,12]。本研究结果显示,结肠癌组织中的AQP9阳性表达率低于癌旁组织,且其过表达后细胞侵袭能力、迁移能力较空白组、空质粒组明显下降,表明AQP9在结肠癌的生长、侵袭以及转移中同样起着非常重要的作用。
肿瘤细胞的侵袭和迁移是造成结肠癌难以根治的重要原因。研究认为,肿瘤细胞自身的运动和侵袭能力的增加是通过在转移的早期阶段经历EMT实现的[13]。EMT是一种上皮细胞转变为间充质细胞状态的细胞过程,在此期间,间质细胞标志物Vimentin上调,而上皮细胞标志物E-cadherin下调[14,15]。肿瘤细胞通过EMT过程,使上皮细胞失去细胞极性,失去与基底膜连接的上皮表型,获得具有较高的迁移与侵袭能力的间质表型[16]。本研究结果显示,AQP9过表达组E-cadherin表达较空白组、空质粒组升高,Vimentin表达较空白组、空质粒组降低,表明AQP9过表达可诱导E-cadherin表达并抑制Vimentin表达,从而抑制上皮来源的肿瘤细胞向间质细胞表型转变。由于EMT导致的这种表型的转变是肿瘤转移的基础,其过程被抑制后,转移能力随之下降,因此AQP9过表达可抑制结肠癌的侵袭和迁移能力,其机制可能是通过抑制EMT来实现的。
综上所述,结肠癌组织中AQP9表达降低;AQP9过表达可抑制结肠癌的侵袭和迁移能力,其机制可能是通过抑制EMT来实现的。检测AQP9的变化可能为早期诊断提供参考,而AQP9相关制剂的研究可能为靶向治疗提供新的选择。
