人AFP启动子操控的跨膜型抗CD3单链抗体构建及其在AFP阳性肝癌细胞中特异性表达
2019-11-27祁麟熊梦裳林芳珍卢杨熊冬生张砚君范冬梅张晴
祁麟,熊梦裳,林芳珍,卢杨,熊冬生,张砚君,范冬梅,张晴
(1中国医学科学院 北京协和医学院 血液病医院 血液学研究所,天津300020;2国家儿童医学中心 首都医科大学附属北京儿童医院 北京市儿科研究所)
目前,手术切除和肝移植仍是肝癌的主要治疗手段,但患者的整体预后不佳,5年生存率不足6%[1]。近年来,肿瘤免疫治疗成为研究热点,肿瘤疫苗、过继性细胞治疗和免疫检查点抑制剂备受瞩目,但其针对实体瘤如肝癌的疗效较为有限[2]。因此,亟待寻找能高效诱导肝癌细胞死亡的免疫治疗新方法。细胞毒性T细胞(CTL)可以通过抗CD3单克隆抗体(antiCD3scfv)有效裂解含Fc受体的靶细胞[3]。Mentzer等[4]将antiCD3scfv插入肿瘤细胞膜表面时,CTL可对小鼠的多种肿瘤细胞产生较好的杀伤效果;基于此原理设计的antiCD3scfv在肿瘤细胞膜上稳定表达,也可调动淋巴细胞的杀伤活性[5]。2018年2~11月,我们设计膜结合型antiCD3scfv,并将其构建至复制缺陷型腺病毒载体Ad-5中,用腺病毒感染修饰人肝癌细胞;为了提高治疗靶向性,我们以肝癌特异性人甲胎蛋白启动子(hAFPp)操控antiCD3scfv基因表达,使其仅在AFP阳性(AFP+)肝癌细胞中表达,为肝癌的靶向治疗研究提供新思路。
1 材料与方法
1.1 材料 AFP+人肝癌细胞HepG2、Huh-7,AFP阴性(AFP-)正常人肝细胞HL-7702、人乳腺癌细胞MCF-7,感受态细胞为人胚胎肾细胞293A、293T,均购自美国模式培养物集存库(ATCC)。PCR引物由Invitrogen公司合成,pMD19-T Simple载体、大肠杆菌DH5α购自Takara公司,pUp-AFP克隆载体购自赛业生物科技有限公司,大肠杆菌BJ5183由本实验室冻存。鼠抗人流感病毒血凝素(HA)表位标签单克隆抗体、APC标记山羊抗鼠IgG H&L多克隆抗体、FITC标记兔抗绿色荧光光蛋白(GFP)单克隆抗体购自Abcam公司,HRP标记山羊抗兔IgG二抗购自Cell Signal Technology公司。
1.2 实验表达载体的构建
1.2.1 表达载体pGL3-hAFPp构建 以pUp-AFP质粒为模板,以hAFPp上游引物5′-ATCGCTCGAGTGATAAAATCCAGATTCAGTC-3′(下划线为XhoⅠ酶切位点)、下游引物5′-ATCGAAGCTTTGTTTGAGGTTGCTAGTG-3′(下划线为HindⅢ酶切位点)扩增hAFPp序列,并在两端引入XhoⅠ和HindⅢ酶切位点以连接pGL3-Basic质粒载体(含荧光素酶报告基因)。将扩增的hAFPp片段克隆至以荧光素酶Luciferase为下游报告基因的质粒pGL3-Basic中,构建pGL3-hAFPp质粒。菌液PCR初步鉴定后,转化至大肠杆菌DH5α中,挑取单克隆测序鉴定。
1.2.2 hAFPp特异转录活性检测 将构建的pGL3-hAFPp载体与对照载体pGL3-Basic、pGL3-control按2 μg/孔接种,用Opti-MEM无血清培养基稀释至1 μg/100 μL,分别转染HepG2、Huh-7、HL-7702、MCF-7细胞;同时每孔加入50 ng表达海肾荧光素酶报告基因Renilla的载体pRL-TK作为内参,以排除不同细胞数目及细胞状态等因素的干扰。转染后48 h按Promega荧光素酶检测试剂盒说明书操作,先后加入100 μL萤火虫荧光素酶底物LARⅡ和100 μL海肾荧光素酶底物Stop & Glo Reagent,通过fLuc荧光素酶活性/Renilla荧光素酶活性计算相对荧光素酶活性。其中pGL3-Basic质粒fLuc上游不含启动子,作为阴性对照,并用于排除细胞背景信号;pGL3-control质粒fLuc上游是CMV启动子,可作为启动子活性阳性对照;以细胞转染pGL3-control数值为100%,对细胞转染其余两种载体数值进行标准化处理,得到相对荧光活性百分比。
1.2.3 pAd-hAFPp-antiCD3scfv穿梭质粒载体构建 以本实验室前期鉴定及构建的pAZY-CD3质粒为模板,用antiCD3scfv基因上游引物5′-ATCGAGATCTCAGGTGCAGCTGCAGCAGTC-3′(下划线为BglⅡ酶切位点)、下游引物5′-ATCGGTCGACCCGTTTCAGCTCCAGCTTG-3′(下划线为SalⅠ酶切位点)扩增“信号肽(SP)-antiCD3scfv-跨膜肽(TM)”序列,构建鉴定正确的pDisPlay-SP.antiCD3scfv.TM中间载体。经酶切位点EcoRⅤ和NotⅠ酶切pDisPlay-SP.antiCD3scfv.TM中间载体;经酶切位点XhoⅠ和EcoRⅤ酶切pUp-AFP质粒,构建pAd-hAFPp-antiCD3scfv穿梭质粒载体,产物转化DH5α感受态细胞,挑取单克隆进行菌落PCR鉴定。
1.3 腺病毒的重组、包装及滴度测定
1.3.1 腺病毒重组 腺病毒骨架质粒pAdEasy-1、大肠杆菌BJ5183由本实验室保存,制备含pAdEasy-1的大肠杆菌BJ5183感受态细胞。将鉴定正确的pAd-hAFPp-antiCD3scfv质粒用限制性内切酶PmeⅠ进行线性化,并转化至上述感受态细胞;挑取阳性克隆,经测序鉴定重组成功。
1.3.2 腺病毒包装 常规培养293A细胞,至融汇度达到80%时消化;调整细胞悬液密度为1×105/mL,接种于24孔培养板继续常规培养。将罗氏X-tremeGENE DNA转染试剂、无菌pAd-hAFPp-antiCD3scfv线性化质粒、Opti-MEM按说明书制备成DNA-转染试剂复合物,分别加入293A培养孔,轻柔混匀后常规培养10~14 d,至293A细胞全部变圆漂起产生细胞病变效应(CPE)。反复冻融并震荡细胞,使胞内病毒彻底释放;收集第1、2、3代病毒悬液并命名为AdCD3scfv,平行设置腺病毒pAdTrack作为空白对照,用于后续实验。
1.3.3 腺病毒滴度测定 病毒储存液用含2% FBS的无抗生素高糖DMEM培养基稀释为107~1016,使用接种293A细胞的96孔板分别加入以上10个稀释梯度的病毒储存液,常规培养10 d后置于荧光显微镜下观察。按照TCID50方法测定重组腺病毒滴度,AdCD3scfv滴度为1.58×1011PFU/mL、AdTrack滴度为1.26×1012PFU/mL,两者均取2×107PFU/mL 用于后续实验。
1.4 antiCD3scfv对肝癌细胞的特异修饰及活性检测
1.4.1 antiCD3scfv蛋白表达情况检测 采用Western blotting法。取对数生长期HepG2、Huh-7、HL-7702、MCF-7细胞,按2×105/孔接种6孔板,每种细胞接种2孔。分别加入终浓度为2×107PFU/mL的AdCD3scfv(100 MOI)和2×107PFU/mL的空载对照腺病毒AdTrack(100 MOI)。收集各感染细胞蛋白,Western blotting法检测antiCD3scfv蛋白。
1.4.2 antiCD3scfv蛋白表达定位检测 采用免疫荧光法。以AdCD3scfv和AdTrack感染上述4种细胞48 h后,收集细胞并调整细胞密度为1×105/mL,经多聚甲醛固定后封闭;加一抗(鼠源抗HA标签抗体)、二抗(APC标记山羊抗鼠IgG H&L多克隆抗体)孵育,以免疫荧光法对目的蛋白进行定位。
1.4.3 腺病毒感染及跨膜antiCD3scfv的表达效率测算 采用流式细胞仪。于100 MOI条件下,再次以AdCD3scfv和AdTrack感染上述4种细胞,一抗、二抗孵育同1.4.2,用流式检测各种细胞GFP阳性率及HA标记anti-CD3scfv蛋白表达水平,评价腺病毒感染及跨膜antiCD3scfv的表达效率。
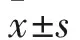
2 结果
2.1 实验表达载体的构建结果
2.1.1 表达载体pGL3-hAFPp的构建结果 通过PCR从pUP-AFP克隆载体中克隆人—鼠嵌合型AFP启动子,符合预期相对分子质量2 810 bp(封三图1A);在构建成的质粒pGL3-hAFPp中,选取菌液PCR阳性克隆小提质粒(封三图1B),双酶切再次鉴定正确的克隆,经测序鉴定后序列正确(封三图1C)。
2.1.2 hAFPp特异转录活性分析结果 hAFPp在AFP+的HepG2、Huh-7细胞中转录活性分别为160.86%±26.24%、80.08%±12.64%,而在AFP-细胞中转录活性均<7%(P均<0.05)。pGL3-Basic在这4种细胞中转录活性介于0.1%~1%(P均<0.05),表明各个样本间实验背景基本一致。见表1。
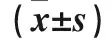
表1 pGL3-hAFPp、pGL3-Basic转染不同类型细胞转录活性比较
注:与AFP-细胞转染同类型载体比较,*P<0.05。
2.1.3 pAd-hAFPp-antiCD3scfv穿梭质粒载体构建结果 克隆得到SP.antiCD3scfv.TM序列,符合预期性对分子质量1 023 bp(封三图2A);EcoRⅤ和NotⅠ双酶切pAdTrack-hAFPp质粒(封三图2B),成功构建pAdTrack-hAFPp质粒;阳性克隆(封三图2C)经测序公司测序为正确的pAd-hAFPp-antiCD3scfv穿梭质粒载体,经双酶切再次鉴定正确(封三图2D)。
2.2 antiCD3scfv对肝癌细胞的特异修饰及活性检测结果
2.2.1 antiCD3scfv蛋白表达情况 在AdCD3scfv感染的细胞中,仅HepG2、Huh-7细胞中检测到antiCD3scfv蛋白表达(36.7 kD),而HL-7702、MCF-7均无条带出现。AdTrack做为空载对照,在上述4种细胞中均无目的蛋白表达。见封三图3。
2.2.2 antiCD3scfv蛋白表达定位情况 AdTrack感染后,4种细胞均未见目的蛋白表达,AdCD3scfv感染后,仅在HepG2、Huh-7细胞见antiCD3scfv蛋白表达于细胞膜表面(红色荧光),而HL-7702、MCF-7细胞未见antiCD3scfv蛋白表达。见封三图4。
2.2.3 各类细胞腺病毒感染及跨膜antiCD3scfv表达效率 AdCD3scfv及AdTrack对4种细胞病毒感染效率(GFP+细胞比率)均>95%,证明100 MOI为合适的病毒感染复数;但仅在AdCD3scfv感染的HepG2、Huh-7细胞中GFP+antiCD3scfv+细胞群比例>90%,高于AdCD3scfv感染的HL-7702、MCF-7及AdTrack感染的4种细胞(P均<0.05)。见表2。
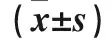
表2 各类细胞腺病毒感染后跨膜GFP+ antiCD3scfv+细胞比率比较
注:与感染AdTrack同类型细胞比较,*P<0.05;与AFP-细胞转染同类型载体比较,#P<0.05。
3 讨论
肿瘤抗原是癌症免疫治疗的核心,至今已经鉴定的可被T细胞靶向的几种肝癌特异性肿瘤相关抗原(TAA)有癌胚抗原(AFP、GPC3)、过表达抗原(TERT)、肿瘤睾丸抗原(MAGE-A、SSX-2、NY-ESO-1)等[6]。肝癌作为一种极其特异质性的肿瘤,在其内部并非所有肿瘤细胞都表达相同的抗原[7],而免疫系统对缺乏抗原或者抗原表达不强的肿瘤细胞具有选择性压力,这些肿瘤细胞将逃避免疫系统监视,并最终导致肿瘤重塑,或称为“免疫编辑”。通过此类机制形成的新生肿瘤内部极度缺乏抗原,这使肝癌的免疫治疗面临着更严峻的挑战。
研究发现,70%以上的肝癌细胞会大量表达一种大分子糖蛋白AFP。AFP本身在胎儿肝细胞中大量表达,出生后合成停止;但当肝细胞癌变时,其抗原基因被激活,可重新产生大量的AFP[8]。因此,AFP启动子已成为靶向肝癌的基因治疗研究中常用的转录特异性启动子元件,特别是在很多以腺病毒为载体的基因治疗研究中,该启动子都被用来驱动下游治疗基因的表达[9];此外,利用抗体直接作用于T细胞表面的CD3分子向下游传递活化信号,可调动淋巴细胞的杀伤活性[10]。以antiCD3scfv改造修饰肿瘤细胞,实现T细胞对肿瘤细胞的杀伤作用,可以绕过抗原表达或者MHC抗原提呈的局限。因此,本研究选用了hAFPp操控antiCD3scfv的表达,达到控制腺病毒只在感染肝癌细胞后才能启动antiCD3scfv特异性表达的目的,而不影响可能被感染的正常细胞,进一步增强这个基因治疗体系的特异性。
根据以上思路,本研究将跨膜型antiCD3scfv基因构建至Ad-5腺病毒载体中,以腺病毒感染修饰人肝癌细胞。为了提高治疗靶向性,减少对正常细胞的潜在损伤,本研究又设计以肝癌特异性hAFPp操控antiCD3scfv基因,使其只有在AFP+肝癌细胞中才能表达。通过免疫荧光与流式分析发现,antiCD3scfv蛋白成功表达在细胞膜表面,并且仅表达于AFP+的肝癌细胞HepG2及Huh7中,也再次证明hAFPp的特异转录活性和肝癌特异性。
肿瘤细胞膜表面antiCD3scfv的表达密度决定淋巴细胞的活化程度。提高肿瘤内部新生腺病毒的生物利用度,增加antiCD3scfv的表达,即可促进淋巴细胞的活化,又可强化免疫反应。Bhattacharyya等[11]研究发现,5-FU可以改变宿主细胞表面腺病毒内化所需关键受体的表达水平,主要表现为CAR、αvβ3和αvβ5整合素表达的升高,从而增强宿主细胞对腺病毒的摄取能力。因此,在本研究的基础上联合5-FU,理论上可以促进新生腺病毒对肝癌细胞的感染效率并评价免疫治疗效果的改善,这也是本研究下一步准备着手开展的工作。
