模式原生动物浮萍棘尾虫纯培养体系的建立与优化
2019-11-26吴禹岐李世宽范金凤
王 影 姚 琳 吴禹岐 李世宽 范金凤 陈 瑛
(哈尔滨师范大学黑龙江省水生生物多样性研究重点实验室, 哈尔滨 150025)
浮萍棘尾虫(Stylonychia lemnae)是一种营自由生的淡水纤毛虫, 广泛分布于池塘、河流和沼泽中。隶属于原生动物界纤毛门多膜纲下毛目尖毛科[1], 是棘尾虫属的模式种。作为单细胞模式生物, 棘尾虫在研究核组织和发育、染色体和染色质、端粒生物学以及基因组重排等领域有着重要的地位[2—4]。早在1876年, 第一份记录染色体和有丝分裂纺锤体的报道就来自于对棘尾虫小核结构的观察[5]。另外一份研究发现, 在浮萍棘尾虫大核多倍体化后, 基因组中有大量DNA(约90%)存在丢失现象, 这一发现引起了学者们对于纤毛虫中基因组减少和重排现象的广泛研究。随后, 浮萍棘尾虫即作为模式单细胞生物, 广泛用于端粒结构调控[6]和染色质动力学的研究中[7—9]。在2013年,浮萍棘尾虫大核基因组完成测序, 为研究染色质介导、RNA引导的发育基因组重排等现象提供了分子生物学基础[10]。基于基因组测序结果, 本实验室研究了浮萍棘尾虫在表皮生长因子诱导下的转录组响应, 从转录水平初步揭示了其分裂和增殖调控的分子机制[11]。棘尾虫主要营动物性营养[12],传统的棘尾虫培养方式是喂饲藻类(Algae)、细菌(Bacteria)及唇鞭虫(Chilomonas)等。在利用该物种作为研究对象开展相关实验前, 通常需进行饥饿处理, 以减少细菌和微藻对研究结果的干扰, 但是依然难以完全消化虫体内的食物[13], 非常不利于开展棘尾虫的基础生物学研究。因此, 建立浮萍棘尾虫纯培养体系, 成为开展棘尾虫生物学研究的重要前提。
原生动物的培养方式主要分为自由生和寄生型两类: 自由生活的模式原生动物以草履虫(Paramecium)和四膜虫(Tetrahymena)为代表, 其专用的无菌培养基已经建立[14—16], 其他种属的培养方式均为混合培养[17—19]。因此, 本研究以原生动物嗜热四膜虫纯培养基为主要参考[20], 采用响应面分析方法,通过单因素实验和正交实验筛选调整各个主要组成分配比, 以获得适合浮萍棘尾虫细胞的无菌纯培养基, 并进一步优化了培养条件。
1 材料与方法
1.1 供试材料
实验所用的浮萍棘尾虫(Stylonychia lemnae)由中国科学院水生生物研究所馈赠。其基因组数据库网址: http://stylo.ciliate.org/index.php/home/welcom。
1.2 培养基及实验方法
嗜热四膜虫培养基的成分主要包括碳源、氮源、无机盐、葡萄糖和柠檬酸等成分达39种, 用于探究不同成分对虫体生长繁殖的影响, 具体成分参考唐任寰等[21]; 培养唇鞭虫的Pringsheim’s液成分为Na3PO4、KCl、Ca(NO3)2、MgSO4和FeSO4; 绿梭藻(Chlorohonium)培养基成分为NaCl、KCl、CaCl2、MgCl2、NaH2PO4、NH4NO3、MgSO4、FeCl3和MnCl2等无机成分, 具体成分参考Ammermann等[22], Pringsheim’s液、绿梭藻培养基只用来比较和检验优化培养基的优化效果。
优化培养基的方法主要分为两步: 第一步, 利用单因素实验设计, 探索主要营养元素的浓度, 为优化培养基成分提供合理的数据范围。第二步, 为克服单因素实验的局限性, 通过正交实验和统计学数据分析后, 确定主要影响因素。将最佳培养基成分和最适培养条件相组合, 筛选出适合于浮萍棘尾虫的培养体系。
1.3 浮萍棘尾虫培养方法
取100只虫体放入10 mL的培养液中, 在设定的pH和温度条件下静置培养, 每24h测定一次细胞密度, 每次计数进行3个技术重复。
1.4 氮源浓度对浮萍棘尾虫生长的影响
在嗜热四膜虫培养基其他组分不变的条件下:分别添加甲硫氨酸、苏氨酸、缬氨酸、异亮氨酸、组氨酸、丙氨酸、谷氨酸、谷氨酰胺、甘氨酸、丝氨酸(以5%的单位为一个浓度梯度, 共稀释7个浓度), 研究10因素不同浓度组合条件下氮源浓度对细胞密度的影响。每个处理做3个重复。培养方法同1.3。
1.5 碳源浓度对浮萍棘尾虫生长的影响
在嗜热四膜虫培养基其他组分不变的条件下:分别添加葡萄糖和柠檬酸(以10 mg/L为一个浓度梯度, 共稀释6个浓度), 研究在不同浓度条件下碳源浓度对细胞密度的影响。每个处理做3个重复。培养方法同1.3。
1.6 磷酸氢二钾浓度对浮萍棘尾虫生长的影响
在嗜热四膜虫培养基其他组分不变的条件下:分别添加磷酸氢二钾(以0.1%的单位为一个浓度梯度, 共稀释5个浓度), 研究磷酸氢二钾浓度对细胞密度的影响。每个处理做3个重复。培养方法同1.3。
1.7 优化试验
响应面优化实验响应面优化实验是由Box等[23]提出的一种试验设计方法, 是一种综合试验设计和数学建模的优化方法, 通过对具有代表性的局部各点进行试验, 回归拟合在全局范围内因素与结果之间的函数关系, 并且取得各因素的最优水平值[24]。氮源采用central composite design设计了10因素的组合实验, 研究不同组合条件对于棘尾虫细胞数目的影响, 筛选出最适的氮源元素含量的配比。
正交实验在单因素实验结果的基础上, 以氮源、碳源的母液(葡萄糖和柠檬酸按照1:1配制)和磷酸氢二钾作为考察因素, 按正交实验设计,统计实验结果, 比较各组合培养条件对细胞密度的影响, 筛选出最适于棘尾虫生长的培养基组分。每个处理做3个重复。培养方法同1.3。
1.8 最佳培养条件的筛选
在优化后的培养基下培养, 研究培养温度(10、15、20、25和30℃)、培养基初始pH (6.0、6.5、7.0、7.5和8.0)和初始接种密度(5、50、100、200和300 cells/mL)对最终获得细胞密度的影响。每个处理做3个重复。培养方法同1.3。
1.9 细胞密度与代时计算方法
生长曲线与代时和细胞密度的换算公式如下:

其中, A为初始体系中微生物数量常用对数值;B为最大生长速率; C为微生物稳定期数量常用对数值与初始数量常用对数值之差; M为最大生长速率时所对应的时刻;Y(Nt)为微生物在时间t时的常用对数值lg。根据上述公式用Origin8.0即可直接得出参数A、C、B和M, 进而算出: MCC=eA+C;GT=(2.7182/B)/(log2MCC/N0); 其中, e为自然对数,N0为接种初始密度, MCC为细胞最大密度, GT为对数期的代时[25]。通过生长曲线可算出最大细胞密度(Maximum cell concentration, MCC)和代时(Generation times, GT)。
1.10 数据统计
实验数据利用SPSS(20.0)进行统计学分析。
2 结果
2.1 氮源浓度对细胞密度的影响
单因素实验发现, 嗜热四膜虫培养基中18种氨基酸里有10种氨基酸的浓度变化对细胞密度具有显著影响。利用central composite design设计了10因素的组合实验, 共300组不同浓度氨基酸的组合实验。经过方差分析和各因素的贡献度分析得出: 呈现正效应的异亮氨酸贡献度最大为48.182%、丙氨酸的贡献度是22.4506%, 呈现负效应的组氨酸的贡献度是14.6905%, 说明在一定的范围内, 增加异亮氨酸、丙氨酸的浓度含量并减少组氨酸的浓度含量有助于棘尾虫细胞密度的增加。氮源中心组合的细胞密度的回归方程为:

N4为异亮氨酸, N5为组氨酸, N6为丙氨酸。回归方程用决定系数R2检测, 其值为0.9037, 说明实际值与预测值拟合良好。变异系数(CV)=5.18%, 值稍大, 但在合理范围内, 说明模型可信度高。通过响应面的贡献度分析发现N4-6的贡献程度最大, 需要进一步调整比例, 在实际统计数据结果时发现当组氨酸的添加量为零时, 细胞生长密度最高, 所以最终表 1中只包含9种氨基酸, 配成氮源母液。氮源的配比见表 1。

氨基酸Amino acid 浓度Concentration (mol/L)L-Ala 2.5280×10-4 L-Glu 1.8835×10-4 L- Gln 5.4795×10-5 Gly 3.6667×10-4 L-Lle 2.6718×10-4 L-Val 1.4957×10-4 L- Met 1.5101×10-4 DL-Ser 2.1429×10-4 L-Thr 2.3109×10-4
2.2 碳源浓度对细胞密度的影响
培养基中的碳源是由葡萄糖和柠檬酸提供, 因此对碳源进行单因素实验, 结果如图 1所示, 当葡萄糖浓度为30 mg/L、柠檬酸浓度为40 mg/L, 作为碳源的最佳浓度时, 细胞密度均存在最大值约为400 cells/mL。

图1 葡萄糖和柠檬酸的浓度对细胞密度的影响Fig. 1 The effect of glucose and citric acid on cell density
2.3 磷酸氢二钾浓度对细胞密度的影响
如图 2所示, 细胞密度随着K2HPO4·3H2O浓度的增加而增加。当K2HPO4·3H2O的浓度达到0.5%时, 细胞密度达到最大300 cells/mL左右, 而K2HPO4·3H2O浓度继续提高细胞密度则随之递减。在一般情况下, K2HPO4·3H2O除了为细胞的生长提供磷源外, 还具有稳定培养液pH的作用, 偏高或偏低的pH都不利于细胞生长。本实验验证了K2HPO4·3H2O的最适添加量为0.5%。

图2 磷酸氢二钾的浓度对于细胞密度的影响Fig. 2 The Effect of K2HPO4 on cell density
2.4 氮源、碳源和磷酸氢二钾三因素的正交实验及结果分析
为克服单因素实验结果的局限性, 探究几大营养元素之间相互作用的关系, 分别以氮源母液、碳源母液及磷酸氢二钾作为三大类营养元素, 采用正交实验设计方法, 设计了3因素3水平的优化实验,正交实验设计见表 2, 结果分析见表 3。
三因素中心组合的细胞密度的回归方程为:

X1:氮源,X2:碳源,X3:磷酸氢二钾, 回归方程用决定系数R2检测, 其值为0.8221, 说明实际值与预测值拟合良好; 变异系数(CV)=11.21%, 值稍大, 但在合理范围内, 说明模型可信度高, 因素和水平的显著性可有效地检测棘尾虫的生长情况, 反映因素之间相互影响的关系。实验数据经过方差分析, 从表中可以观察到氮源、碳源和磷酸氢二钾对于棘尾虫细胞生长的影响都显著, 氮源的影响最大, 其次是磷酸氢二钾。最佳的配比为氮源的浓度80 mg/mL, K2HPO4·3H2O的浓度达到0.65% mg/mL, 碳源的终浓度为20 mg/mL时, 细胞密度最大可达868 cells/mL左右。
2.5 优化纯培养基与常用培养基对浮萍棘尾虫培养效果的比较
在相同的培养条件下, 初始接种量均为10 cells/mL, 分别添加等量的绿梭藻培养液、Pringsheim’s唇鞭虫培养液和纯培养基, 每组设置3个重复, 对其进行长达144h的计数观察, 统计数据通过差异显著性分析, 得到3种培养基对于浮萍棘尾虫的影响, 得到在72h、96h和120h时均差异性显著,P<0.05, 说明优化后的培养基, 相对于其他两种培养条件, 具有显著影响。
在相同培养条件下, 浮萍棘尾虫在Pringsheim’s液、绿梭藻培养液和优化培养基(Medium)中的生长曲线见图 3。可以看出在3种培养基中, 细胞密度都在120h左右达到最大, 120h后随之减少。在优化培养基中最大细胞密度(Maximum cell concentration)MCC约为6.0×102cells/mL、代时(Generation times)GT为10h, 而在常用的Pringsheim’s液和绿梭藻使用的混合培养基中MCC为4.8×102和4.0×102cells/mL、GT为13h。在优化后培养基相对于传统的培养方式, 在保证细胞数量有所增加的情况下, 成功的缩短了细胞分裂代时。同时, 活体和蛋白银染色观察培养虫体效果(图 4), 发现无菌纯培养基中生长的棘尾虫体内不再有大量藻和细菌, 细胞质呈现均匀洁净的状态。

表2 三因素的正交实验设计Tab. 2 Three-factor orthogonal experimental design

表3 三因素的方差分析Tab. 3 ANOVA for content of three components
2.6 浮萍棘尾虫培养条件的优化
分别以培养温度、初始pH、接种量做单因素实验, 根据培养结果, 分析可知: (1)温度对于棘尾虫生长的影响是显著的, 随着温度的升高, 细胞密度逐渐增大, 到25℃时, 细胞密度可达到850 cells/mL左右; 但温度进一步升高, 虫体密度急剧减少(图 5);(2)不同的初始pH对棘尾虫的生长具有一定的影响,随着初始pH的增加, 细胞密度也逐渐增加, 当初始pH为7.0时, 细胞密度达到1100 cells/mL左右, 当初始pH继续增加时, 细胞密度反而下降, 利用单因素实验得出, 棘尾虫生长的最佳初始pH为7.0 (图 6);(3)不同的接种量对棘尾虫数量的影响是显著的, 利用单因素实验得出, 当接种量为100 cells/mL时, 细胞密度可达到3500 cells/mL, 在实验过程中发现过高或过低的接种量均无法满足分子实验的需求, 确定最佳接种量为100 cells/mL (图 7)。本实验中采用的是容量为50 mL的无菌培养瓶, 加入10 mL培养液后水平放置, 既能够保证培养瓶内有充足的氧气, 又能给棘尾虫类喜贴壁生活的原生动物提供足够的表面积, 因此选择的装液量为10 mL。当温度为25℃, 初始pH为7.0, 接种量为100 cells/mL时, 此为各因素的最佳培养条件。

图3 浮萍棘尾虫在三种培养条件下的生长曲线Fig. 3 The growth curve of Stylonychia lemnae under three culture conditions

图4 浮萍棘尾虫在不同培养条件下的活体和染色图片Fig. 4 Living and staining images of Stylonychia lemnae under different culture conditions
2.7 培养基配制方法及浮萍棘尾虫的驯化
本实验将无菌培养浮萍棘尾虫的纯培养基命名为SLPP, 具体成分配比如下(表 4), 具体配置方法和步骤: (1)按配方称取相应药品, 溶于100 mL灭菌ddH2O, 搅拌溶解均匀后, 调节pH等于7.0, 配制为母液; (2)将母液高压蒸汽灭菌锅, 115℃, 灭菌15min, 冷却后4℃冰箱储存待用; (3)培养前, 在超净工作台中, 用灭菌ddH2O将母液稀释20倍后, 用于培养虫体。
为了避免藻类的干扰, 浮萍棘尾虫可先选用普通麦粒水培养一段时间, 待达到对数生长期后, 再将浮萍棘尾虫转接到灭菌的SLPP培养基中, 在25℃条件下, 无菌培养至对数期生长期, 再连续转接3次, 可获得能够稳定的在SLPP培养基中生长繁殖的无菌虫体, 用于后续的扩大培养和分子实验。

图5 浮萍棘尾虫在不同温度下的细胞密度Fig. 5 The cell density of Stylonychia lemnae under different temperatures
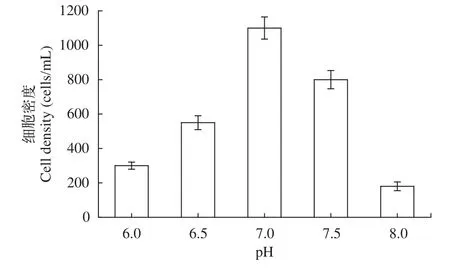
图6 浮萍棘尾虫在不同初始pH下的细胞密度Fig. 6 The cell density of Stylonychia lemnae under different initial pH
3 讨论
原生动物大都生活在有机质丰富、水质腐败且不大流动的污水中。不同的水质, 生活着不同种类的原生动物。通常我们在野外采集回的样品, 均需经过原位水的培养, 逐渐替换为蒸馏水进行驯化,培养过程中通过添加麦粒、米粒等物质产生的菌类, 供给营养[26]。研究发现原生动物和水细菌关系密切, Sanders等[27]指出无论在淡水或海洋生态系统中, 细菌和鞭毛虫的数量有着较为稳定的比例(约1000:1)。原生动物对细菌的掠食速度是惊人的,每时每刻都在进食, 所以食用的菌类、藻类等物质长期残留在虫体内。在显微镜下分别拍摄在菌类、藻类喂饲下的棘尾虫活体和蛋白银染色图片时, 可明显的观察到存在于虫体内部未消化完全的食物(图 4)。因此, 为了减少细菌和藻类对分子测序分析的干扰, 往往在提取浮萍棘尾虫遗传物质前,先进行饥饿处理, 但是细菌和微藻在虫体内依然难以被完全消化[28], 对分子测序结果产生干扰。而使用已有的自由生纤毛虫无菌纯培养基时, 发现棘尾虫不能获得稳定的生长效果。经过本实验的研究和检验, 初步建立了适合浮萍棘尾虫无菌纯培养的培养基和培养条件。利用该纯培养体系, 最大细胞密度可比传统培养方式提高1.2%左右, 有效避免其他物种干扰, 同时, 该培养基成分与嗜热四膜虫纯培养基相比更加简洁廉价。

图7 浮萍棘尾虫在不同接种量下的细胞密度Fig. 7 The cell density of Stylonychia lemnae under different inoculation quantity

表4 SLPP培养基组分Tab. 4 SLPP medium component
经过优化的培养基从原来的“少量原种, 纯营养液, 长周期培养”的方式转变为“大量原种, 配合型营养液, 短周期培养”的方式[29], 在培养基中所添加的碳源、氮源和无机盐均是原生动物培养中常用的营养成分。经过筛选营养成分和优化培养条件, 建立起了适用于腹毛类棘尾虫属的培养基, 既可以获得纯净的生物样品, 又可以缩短实验材料培养的周期, 有利于后续实验的开展。
