大黄鱼TRIM25基因克隆和表达分析
2019-11-26周真真张建设
周真真 景 斐 魏 可 张建设
(浙江海洋大学海洋科学与技术学院, 国家海洋设施养殖工程技术研究中心, 舟山 316022)
先天免疫反应是脊椎动物抵御微生物入侵的第一道防线[1]。当脊椎动物被病原体感染时, 病原体高度保守的核糖核酸及蛋白分子成分即病原体相关分子模式(Pathogen-association molecular patterns, PAMPs)能够快速被细胞模式识别受体(Pattern recognition receptors, PRRs)识别[2]。目前已有3种细胞模式识别受体被分析鉴定, 分别是Toll样受体(TLRs)、NOD样受体(NLRs)和RIG-I样受体(RLRs)[3—7]。PRRs识别病原体PAMPs, 启动下游一系列信号传导通路, 诱导炎性细胞因子和Ⅰ型干扰素的产生。其中, RLRs是包浆中识别病毒dsRNA的主要受体家族, RLRs (如RIG-I)的表达受到多种分子的调节, 包括病毒dsRNA和病毒dsRNA模拟体poly(I:C)等[2]。而且RIG-I的CARDs结构域被E3泛素连接酶TRIM25 (Tripartite motif-containing 25)泛素化而激活, 这对于RIG-I信号通路的信号转导至关重要[8]。
蛋白泛素化是在El泛素激活酶, E2泛素结合酶以及E3泛素连接酶作用下对靶蛋白泛素化修饰从而调控细胞内信号通路并激活细胞内先天免疫应答, 而E3泛素连接酶由于其特异性识别靶蛋白, 因此在蛋白泛素化修饰过程中发挥着至关重要的作用[9,10]。E3泛素连接酶在脊椎动物中普遍存在, 并且包括HECT结构域家族、U-box结构域家族和RING结构域家族[11,12]。TRIM蛋白属于E3泛素连接酶的RING结构域家族, 参与多种生物学过程, 包括细胞分化、细胞周期调控、细胞凋亡和先天免疫反应[13,14]。TRIM家族蛋白在结构上从N端到C端包含保守的RING结构域、1—2个B-box结构域、Coiled-coil结构域, 另外在C末端还有可变的蛋白结构域[15—18]。其中, RING结构域参与锌原子的结合并促进对靶蛋白的泛素化, 提高蛋白的稳定性[19];B-box结构域为TRIM蛋白的特征结构域且能提高TRIM蛋白E3泛素连接酶活性[20,21]; Coiled-coil结构域可以促进TRIM蛋白间同源或异源的寡聚反应[22];C末端的PRY/SPRY结构域通过与RIG-I相互作用导致下游抗病毒信号明显增加, 从而诱导干扰素的产生[23]。TRIM家族在哺乳动物中被广泛研究,TRIM家族基因参与哺乳动物机体多种生命活动[13,24],例如, 与HIV-I病毒相关的TRIM5[25], 神经元特异性蛋白TRIM22[26]以及与先天免疫相关的TRIM25[8]、TRIM15[27]和TRIM21[28]等。
近几年TRIM家族成员在鱼类中被研究, 在斑马鱼(Danio rerio)基因组中发现240种TRIM家族基因成员或类似TRIM基因[29], 其中包含鱼类特有的TRIM亚家族基因 finTRIM/ftr (Fish novel large multigene TRIM gene)。在大西洋鲑(Salmo salar)[30]、斜带石斑鱼(Epinephelus coioides)[31]和尼罗罗非鱼(Oreochromis niloticus)[32]等硬骨鱼类中发现病毒和病毒模拟体poly(I:C)诱导TRIM25基因表达, 而且TRIM25基因在体外过表达可抑制病毒复制, 在培养的鱼类细胞中可以增强干扰素信号基因表达[32]。这些研究充分表明TRIM25基因可能在硬骨鱼类抗病毒免疫应答中发挥重要作用。
大黄鱼(Larimichthys crocea)是我国一类重要的海洋经济鱼种[33,34]。近年来, 大黄鱼遭受细菌、寄生虫和病毒等的危害, 对大黄鱼养殖产业造成严重的影响[35,36]。因此, 为建立控制大黄鱼疾病的有效措施, 需要更深入地研究大黄鱼抗病分子机理。为研究大黄鱼抗病免疫机制, 本研究选择大黄鱼TRIM家族中的TRIM25基因进行初步研究。因此,本研究对大黄鱼TRIM25基因编码区进行分子克隆,并研究该基因的分子特征以及在poly(I:C)感染后的表达分析。
1 材料与方法
1.1 实验动物
实验所用大黄鱼是来自中国浙江省舟山市, 用于实验的每条大黄鱼约重100 g。实验大黄鱼需在25℃水箱中暂养2周左右, 每天至少投喂2次。实验大黄鱼麻醉后被处死, 取头肾、脾脏、肝脏和外周血等组织, 并将取出的各组织在-80℃冻存。每组实验设置3个平行。
1.2 poly(I:C)的用法
病毒dsRNA模拟体poly(I:C)原液(Sigma-Aldrich)溶解在1 mg/mL的磷酸盐缓冲液(PBS)中, 通过腹腔向大约重100 g的大黄鱼体内注射0.25 mg poly(I:C), 对照组注射等量无菌PBS溶液。在poly(I:C)注射入大黄鱼后, 分别在3h、6h、12h、24h和48h时间点以及注射PBS的对照组取外周血、头肾、脾脏和肝脏主要免疫组织, 在-80℃冻存。
1.3 TRIM25基因克隆
采用Trizol试剂(Invitrogen, USA)从冻存的大黄鱼各个组织(-80℃保存)中提取总RNA, 总RNA纯度用1%琼脂糖凝胶电泳检测, 通过NanoDrop 2000核酸蛋白检测仪对总RNA浓度测定, RNA样品OD值一般在1.8—2.1视为纯度极高。然后按照SuperScriptTMIII反转录酶试剂盒(Invitrogen, USA)说明书将5 μg总RNA反转录合成第一链cDNA。
根据大黄鱼转录组获得TRIM25基因编码序列,针对TRIM25基因设计特异性的引物TRIM25-F/TRIM25-R (表 1), 以大黄鱼脾脏cDNA作为模板,用EasyTaq®DNA Polymerase (全式金)进行聚合酶链式反应(PCR)。PCR反应体系(20 μL): 上下游引物各0.4 μL, 2.5 mmol/L dNTP Mixture 1.6 μL, 10×EasyTaq®Buffer 2 μL, EasyTaq®DNA Polymerase 0.2 μL, 模板0.4 μL, 加无菌去离子水15 μL; 设置PCR反应条件为: 95℃预变性5min; 95℃变性30s,58℃退火30s, 72℃延伸10s, 32个循环; 72℃终延伸10min。PCR产物利用1%琼脂糖凝胶分离, 并利用普通琼脂糖凝胶DNA回收试剂盒(天根, 中国)进行胶回收, 然后连接并克隆到pGEM-T载体上(Promega, USA), 通过蓝白斑筛选获得阳性克隆子, 送至上海华大基因测序。最后用DNAstar软件拼接测序后的序列, 获得大黄鱼TRIM25基因完整编码序列, 并命名为LcTRIM25。
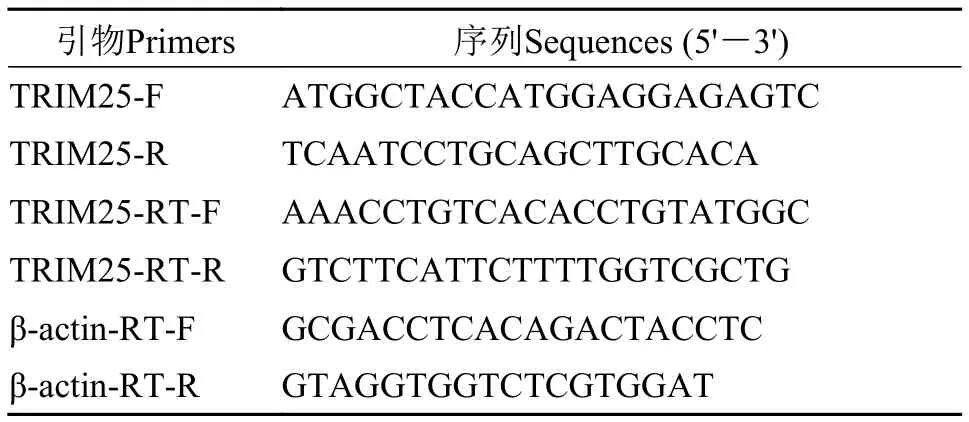
表1 PCR引物信息Tab. 1 PCR primer sequences information
1.4 TRIM25基因生物信息学分析
LcTRIM25核苷酸序列通过MEGA7.0软件翻译为氨基酸序列[37], 并通过DNAMAN软件对多个物种的TRIM25基因进行多序列比对。利用ExPAsy(https://web.expasy.org/protparam/)在线软件对LcTRIM25蛋白进行序列分析。另外, 利用SMART在线软件(http://smart.embl-heidelberg.de/)预测LcTRIM25蛋白结构域。TRIM25基因系统发育分析是在不同物种的TRIM25氨基酸序列基础上, 采用MEGA7.0软件中的一种自下向上(聚集)的聚类方法——相邻连接(NJ)方法生成系统进化树[38]。
1.5 实时荧光定量PCR表达分析
用Trizol方法提取冻存的poly(I:C)感染大黄鱼的外周血、脾脏、头肾和肝脏组织的总RNA,RNA浓度和纯度的检测同1.2, 使用SuperScriptTMIII反转录酶试剂盒进行反转录, 合成第一链cDNA。根据克隆获得的LcTRIM25基因编码序列, 利用primer premier 5.0设计荧光定量特异性引物TRIM25-RT-F/TRIM25-RT-R (表 1)。管家基因β-actin[39]为本实验内参基因, 内参基因是LcTRIM25基因表达的内部参照物, 是实时荧光定量PCR (qRT-PCR)系统工作时的某种标准,β-actin荧光定量引物β-actin-RT-F/β-actin-RT-R (表 1)。
用SYBR®Premix ExTaq™ (TaKaRa, Japan)试剂在ABI 7500快速实时PCR系统(Applied Biosystems, USA)上检测LcTRIM25基因在各组织的相对表达量, 每组实验设置3个平行。实时荧光定量20 μL PCR反应体系: 0.8 μL上下游引物、0.4 μL ROX Reference Dye II、10 μL TB Green Premix ExTaqII、1 μL cDNA模板, 7 μL DEPC水。荧光定量PCR反应结束, 利用2-ΔΔCt方法分析LcTRIM25基因表达量, 并通过SPSS软件中方差分析(ANOVA)了解实验组和对照组基因表达差异, 采用邓肯(Duncan)多重比较法分析基因相对表达量[40]。采用均值±标准差(SE)分析实验数据结果,P<0.05为具有显著性差异,P<0.01为具有极显著性差异。
2 结果
2.1 大黄鱼TRIM25基因序列分析
经扩增、测序获得LcTRIM25基因编码序列全长为2097 bp, GenBank登录号: MK327541, 编码698个氨基酸。ExPAsy在线软件预测LcTRIM25蛋白分子量为77.99 kD, 分子式为C3404H5402N966O1047S43,理论等电点是8.66, 富含丝氨酸(Ser, 11%)、亮氨酸(Leu, 8.6%)和赖氨酸(Lys, 7.6%)。利用在线软件SMART预测蛋白结构域, LcTRIM25蛋白结构分析发现未包含信号肽, 包括3个高度保守的结构域, 分别是RING结构域(第20—57位氨基酸)、B-box2结构域(第151—191位氨基酸)、Coiled-coil结构域(第227—281位氨基酸)和可变的C末端PRY/SPRY结构域(第523—697位氨基酸)。
2.2 TRIM25蛋白多序列比对
经Blastx在线软件分析发现LcTRIM25氨基酸序列与斜带石斑鱼TRIM25氨基酸序列同源性较高(67%)。另外, LcTRIM25氨基酸序列与人类(Homo sapiens, XM_005082.4)、小鼠(Mus musculus, NM_009546.2)、鸡(Gallus gall, NM_001318458.1)、非洲爪蟾(Xenopus laevis, XM_018238270.1)、斑马鱼(NM_200175.1)和斜带石斑鱼(KX_258199.1)的TRIM25氨基酸序列利用DNAMAN软件进行多序列比对。多序列比对结果发现TRIM25蛋白结构域序列相似性相对较高; 并且大黄鱼和斜带石斑鱼TRIM25氨基酸序列具有较高同源性, 与Blastx分析结果相同。
2.3 TRIM25基因系统进化树构建
收集来自GenBank数据库中已发表的不同物种(两栖动物、哺乳动物、爬行动物、鸟类和硬骨鱼类)TRIM25基因序列。在TRIM25氨基酸序列基础上, 构建系统进化树(图 1)。TRIM25系统进化树显示分为单独的三支, 分别是哺乳动物、爬行动物和鸟类聚集为一支; 硬骨鱼类聚为一支; 两栖动物为一支。其中, 哺乳动物、爬行动物和鸟类各自为一小支, 说明哺乳动物, 爬行动物和鸟类的TRIM25基因同源性很高。另外, 系统进化树表明大黄鱼TRIM25基因与鲈形目斜带石斑鱼同源性较高, 亲缘关系最近; 与两栖动物、爬行动物、鸟类和哺乳动物同源性相对低。
2.4 LcTRIM25基因组织表达分析
本实验采用qRT-PCR方法检测健康大黄鱼肌肉、皮肤、脑、肠、外周血、心脏、脾脏、头肾、肝脏9个正常组织中LcTRIM25基因的表达。qRTPCR结果表明,LcTRIM25基因在被检测的9个组织中广泛表达, 但表达量相对较低(图 2)。LcTRIM25基因在不同组织中的表达水平存在差异, 以表达量为1的肌肉组织为参考, 在肝脏中表达量最高, 约为对照组3倍, 在心脏中表达量最低, 约为对照组1/300倍(图 2), 这种差异性表达可能是由不同的组织表达模式所诱导。
2.5 LcTRIM25基因在poly(I:C)感染后的时序表达
qRT-PCR结果显示, 在poly(I:C)感染大黄鱼后,LcTRIM25基因在各组织中(外周血、头肾、脾脏和肝脏)的表达水平与对照组相比显著升高(图 3)。在外周血中LcTRIM25基因的表达量在24h达到最高,24—48h表达量逐渐降低(图 3A); 在头肾中LcTRIM25基因表达水平在12h达到最高峰后出现下降趋势(图 3B); 在脾脏中LcTRIM25基因表达量在6h到达峰值, 从6—48h期间表达量逐渐下降(图 3C); 在肝脏中,LcTRIM25基因表达量从3—6h期间呈现下降趋势, 在6—12h表达量逐渐上升并在12h达到最高值, 之后表达量呈现下降趋势(图 3D)。
3 讨论
在之前的研究中根据TRIM家族成员结构域的组成以及进化角度将TRIM家族分为两大类(Group1, Group2): Group1包含除SPRY结构域的多种C末端结构域, 进化较慢, 结构保守; Group2的特征是C端具有SPRY结构域并且仅具有B-box2结构域, 而且Group2的进化速度比Group1更快速[41—43]。在本研究中, 大黄鱼TRIM25基因通过扩增、测序获得其编码序列全长2097 bp, 编码698个氨基酸;蛋白结构预测发现LcTRIM25从N端到C端具有保守的结构域(RING、B-box2和Coiled-coil)和可变的C末端PRY/SPRY结构域; 另外, 多序列比对和系统进化树分析表明LcTRIM25基因与鲈形目斜带石斑鱼TRIM25基因的同源性较高, 而且系统进化树表明大黄鱼与哺乳动物、爬行动物、鸟类和两栖动物TRIM25基因同源性相对低。这可能是因为不同物种所处环境不同, 面对不同的环境选择压力, 导致不同的进化速度和进化方向[42]。这些分子特征分析说明大黄鱼TRIM25基因属于Group2 TRIM家族。
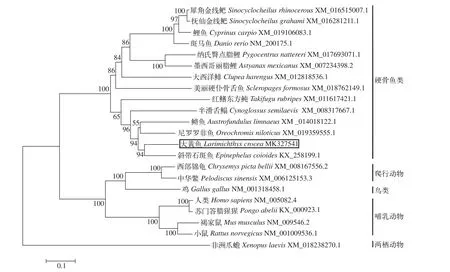
图1 TRIM25基因系统进化树(NJ)Fig. 1 Phylogenetic trees of TRIM25 gene (Neighbor-joining)
研究发现Group2的TRIM家族成员在病毒感染的先天免疫反应中发挥重要作用[42,44,45], 例如TRIM27通过靶向作用IKKs负调控参与抗病毒应答和炎症反应的信号转导[44],TRIM21在泛素化非降解途径中有助于巨噬细胞天然免疫的激发[46]和TRIM5α被认为是先天性细胞对HIV-1抗性的物种特异性介质[47]等。在本研究中, qRT-PCR结果显示LcTRIM25在健康大黄鱼9个正常组织中广泛存在,但表达水平相对较低, 这与斜带石斑鱼TRIM25基因[31]和韩国鳑鲏(Rhodeus uyekii)TRIM25基因[48]研究一致。LcTRIM25基因在肝脏中达到最高表达量,这可能是为了满足肝脏在体内进行新陈代谢的需要, 而且在头肾、肠和肌肉中表达量较高, 说明大黄鱼TRIM25基因在免疫相关组织中高度表达。
另外, 早有研究证明硬骨鱼类TRIM25基因对病毒感染具有快速响应模式。大西洋鲑感染传染性鲑鱼贫血病毒(ISAV)[30]和斜带石斑鱼感染poly(I:C)或石斑鱼虹彩病毒(SGIV)时[31],TRIM25基因表达水平都呈现迅速上升后下降趋势。本研究对LcTRIM25基因在健康大黄鱼注射poly(I:C)后不同时间点的表达水平变化进行检测。LcTRIM25基因在外周血、头肾、脾脏和肝脏中表达量迅速增加, 均出现上升到达峰值后下降的趋势; 其中头肾和脾脏中LcTRIM25基因表达量在6h达到峰值; 肝脏中LcTRIM25基因表达量在12h达到峰值; 外周血中LcTRIM25基因在24h达到最高表达水平且上调幅度最大, 这可能是因为外周血是机体重要的免疫场所, 外周血中含有可以直接参与免疫反应的白细胞[32], 另外, poly(I:C)通过腹腔注射入大黄鱼体内随外周血液循环扩散到主要免疫组织, 组织感染poly(I:C)后迅速反应, 从而TRIM25基因在相关免疫组织中表达水平比在外周血中更快到达峰值, 而在血液循环过程中TRIM25基因一直持续表达。这说明大黄鱼TRIM25基因可能在先天免疫应答过程中发挥重要作用。

图2 LcTRIM25基因在大黄鱼健康组织中的表达Fig. 2 Tissue specific expression of LcTRIM25 gene in healthy Larimichthys crocea
综上所述, 经过分子克隆、测序首次确定大黄鱼TRIM25基因编码序列全长, 并检测LcTRIM25基因在健康大黄鱼以及感染poly(I:C)后的表达量变化。LcTRIM25基因在被检测的健康大黄鱼各个组织中均表达, 在肝脏中表达量最高; 健康大黄鱼注射poly(I:C)后,LcTRIM25基因在免疫组织中表达水平迅速上调, 且不同组织中LcTRIM25基因表达模式具有差异性。初步推测大黄鱼TRIM25基因可能在先天抗病毒免疫反应中发挥作用, 为研究Group2 TRIM家族成员在硬骨鱼类中的抗病毒免疫应答提供理论参考。

图3 LcTRIM25基因在poly(I:C)刺激后的时序表达Fig. 3 The relative expression of LcTRIM25 gene after poly(I:C) challenge
