IL-4 和IFN-γ 对COPD 患者肺成纤维细胞HIF-1α 和TGF-β1 表达的影响
2019-11-22曾慈梅欧宗兴黄邓高马西淼
曾慈梅 欧宗兴 黄邓高 沈 彬 王 蕾 马西淼 曹 卉
1.中南大学湘雅医学院附属海口医院呼吸内科,海南海口 570208;2.中南大学湘雅医学院附属海口医院心胸外科,海南海口 570208;3.中南大学湘雅医学院附属海口医院中心实验室,海南海口 570208
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种慢性肺部气流受限的疾病,气道重塑是COPD 重要的病理生理学改变[1]。γ 干扰素(interferon-γ,IFN-γ)和白细胞介素4(interleukin-4,IL-4)分别是CD4+T 细胞亚群Th1、Th2 最具代表性的细胞因子,可采用IFN-γ/IL-4 来表征Th1/Th2 亚群分布状态[2];同时,COPD 患者血清中IFN-γ 和IL-4 水平的动态变化与COPD 病程密切相关[3]。近期的研究[4-5]表明IFN-γ 和IL-4 直接参与了COPD 相关的气道和血管重构进程,但具体的机制不明。缺氧诱导因子1α(hypoxia inducible factors,HIF-1α)和转化 生长因子β1(transferring growth factor β1,TGF-β1)在COPD 诱发的血管重塑过程中发挥了重要作用[6-8]。本研究拟评价IFN-γ 和IL-4 对COPD 患者肺成纤维细胞HIF-1α、TGF-β1 表达的影响,并结合患者临床资料;初步探讨IFN-γ 和IL-4 在COPD 患者气道重塑中的作用,为治疗COPD 提供新思路。
1 资料与方法
1.1 一般资料
收集2017 年12 月~2018 年8 月在中南大学湘雅医学院海口附属医院胸外科因肺癌进行手术切除的正常肺组织(16 例)标本和肺癌合并COPD 患者(12 例)的肺组织切片标本。术前均征求患者同意,并记录患者的年龄、性别、吸烟史和肺功能,并以肺功能为依据,根据全球慢性阻塞性肺疾病(GOLD2017)标准分级。排除标准:合并哮喘、支气管扩张和间质性肺疾病等其他肺部疾病史者。
1.2 试剂与方法
重组人IL-4 和IFN-γ 购自R&D 公司;HIF-1α和TGF-β1 一抗购自Abcam 公司;β-actin 一抗和所有二抗购自中杉金桥公司;引物由生工生物工程股份有限公司合成。
1.3 COPD 患者肺成纤维细胞与正常肺成纤维细胞的原代培养
取1 cm3COPD 肺活检组织,无菌磷酸缓冲盐溶液(PBS)漂洗3 遍,剪碎组织块成匀浆状,取约1 mm3左右组织碎块接种于24 孔板,待组织碎块贴附后加入DMEM-10%FBS l mL 培养,每3~4 天换液,1~2 周左右可见组织碎块周围有成纤维细胞爬出,继续培养至细胞融合成片铺满大部分容器底部,0.25%胰蛋白酶0.2 g/L EDTA 消化并转移到25 mL 培养瓶,常规培养,1∶2 传代,取第2~5 代细胞进行实验。取1 cm3正常部位肺组织,参照“COPD 患者肺成纤维细胞原代培养”的方法进行操作。
1.4 qRT-PCR
TRIzolTMReagent(Invitrogene)提取细胞总RNA,取300 ng 总RNA 进行反转录制备cDNA,采用Takara公司的PrimeScriptTMRT Master Mix 试剂,反应体系和时间参照产品说明书进行;将反转录后的cDNA 稀释10 倍进行qRT-PCR,采用Takara 公司的TB GreenTMPremix Ex TaqTMⅡ试剂,反应体系和时间参照产品说明书进行;使用Applied Biosystem 7500 Fast 系统进行实验。引物序列如下:HIF-1α,上引物:5′-GCCAGATCTCGGCGAAGTAA-3′;下引物:5′-CCAGTTAGTTCAAACAGCATCCA-3′TGF-β1;上引物:5′-CTGTCCAACATGATCGTGCG-3′;下引物:5′-TGACACAGAGATCCGCAGTC-3′;β-actin,上引物:5′-AGACCTGTAC-GCCAACACAG-3′;下引物:5′-TTCTGCATCCTGTCGGCAAT-3′。采用2-△△Ct法计算mRNA 相对变化倍数。
1.5 Western blot
消化细胞,500 g/min 收集,加入适量体积RIPA裂解液,冰上裂解1 h,收集上清进行BCA 定量,调整上样浓度,将蛋白样品行10% SDS-PAGE 电泳,后电转至PVDF 膜上,5% BSA 室温封闭2 h,一抗4℃孵育过夜,二抗4℃孵育2 h,ECL 检测。
1.6 统计学方法
采用SPSS 17.0 统计软件对所得数据进行统计学分析。计量资料采用均数±标准差()表示,两组均数间比较采用t 检验,相关性分析采用Pearson 直线相关法,以P <0.05 为差异有统计学意义。
2 结果
2.1 COPD 患者及正常肺成纤维细胞的原代培养
光镜下可见肺组织块周围有成纤维细胞长出,伴随上皮细胞、间皮细胞、内皮细胞或平滑肌细胞混杂,第三代肺成纤维细胞呈典型纺锤状形态,贴壁良好。第四代肺成纤维细胞视野内已几乎没有其他细胞存在,生长状态良好。收集细胞用流式细胞术进行鉴定,可见波形蛋白阳性细胞率达98%以上。见图1。

图1 肺成纤维细胞的原代培养
2.2 HIF-1α 和TGF-β1 在COPD 患者肺成纤维细胞中的表达情况
与正常肺成纤维细胞比较,COPD 患者肺成纤维细胞中HIF-1α 的mRNA 平均上调2.5 倍左右(P <0.01);TGF-β1 的mRNA 平均上调2.2 倍左右(P <0.01)。见图2。

图2 HIF-1α 和TGF-β1 在COPD 患者肺成纤维细胞中的表达
2.3 IL-4 对正常肺成纤维细胞中HIF-1α 和TGF-β1生成的影响
用重组人IL-4(50 ng/mL)刺激正常肺成纤维细胞,结果显示:IL-4 可引起肺成纤维细胞HIF-1α、TGF-β1 的mRNA 和蛋白表达升高(n=5,P <0.05),见图3A~B,且IL-4 的作用时间与HIF-1α、TGF-β1的蛋白表达水平呈正相关(n=5,P <0.05)。见图3C。
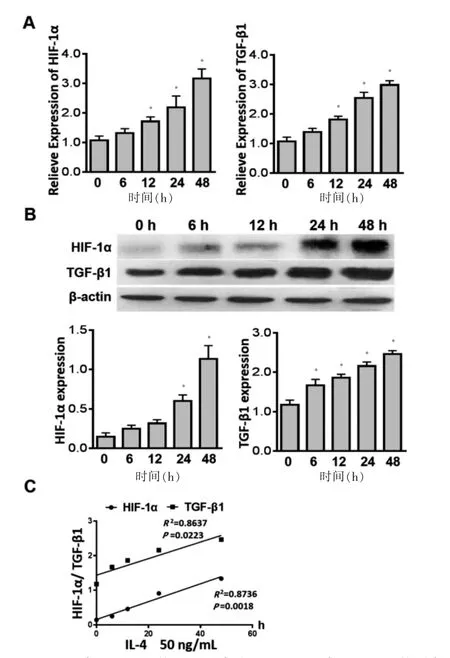
图3 IL-4 对正常肺成纤维细胞HIF-1α 和TGF-β1生成影响(n=5)
2.4 IFN-γ 对正常肺成纤维细胞HIF-1α 和TGF-β1生成的影响
用重组人IFN-γ(50 ng/mL)刺激正常肺成纤维细胞,结果显示:IFN-γ 可引起肺成纤维细胞HIF-1α、TGF-β1 的mRNA 和蛋白表达降低(n=5,P <0.05),见图4A~B,且IFN-γ 的作用时间与HIF-1α、TGF-β1的蛋白表达水平呈负相关(n=5,P <0.05)。见图4C。
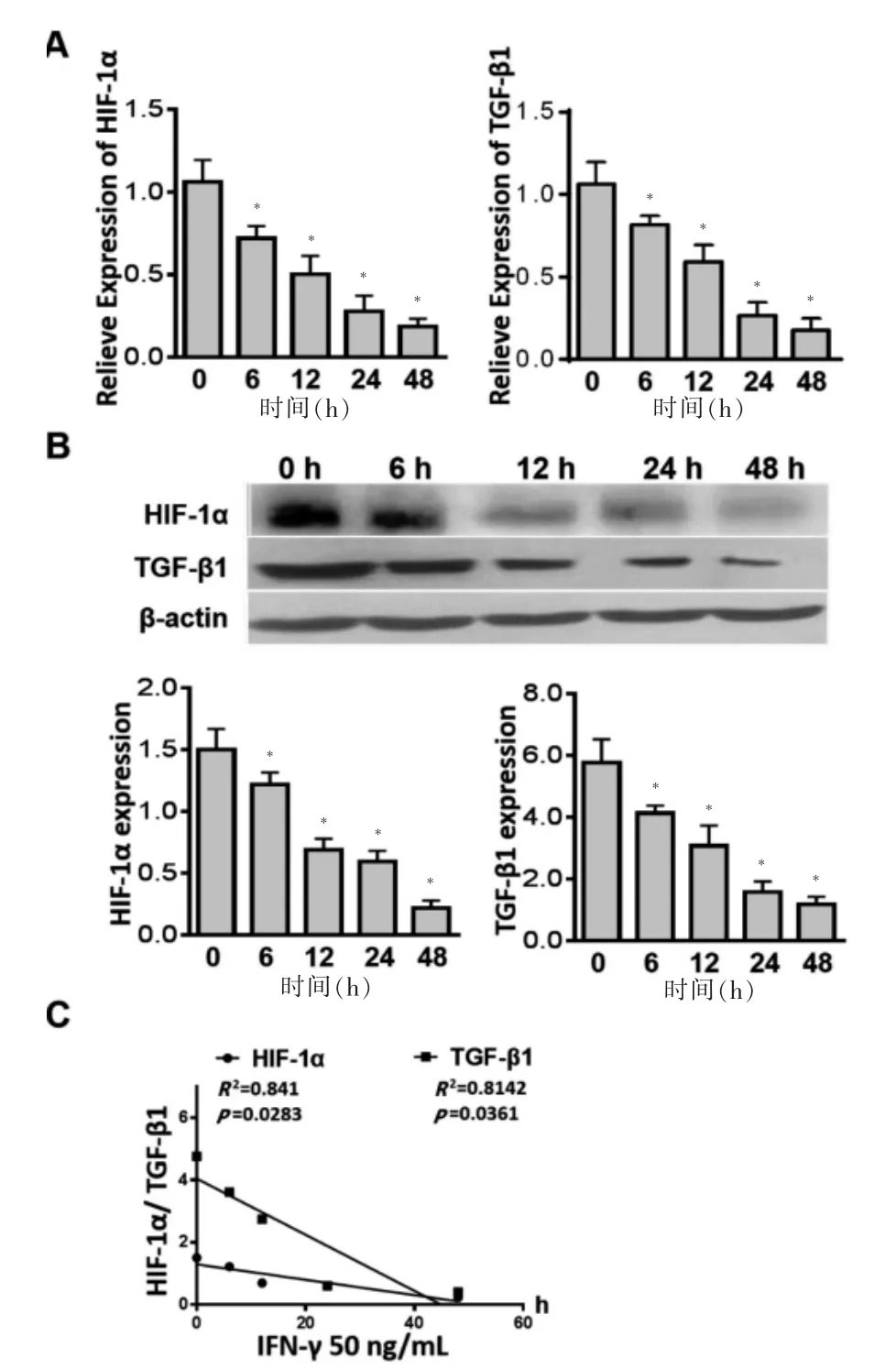
图4 IFN-γ 对正常肺成纤维细胞HIF-1α 和TGF-β1 生成的影响
3 讨论
气道重塑是COPD 重要的病理生理学改变[1]。目前已发现有50 多个细胞因子与COPD 的发生、发展有关[9]。IFN-γ 和IL-4 分别是CD4+T 细胞亚群Th1、Th2最具代表性的细胞因子,可采用IFN-γ/IL-4 来表征Th1/Th2 亚群分布状态。Th1/Th2 细胞直接参与了COPD 的病理进程,而COPD 患者的Th1 细胞亚群向Th2 细胞亚群转化是导致急性COPD 发作的重要诱因[10-13]。亦有研究报道IFN-γ 和IL-4 直接参与COPD诱发的气道重塑,但具体机制不明。
COPD 患者以长期慢性低氧为特征,在肺血管重塑阶段,较低的氧浓度可诱导HIF-1α 表达和活性增加[14],并可通过激活其下游分子直接参与COPD 气道重塑过程。TGF-β1 是上皮-间质转化(EMT)过程中重要的调控因子,可通过Smad 通路、ERK/MAPK、PI3K/AKT、Wnt 通路等多种途径促使气道上皮细胞损伤、间充质细胞增生,诱发气道重塑和气流受限[15-16]。结合近期的文献报道[17-20]和IFN-γ、IL-4 在COPD 发生、发展进程中的重要作用,本课题组推测IFN-γ和IL-4可能会通过HIF-1α、TGF-β1 影响气道重塑过程。
本研究中,以COPD 患者和正常肺成纤维细胞为研究对象,利用重组人IL-4 和IFN-γ 刺激肺成纤维细胞,模拟COPD 急性期和稳定期血清中IL-4/IFN-γ对肺成纤维细胞的影响。研究发现:HIF-1α 和TGFβ1 在COPD 患者肺成纤维细胞中高表达;IL-4 可促进正常肺成纤维细胞HIF-1α、TGF-β1 的生成,且IL-4 的作用时间与HIF-1α、TGF-β1 的蛋白表达水平呈正相关;IFN-γ 可抑制HIF-1α 和TGF-β1 的生成,IFN-γ 的作用时间与HIF-1α、TGF-β1 的蛋白表达水平呈负相关。上述结果提示在COPD 患者急性期,血清中高水平的IL-4 和低水平的IFN-γ 发挥协同作用,诱导肺成纤维细胞产生HIF-1α、TGF-β1,从而促进COPD 气道重塑的发生。但IL-4/IFN-γ 调控肺成纤维细胞HIF-1α/TGF-β1 生成的作用机制仍不清楚,相关调控网络需要进一步阐明。
