吡嘧司特钾咀嚼片的制备和质量考察
2019-11-21赵斌锋
姜 成,赵斌锋
(浙江金立源药业有限公司,浙江 绍兴 312369)
吡嘧司特钾是由美国施贵宝公司首先研制合成的抑制抗原引起的变态反应介质释放的药物,1991 年在日本由BMS 公司以Pemirolastion(商品名)、Mitsubishi-Tokyo 公司以Alegysal(商品名)上市,主要用于治疗轻中度过敏性支气管哮喘、过敏性鼻炎、过敏性皮炎及眼结膜炎等[1],剂型主要为片剂[2-3]。由于咀嚼片[4]具有易咀嚼、味道可口(掩味或可接受的味道)、尺寸及形状适中、易崩解的特点,本文作者采用《中华人民共和国药典》规定的硬度、脆碎度和崩解度试验方法和要求[5],进行处方的优化筛选;同时,按照《中华人民共和国药典》规定的试验方法,对其进行了含量、溶出度和稳定性考察,成功制备出符合《中华人民共和国药典》规定的吡嘧司特钾咀嚼片。该剂型可以解决儿童患者用药难题,为吡嘧司特钾临床用药多样化提供支持。
1 仪器与材料
MP5002 电子天平(上海舜宇恒平科学仪器有限公司),RC8MD 溶出仪(天津天大天发科技有限公司),UV-2600 紫外-可见分光光度计(日本Shimadzu 公司),标准筛(上虞五四建材仪器厂),DHG-9246A 电热恒温鼓风干燥箱(上海精宏实验设备有限公司),ZPS008 实验室旋转式压片机(上海天祥健台制药器械有限公司),BJ-2A 崩解时限测定仪(天津国铭医药设备有限公司),YD-35 智能片剂硬度仪(天津天大天发科技有限公司),KBF720 稳定性试验箱(德国Binder 公司)。
吡嘧司特钾(浙江金立源药业有限公司,批号0101820170412),蔗糖(南宁桂之隆药用辅料有限公司),甘露醇、微晶纤维素(旭城株式会社),可溶性淀粉、羧甲基淀粉钠、乳糖、硬酯酸镁(安徽山河药用辅料股份有限公司),预胶化淀粉(湖州展望药业有限公司),阿司巴坦(西安泰华医药科技有限公司),桔子香精(泰兴市三华食品添加剂厂),乙醇(湖南湘易康制药有限公司)。
2 方法与结果
2.1 吡啶司特钾嚼片的制备
2.1.1 制备工艺
按处方配比取吡嘧司特钾、甘露醇、微晶纤维素、预胶化淀粉、羧甲基淀粉钠、阿司巴坦和桔子香精,分别过80 目筛,混合均匀,以体积分数70%的乙醇溶液作润湿剂,20 目筛湿法制粒,置80 ℃烘箱鼓风干燥约2 h,18 目筛整粒,再混入处方量的硬脂酸镁,压片即得。
2.1.2 处方筛选
本品设计规格为5 mg,处方以吡嘧司特钾为主药,甘露醇为稀释剂和矫味剂,预胶化淀粉、微晶纤维素为稀释剂,羧甲基淀粉钠为崩解剂,阿司巴坦和桔子香精为矫味剂;硬脂酸镁为润滑剂;体积分数70%乙醇为润湿剂,通过对制粒情况和咀嚼片外观性状、口味、脆碎度以及崩解度项目的综合考察,筛选最佳处方。各处方中吡嘧司特钾均为5 mg、香精为3 mg、硬脂酸镁3 mg,体积分数70%乙醇适量,其他材料用量见表1。通过对不同处方工艺的制粒状况和制成的咀嚼片的外观性状、口味、脆碎度以及崩解度考察,处方6 的各项常规检查指标较好,由此确立为本品的制备处方,考察结果见表2。
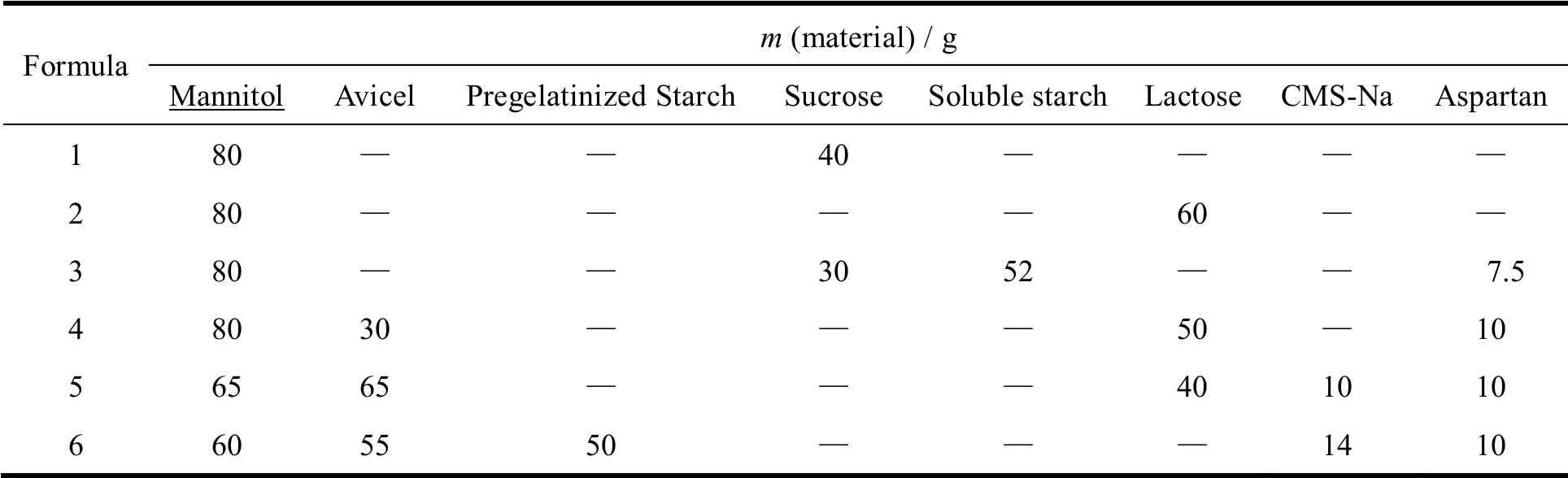
Table 1 Formulation of pemirolast potassium chewable tablets表1 吡嘧司特钾咀嚼片的处方组成
2.2 吡啶司特钾嚼片的含量测定
2.2.1 测定波长的选择
分别取吡嘧司特钾对照品和空白辅料适量,用水溶解并稀释使成每1 mL 含吡嘧司特钾约10 µg 的溶液。按《中华人民共和国药典》2015 年版四部分光光度法,在波长200~400 nm 内扫描测定。结果吡嘧司特钾在波长357 nm 处有最大吸收,且辅料成份溶液在波长357 nm 处无吸收,故确定357 nm 为本品的检测波长。
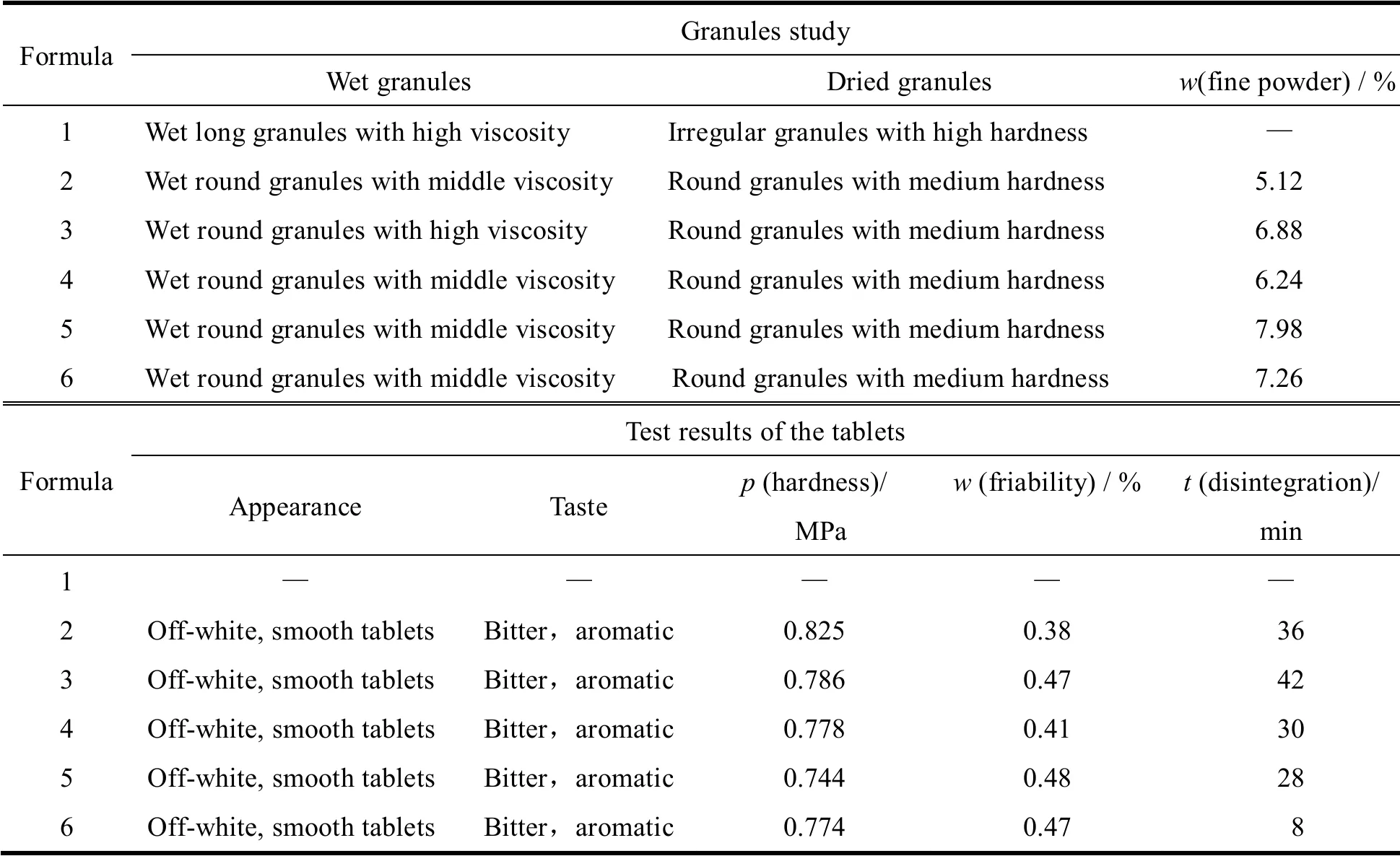
Table 2 Investigation of formulation of pemirolast potassium chewable tablets表2 吡嘧司特钾咀嚼片处方的考察结果
2.2.2 标准曲线绘制
取吡嘧司特钾对照品约20 mg,精密称定,置于500 mL 量瓶中,用水溶解并稀释至刻度,摇匀,分别吸取上述溶液1、2、3、4 和5 mL 置于10 mL 量瓶中,用水稀释至刻度,摇匀。用紫外-可见分光光度仪在波长357 nm 处分别测定吸光度,以质量浓度对吸光度进行回归,其回归方程为A=3.1×10-3+6.21×10-2ρ(r=0.999 8,n=5),吡嘧司特钾水溶液的质量浓度在3.6~18.0 µg·L-1内线性良好。
2.2.3 精密度试验
取同一批号本品6 份各10 片,精密称定,研细,精密称取细粉适量(约相当于吡嘧司特钾5 mg),置于50 mL 量瓶中,用水溶解(必要时可超声)并稀释至刻度,摇匀,滤过。精密量取续滤液1 mL 置于10 mL 量瓶中,用水稀释至刻度,摇匀,作为供试溶液。按“2.2.5”条方法,在波长357 nm 处测定吸光度,计算含量。结果测量值平均RSD 为0.51%,表明本方法的重现性及精密度较好。
2.2.4 回收率试验
田卓对马老说,我们“十大本土最具发展潜力房地产企业”评选活动的策划就是高先生做的,操作性很强,目前进展得很顺利,具体情况我会单独向您汇报的。
按本品规格的50%、80%、100%(并以一定放大比例)分别精密称取吡嘧司特钾;再分别精密称取混合粉适量(约相当于吡嘧司特钾10 mg),置于100 mL 量瓶中,用水溶解(必要时可超声)并稀释至刻度,摇匀,滤过。精密量取续滤液1 mL,置于10 mL 量瓶中,加水稀释至刻度,摇匀,作为供试溶液。另取吡嘧司特钾对照品约10 mg,精密称定,置于100 mL 量瓶中,用水溶解并稀释至刻度,摇匀,精密量取1 mL,置10 mL 量瓶中,加水稀释至刻度,摇匀,作为对照溶液。按“2.2.5”条方法测定吸光度,计算得其平均回收率为99.44%(n=9),RSD 为0.55%。
2.2.5 含量测定
取本品10 片,精密称定,研细,精密称取细粉适量(约相当于吡嘧司特钾5 mg),置于50 mL量瓶中,用水溶解(必要时可超声)并稀释至刻度,摇匀,滤过。精密量取续滤液1 mL 置于10 mL量瓶中,用水稀释至刻度,摇匀,作为供试溶液。另取吡嘧司特钾对照品适量,精密称定,加水溶解并稀释成每1 mL 含10 µg 的溶液,摇匀,作为对照溶液。结果20180618、20180619 和20180620三批样品的含量质量分数分别为99.19%、98.96%和98.63%。
2.3 吡啶司特钾嚼片的溶出度考察
2.3.1 溶出均一性考察
按《中华人民共和国药典》2015 年版四部溶出度测定法,以水900 mL 为溶剂,转速为100 r·min-1,依法操作。分别于5、10、15、30、45、60 和60 min 时取样各10 mL,同时补加等量同温度水,滤过,取续滤液作为供试溶液;另取吡嘧司特钾对照品约10 mg,精密称定,置于100 mL 量瓶中,用水溶解并稀释至刻度,摇匀,精密吸取1 mL,置于10 mL 量瓶中,加水稀释至刻度,摇匀,作为对照溶液。将上述供试溶液和对照溶液在波长357 nm 处分别测定吸光度,计算出每片在不同时间点的溶出度,结果见表3。结果显示,吡嘧司特钾咀嚼片10 min 溶出度平均值达95.39%,不同样品测得的溶出度无显著差异,溶出均一性良好,符合《中华人民共和药典》规定的要求。
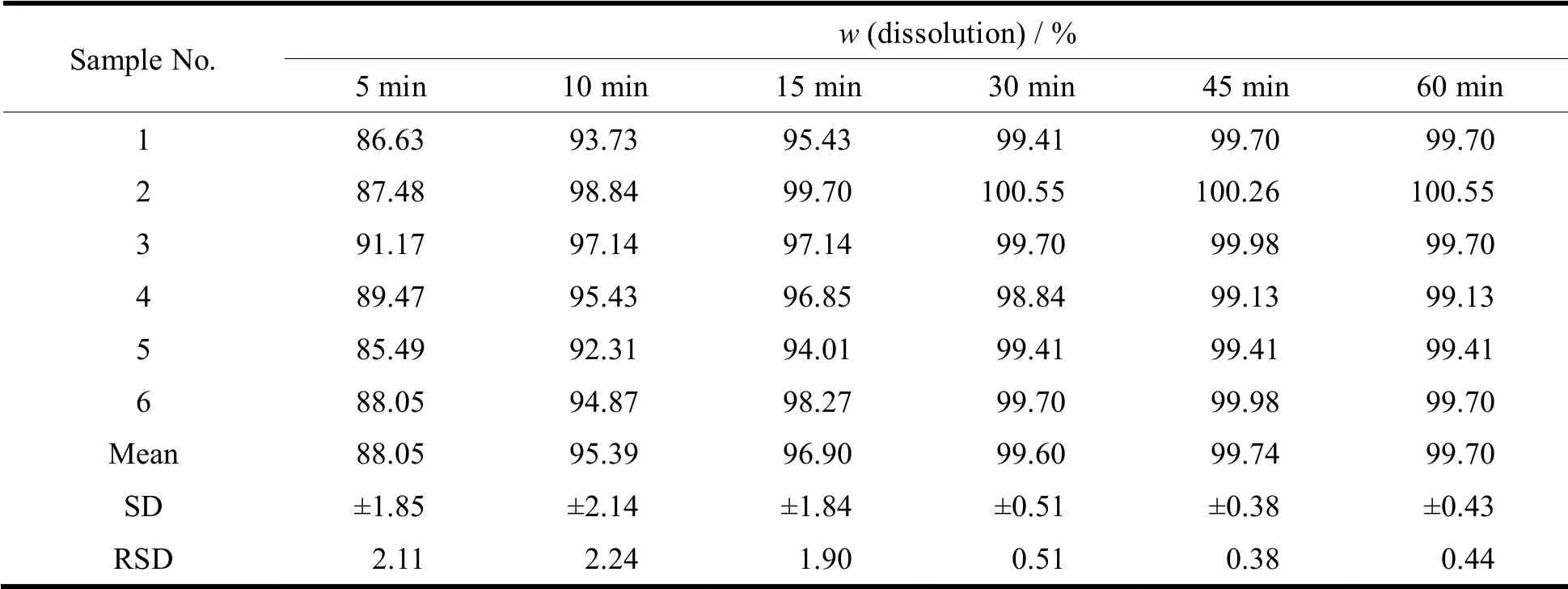
Table 3 Test results of dissolution homogeneity of pemirolastpotassium chewable tablets表3 吡嘧司特钾咀嚼片溶出均一性试验结果
2.3.2 溶出度测定
取本品适量,照《中华人民共和国药典》2015 年版四部溶出度测定法,以水900 mL 为溶剂,转速为100 r·min-1,依法操作,于30 min 时取样15 mL,滤过,取续滤液作为供试溶液;另取吡嘧司特钾对照品约10 mg,精密称定,置于100 mL 量瓶中,用水溶解并稀释至刻度,摇匀,精密量取1 mL,置10 mL 量瓶中,加水稀释至刻度,摇匀,作为对照溶液。按“2.2.5”条方法测定并计算每片的溶出量。结果20180618、20180619 和20180620 三批样品溶出度结果分别为99.01%、98.55%和98.37%。
2.4 吡啶司特钾嚼片中有关物质的检测
取本品细粉适量(约相当于吡嘧司特钾5 mg),精密称定,置于50 mL 量瓶中,加水溶解并稀释至刻度,摇匀,滤过,取续滤液作为供试溶液。量取供试溶液1 mL,置于100 mL 量瓶中,用水稀释至刻度,摇匀,作为预试溶液,即对照溶液。按《中华人民共和国药典》2015 年版四部高效液相色谱法测定。色谱条件为:用十八烷基键合硅胶为填充剂,以水(用冰醋酸调pH 值至3.5)-甲醇(体积比60∶40)为流动相,检测波长为257 nm,理论板数以吡嘧司特钾峰计算应不低于2 500。取预试溶液20 µL 注入液相色谱仪中,调节检测灵敏度,使主成分色谱峰的峰高为满量程的10%~25%,再分别取供试溶液和对照溶液各20 µL 注入液相色谱仪,记录色谱图至主成分峰保留时间的两倍,供试溶液中如有杂质峰,量取各杂质峰面积之和,与对照溶液主峰面积的1.5 倍比较。结果20180618、20180619 和20180620 三批产品中有关物质的含量质量分数分别为0.23%、0.23%和0.22%。
2.5 吡啶司特钾嚼片的稳定性考察
2.5.1 吡嘧司特钾咀嚼片的强度稳定性试验
最佳处方样品模拟商品包装,分别在光照(4 500±500)lx、高温(60 ℃)及高湿(75%)条件下,在第5 天、第10 天取样,进行外观、含量、溶出度和有关物质考察,结果见表4。结果表明:处方样品在光照、高温条件下考察10 d 后,各项检查指标均表现稳定,表明该处方适合本品的制备,结合一般咀嚼片的贮存条件,本品仍宜室温、遮光、密闭保存。

Table 4 Observation results of stress testing of pemirolast potassium chewable tablets表4 吡嘧司特钾咀嚼片的强度稳定性试验考察结果
2.5.2 吡嘧司特钾咀嚼片的加速稳定性试验
将三批模拟销售包装的样品置于相对湿度为75%、温度为40 ℃的条件下存放,分别于第1、2、3、6 月取样,对样品的性状、溶出度、含量和有关物质进行考察,结果见表5。结果表明:吡嘧司特钾咀嚼片样品在包装条件下,高温、高湿条件下存放6 个月后,各项检查指标均未见明显变化。
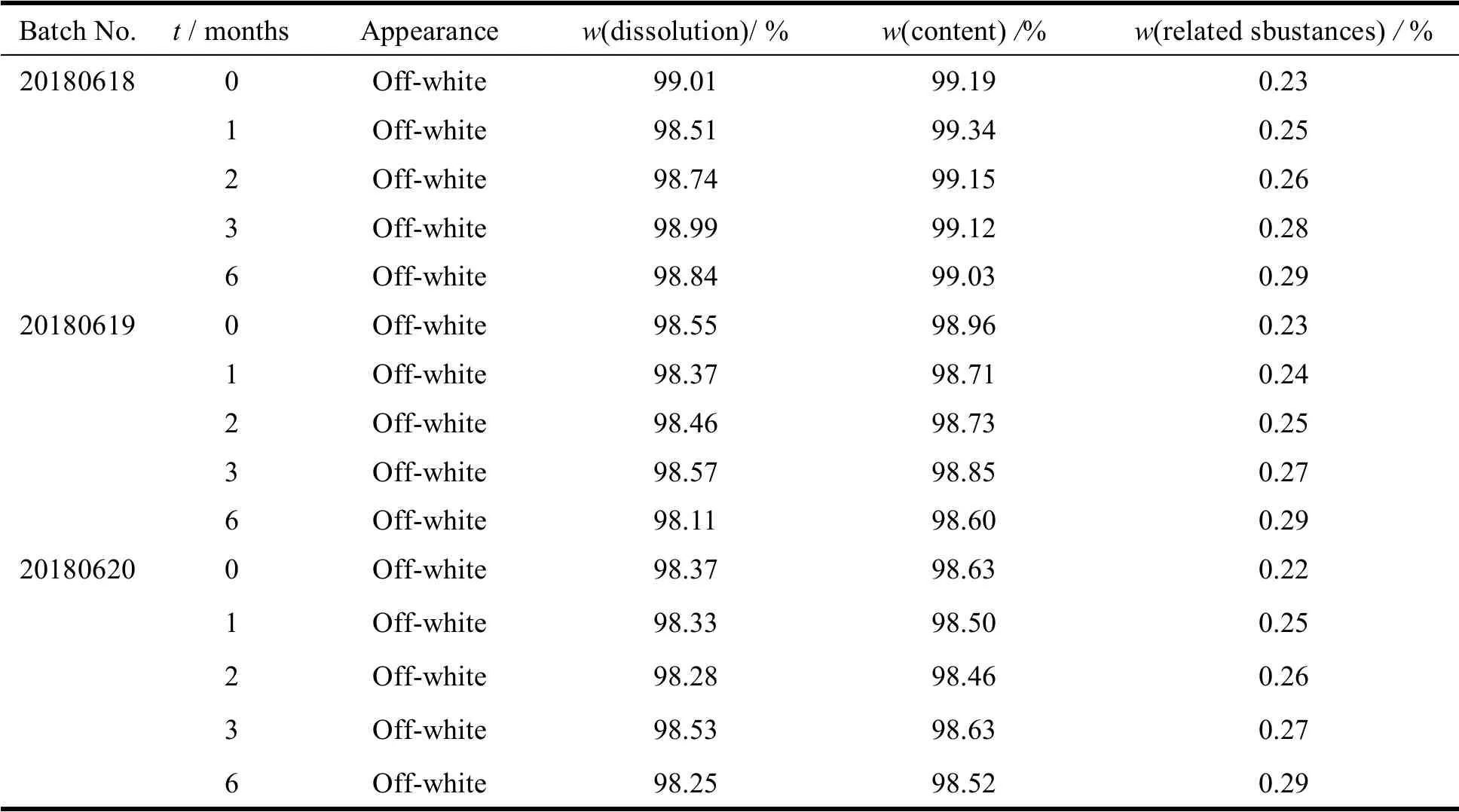
Table 5 Test results of accelerated stability of pemirolast potassium chewable tablets表5 吡嘧司特钾咀嚼片的高温、高湿加速试验结果
2.5.3 吡嘧司特钾咀嚼片的长期留样稳定性考察
将三批模拟销售包装的吡嘧司特钾咀嚼片,置温度(25 ± 2)℃、相对湿度为60% ± 5%的条件下,分别于3、6、9、12 个月取样,并对其性状、溶出度、含量进行考察,用高效液相色谱法进行有关物质检查,12 个月的长期稳定性试验结果见表6。

Table6 Test results of long-term stability of pemirolast potassium chewable tablets表6 吡嘧司特钾咀嚼片样品长期留样试验结果
3 讨论
3.1 剂型与处方选择
吡嘧司特钾剂型以传统的片剂为主,后来又出现了外用的鼻喷剂[6]和滴眼液[3,7],但针对不同适应症,尤其是儿童及动物保健用药使用传统片剂有诸多不便。加之,咀嚼片[8]有溶出快和服用携带方便等优点,所以该剂型作为首先。
处方选择根据FDA 发布的咀嚼片关键质量属性指导原则,咀嚼片应具备的四大特征:易咀嚼、味道可口(掩味或可接受的味道)、尺寸及形状适中、易崩解,以有利于药片破碎和活性成分溶出。咀嚼片的关键质量属性包括硬度、崩解时限、溶出度以及其他影响生物利用度和生物等效性的因素[9],为处方筛选提供依据。
3.2 含量、溶出度和有关物质检测方法
含量和溶出度常见报道有HPLC[7]、RP-HPLC[9-10],紫外-可见分光光度法较为少见,虽然HPLC、RP-HPLC 有检测精准的优点,但费用高,且耗时。根据吡嘧司特钾对紫外-可见光有显著的特征吸收峰,确立采用紫外-可见分光光度法测定。验证表明,该方法可以满足检测要求和相应的检测精度,并且有省时省力、简单易行的优点。
有关物质的检测采用HPLC 方法,专属性实验结果表明,吡嘧司特钾与其降解物质的分离效果令人满意,溶剂水及辅料在此条件下无干扰,经过验证,该方法精密度高、稳定性好。因此采用本法作为吡嘧司特钾咀嚼片的有关物质检查法。
3.3 稳定性试验考察
影响因素试验考察并没有按照起草的质量标准进行全检,只是有重点选择性状、溶出度和有关物质作为考察重点,因为在处方筛选一节中,已选取硬度、脆碎度和崩解度作为筛选依据。影响因素试验可以为处方调整提供支持,同时对产品的贮存和有效期的制定提供依据。
加速稳定性和长期留样稳定性试验为产品的有效期提供参考依据和数据。长期留样12 个月数据显示各个考察项目未见明显变化。
