吉西他滨/顺铂双载脂质体的大鼠体内药代动力学研究
2019-11-21褚未,丁宁,唐星*
褚 未,丁 宁,唐 星*
(沈阳药科大学 药学院, 辽宁 沈阳 110016)
癌症的治疗涉及手术、放射治疗和全身治疗(化学药物治疗)中的一种或多种,低风险患者在早期疾病中通常仅通过手术治愈,但在许多情况下,综合治疗是必须的[1]。其中化疗是转移性肿瘤的主要治疗方式,因为通过血流递送有利于蓄积于癌症部位。尽管化学疗法在癌症治疗中取得了进展,但是由于单独用药产生的耐药性会导致癌症的复发,并且二次治疗的反应率较差[2]。
因此在恶性肿瘤的临床治疗中,使用两种作用机制不同的抗肿瘤活性成分联合化疗已成为常规使用方法,并有很好的效果。联合药物治疗的实践可以追溯到许多世纪前传统中医在处方中使用草药组合的方法[3-4],普遍来说,联合药物治疗有机会做到减小剂量、降低毒性和减少或延缓耐药性的产生,于此同时增大或维持疗效[5]。联合用药方案的确定,需要遵守以下原则:(1)靶向于细胞周期的不同阶段,可以产生最大细胞毒性并减小出现抗性的可能;(2)药物作用机制不同以产生协同作用,并按照最佳剂量与周期给药;(3)药物毒性应控制到最小,从而降低药物对器官组织的损伤。
吉西他滨属于细胞周期特异性药物,主要作用于S 期细胞,抑制DNA 合成,顺铂属细胞周期非特异性药物,作用于增殖周期中各期细胞,与DNA 链上碱基作用抑制肿瘤细胞分裂[2]。两药联用时,GEM 的给药使G1 和G2 期细胞比例增加,可以使CDDP 发挥最大效果,达到协同作用[6],两药作用方式见图1[1]。但由于两药理化性质与药物代谢存在差异,吉西他滨通常受其不良药代动力学和快速代谢失活的限制,在肿瘤部位很难达到最佳药物比例,不可控的联合用药方案可能导致严重的不良反应。因此,需要开发一种组合药物的递送系统,以克服游离铂药物和吉西他滨的限制。
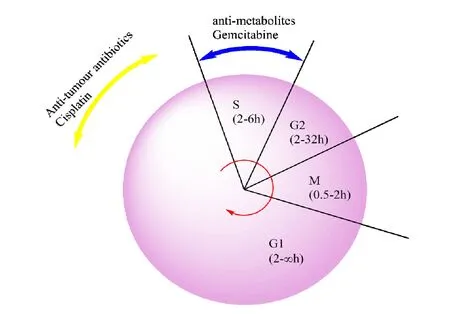
Fig. 1 Schematic diagram of the action mechanism of gemcitabine and cisplatin图1 吉西他滨与顺铂细胞作用机制图
与传统小分子药物相比,纳米药物递送系统更易于控制药物的相关性质。脂质体、纳米粒、胶束等均属于抗癌药物递送载体,其中脂质体是经由美国FDA 批准的可用于癌症治疗的制剂,其脂质膜结构与活细胞膜结构相似,是具有生物相容性和可生物降解性的自组装囊泡,而且可以降低毒性和不良反应以及减少抗肿瘤药物在健康组织中的蓄积。另外,脂质体可以调控药物的物理性质,例如粒径与电位,也可以改善药物的药代动力学性质和药物释放情况。在联合治疗的药物递送方面,脂质体独特的结构特点使其具有得天独厚的优势,可以同时包封亲水与疏水的药物,使不同性质的药物可以在同一脂质体系统内组合;增大载药能力[7],减小给药频率并降低毒性[8];可以通过调整制备方法按比例包封与释放药物,使其以受控的方式发挥作用[9],更有利于达成联合用药的最佳临床效果。
作者初步考察了吉西他滨/顺铂双载脂质体(mPEG-Gemcitabine/cisplatin-liposomes,mPEG-GEM/CDDP-LP)的体外释放特征,同时考察了制剂的药代动力学性质,为进一步研究mPEG-GEM/CDDP-LP 注射给药奠定基础。
1 仪器与材料
ACCULAB ATL-124 分析天平(赛多利斯科学仪器有限公司),S6000 高效液相色谱仪(华普科仪(北京)科技有限公司),水浴恒温培养摇床(上海智城分析仪器制造有限公司),nov AA 400P原子吸收光谱仪(德国耶拿分析仪器股份公司),Xevo TQ/MS 三重四级杆串联质谱仪(美国Waters公司),VB-77 智能样品处理仪(北京莱伯泰科公司),L-119A 样品浓缩仪(北京来亨科贸有限责任公司),YKH-Ⅲ涡旋混合器(江西医疗器械厂),HC-3018R 高速冷冻离心机(安徽中科中佳科学仪器有限公司)。
盐酸吉西他滨(纯度质量分数≥98%,沈阳津昌制药有限公司),顺铂(昆明贵研药业有限公司),大豆卵磷脂S100、DSPE-mPEG(艾伟拓(上海)医药科技有限公司),聚谷氨酸(PLG-g-mPEG,中国科学院长春应用化学研究所),高纯胆固醇(纯度质量分数为95%,百灵威科技有限公司),拉米夫定(纯度质量分数≥98%,大连美仑生物技术有限公司),其他试剂(分析纯,市售),水为纯化水(杭州娃哈哈集团有限公司)。
SD 健康大鼠10 只,雄性,体质量(200 ± 20)g,沈阳药科大学动物实验中心提供,动物许可证号 SYXK(辽)2018-0006。
2 方法
2.1 脂质体体外释放考察
2.1.1 脂质体与药物溶液的相关性质
释放实验中所使用的mPEG-GEM/CDDP-LP 为实验室自制的同时包载吉西他滨与聚谷氨酸-顺铂胶束的双载脂质体,粒径在140 nm 左右,其中吉西他滨包封率在47%左右,顺铂包封率在15%左右,且吉西他滨与顺铂药物质量浓度比约为5∶3。GEM/CDDP-SOL 中药物质量浓度为:吉西他滨为1 g·L-1,顺铂为0.6 g·L-1。
2.1.2 脂质体与药物溶液中药物的释放
采用透析法考察吉西他滨/顺铂溶液(GEM/CDDP-SOL)和吉西他滨/顺铂脂质体(mPEG-GEM/CDDP-LP)的体外释放行为,选择pH 值为7.4 的PBS 缓冲液为释放介质。
分别精密吸取GEM-CDDP-SOL、GEM-CDDP-LP 各1 mL 封装于经煮沸并处理好的透析袋内,扎紧后置于装有40 mL pH 值7.4 PBS 缓冲溶液的锥形瓶中,37 ℃水浴摇床中振摇,分别于0.167、0.33、1、2、4、8、12 和24 h 吸取2 mL 释放介质,同时补加2 mL 同温的释放介质,高效液相测定GEM 和CDDP 含量,按如下公式计算累积释放百分率。
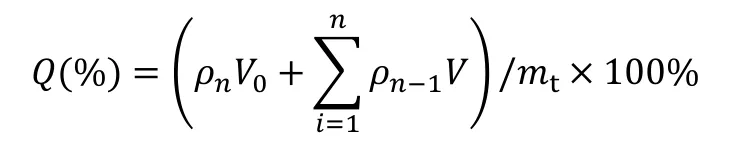
其中:ρn指某时间点测得药物质量浓度,V 指取样体积,V0指释放介质总体积,mt指加入总药量。
2.2 高效液相色谱-串联质谱法测定血浆中GEM 药物浓度
2.2.1 分析方法
色谱条件: 色谱柱为Phenomenex Kinetex XB C18柱(50 mm×21 mm, 2.6 µm),流动相A 为含体积分数0.1%的甲酸水溶液,流动相B 为甲醇,流动相组成为A 与B 的体积比是8∶2,流速为0. 2 mL·min-1,每次进样总时间为2 min,进样量20 µL。
质谱条件: ESI 离子源,正离子检测模式,毛细管电压为3 kV,锥孔电压为20 V,源温和脱溶剂气温度分别为150 ℃和400 ℃,脱溶剂气和锥孔气( N2)流速分别为550 L·h-1和50 L·h-1,检测的GEM 和拉米夫定的m/z 值分别为264.03、111.92 和229.92、111.91。
2.2.2 血浆样品处理
精密量取小鼠血浆50 µL 置于离心管中,加入20 mg·L-1拉米夫定溶液20 µL 和甲醇50 µL,涡旋混合30 s,加入3.5 mL 异丙醇和乙酸乙酯混合溶液(体积比1∶2.5)涡旋混合10 min 后,6 000 r·min-1离心10 min,取上清液2 mL,氮气吹干,400 µL 流动相复溶后,1.2×104r·min-1离心10 min,取上清液5 µL 高效液相色谱-串联质谱法测定。
2.2.3 标准曲线的绘制
吉西他滨标准溶液: 精密称取盐酸吉西他滨对照品16 mg,置于100 mL 量瓶中,加甲醇定容,得质量浓度为160 mg·L-1的盐酸吉西他滨标准储备液。取盐酸吉西他滨标准储备液,用甲醇依次稀释,得质量浓度分别为160、80、40、16、8、4、1.6 µg·L-1和800、400、80 ng·L-1的盐酸吉西他滨系列标准溶液,备用。
内标溶液: 精密称取拉米夫定标准品20 mg,置于100 mL 量瓶中,加甲醇定容,得质量浓度为200 mg·L-1的拉米夫定标准储备液,甲醇稀释制得质量浓度为20 ng·L-1的拉米夫定内标溶液,备用。
取大鼠空白血浆50 µL,分别加入质量浓度分别为20、10、5、2、1、0.5、0.2、0.1、0.05 和0.01 µg·L-1盐酸吉西他滨系列标准溶液50 µL,配制盐酸吉西他滨系列血浆标准溶液,按“2.2.2”条方法操作,以血浆中待测物质量浓度( ρ,µg·L-1)为横坐标,待测物与内标峰面积的比值( A) 为纵坐标,用加权最小二乘法进行线性回归运算,得标准曲线方程为A =2.277×10-4ρ-1.991×10-3,r2=0. 992 4。结果表明,盐酸吉西他滨质量浓度在0.01~20 µg·L-1内与峰面积比呈良好线性关系。
2.3 原子吸收法测定血浆中CDDP 药物浓度
2.3.1 分析方法
灯电流为6 mA,检测波长为266.0 nm,光谱通带宽度为0.2 nm,保护气体为氩气,进样量为20 µL,干燥温度80 ℃持续20 s、90 ℃持续20 s 、110 ℃持续10 s,灰化温度350 ℃持续20 s、1 300 ℃持续10 s,原子化温度2 200 ℃持续8 s。
2.3.2 血浆样品处理
精密量取血浆样品100 µL 置于10 mL 刻度试管中,加硝酸-高氯酸(V∶V = 9∶1)混合溶液2 mL,浸泡过夜后,使用智能样品处理仪进行消化处理,消化温度 140 ℃,消化时间6 h,补加硝酸-高氯酸混合溶液1 mL,消化至无色,继续加热至160 ℃,使液体挥发近干,加蒸馏水0.2 mL赶酸,重复2 次,使酸除尽,加体积分数0.2%的硝酸定容至1 mL,涡旋10 min 混匀。
2.3.3 标准曲线的绘制
精密称取四氯铂酸钾对照品2.15 mg(按Pt 计1.0 mg)置于10 mL 量瓶中,加体积分数0.2%的硝酸溶解并定容,制得按Pt 计100 mg·L-1的储备液。精密量取上述储备液适量,加体积分数0.2%的硝酸稀释成按Pt 计质量浓度为0.5、1、2、5、7.5、10 和20 mg·L-1的系列溶液,4 ℃保存备用。
取大鼠空白血浆100 µL,加入四氯铂酸钾系列标准溶液100 µL,按“2.3.2”条方法处理血浆样品,然后配制成相当于Pt 血浆质量浓度为50、100、200、500、750、1 000 和2 000 µg·L-1的样品溶液,进样20 µL,记录吸光度。以血浆中待测物质量浓度( ρ,µg·L-1)为横坐标,待测物吸光度(A) 为纵坐标,用加权最小二乘法进行回归运算,求得直线回归方程A=3.0×10-4ρ-4.0×10-4, r2=0. 992 6 即为标准曲线,结果表明,Pt 的质量浓度在50~2 000 µg·L-1内与吸光度呈良好线性关系。
2.4 药物溶液的制备
GEM/CDDP-SOL 的制备:精密称取吉西他滨原料药10 mg、顺铂原料药6 mg 置于10 mL 量瓶中,用生理盐水定容,制备成按吉西他滨计1 mg·L-1、按顺铂计0.6 mg·L-1的吉西他滨/顺铂水溶液。
2.5 大鼠体内药物动力学试验
健康雄性SD 大鼠10 只,随机分为2 组:一组尾静脉注射GEM/CDDP-SOL,另1 组尾静脉注射自制的吉西他滨/顺铂双载药脂质体,按吉西他滨计5 mg·kg-1、顺铂计3 mg·kg-1剂量给药。给药后分别于0.083、 0.25、0. 5、1、2、4、6、8、12、24 和48 h 眼眶静脉丛取血500 µL,置肝素抗凝管中,4 000 r·min-1条件下离心10 min 分离血浆。按“ 2.2.2”和“ 2.3.2”条方法操作,高效液相色谱-串联质谱法和原子吸收法测定,所得数值带入标准曲线,计算血药浓度,并计算药物动力学参数。
3 结果
3.1 脂质体的体外释放结果
GEM/CDDP-LP 和 GEM/CDDP-SOL 在两种释放介质中的体外释放曲线见图2。
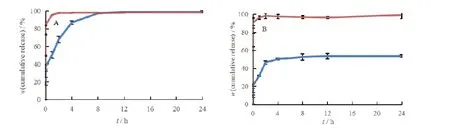
Fig. 2 In vitro release profile of gemcitabine liposomes and gemcitabine solution(A),cisplatin liposomes and cisplatin solution(B)图2 吉西他滨脂质体与吉西他滨溶液(A)和顺铂脂质体与顺铂溶液(B)的体外释放曲线
由图2 可知,GEM/CDDP-SOL 中的GEM 和CDDP 释放非常迅速,在最初的1 h 内几乎全部释放,GEM 释放的质量分数为(95.530 9 ± 0.01)%、CDDP 释放的质量分数为(96.307 15 ± 1.92)%,而GEM-CDDP-LP 中的GEM 和CDDP 释放则相对缓慢,GEM 为(50.50 ± 3.62)%、CDDP 为(31.58 ±1.69)%。其中GEM 在将近8 h 后的累积释放量为(97.26 ± 0.27)%与GEM/CDDP-SOL 的1 h点相近,可认为GEM/CDDP-LP 在10 mmol·L-1磷酸盐缓冲液(pH 值7.4)中具有一定的缓释特征,吉西他滨/顺铂脂质体体外释放较溶液慢,其原因可能是药物被包裹在胶束及脂质体内水相中,发挥了药物贮库作用,使药物在释放介质中缓慢释放。
以脂质体中药物释放为研究对象,分别通过零级动力学方程、一级动力学方程、Higuchi 方程、Ritger-peppas 方程和Weibull 方程对体外释放曲线进行拟合,结果见表1。从方程的相关系数可知,药物的释放最符合Weibull 方程,说明药物释放为扩散机理。

Table 1 Regression equation for drug release from liposomes表1 药物从脂质体中释放的回归方程
3.2 药物动力学结果
GEM/CDDP-LP 和GEM/CDDP-SOL 的平均血药浓度-时间曲线见图3。
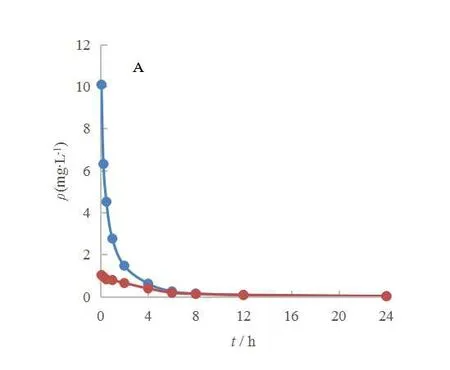
Fig. 3 Blood concentration-time curve of gemcitabine liposomes and gemcitabine solution(A) and cisplatin liposomes and cisplatin solution(B) in rats图3 大鼠体内吉西他滨脂质体与吉西他滨溶液(A)与和顺铂脂质体与顺铂溶液(B)的血药浓度-时间曲线图
经DAS 软件计算分析,主要药动学参数见表2。由表2 可以看出,脂质体组的AUC0-t和AUC0-∞分别是:GEM 为12.42 mg·h·L-1和12.50 mg·h·L-1,CDDP 为19.03 mg·h·L-1和19.82 mg·h·L-1,脂质体组的AUC0-t:GEM-LP 是GEM-SOL 的2.63 倍,CDDP-LP 是CDDP-SOL 的45.86 倍。脂质体组的曲线下面积AUC 明显大于溶液剂组,延长在体内的作用时间,表明GEM/CDDP-LP 在体内的吸收效果优于GEM/CDDP-SOL,生物利用度更好。溶液剂注射后药物迅速吸收,随着药物分布可快速代谢,血浆浓度突然下降。与溶液组相比,GEM/CDDP-LP 组的CL 明显减小,GEM/CDDP-LP 的ρmax值明显大于GEM/CDDP-SOL,ρmax的增加表明脂质体在增加药物吸收方面是有效的,说明与溶液组相比,GEM/CDDP-LP 具有更长的释放时间,表现出缓释作用。
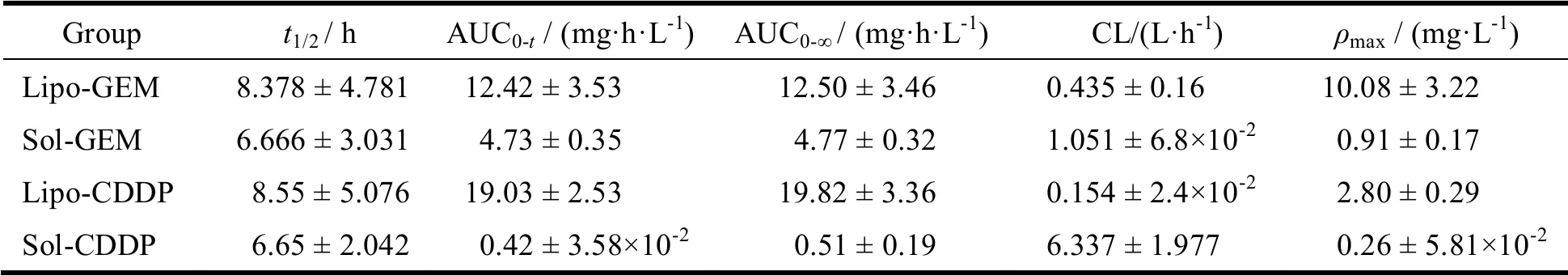
Table 2 Pharmacokinetic parameters of GEM/CDDP-LP and GEM/CDDP-SOL in rats表2 大鼠体内GEM/CDDP-LP 与GEM/CDDP-SOL 的主要药物动力学参数
4 讨论
a. 吉西他滨由于水溶性较强,导致其脂质体包封率不高,容易渗漏。制备脂质体的过程中,尝试的逆相蒸发法可以得到较大的包封率,但其粒径在1 µm 以上,若采取探头超声或挤出等方法整粒减小粒径,会导致吉西他滨包封率迅速降至10%左右。其原因为:粒径大时,内水相体积较大,逆相蒸发包封率与其内水相体积有关,而脂质体注射剂粒径应在200 nm 以下为佳,因此该方法不可取。最终经过筛选,采用薄膜分散-硫酸铵梯度法可得到较大包封率,且粒径可控的双载脂质体[10]。
b. 实验中的脂质体释放结果表示,GEM/CDDP-SOL 的释放非常迅速,在最初1 h 内GEM 几乎全部释放,与GEM/CDDP-LP 中GEM 在8 h 后的累积释放量相近,由此可认为脂质体中药物在磷酸盐缓冲液中有一定缓释特征。释放情况为两相释放曲线,在第一阶段相对快速释放,然后在第二阶段缓慢释放。制剂组在最初释放阶段释放较快,这可能是由于脂质体表面吸附药物的扩散引起的,第二阶段特征在于从形成的脂质体中缓慢释放,可能是药物被包裹在脂质体内水相中,发挥了贮库作用,双层磷脂膜充当药物的膜屏障,胆固醇的存在对磷脂双层有稳定作用。脂质材料中的不饱和磷脂增加了膜的流动性,使药物缓慢释放。
c. 吉西他滨联合顺铂是治疗非小细胞肺癌(NSCLC)的一线用药,但两药均存在着给药后在血液中快速分布全身,半衰期短的问题。这增大了两药的毒性以及限制了药物的疗效。脂质体由于具有组织相容性、靶向性和缓释性等突出优势,因此考虑制备成脂质体改善其药代动力学性质。结果显示,mPEG-DSPE 修饰的脂质体可影响药物的体内行为,具有长循环效果,同时一定程度上可提高GEM 和CDDP 在大鼠体内的生物利用度。mPEG-DSPE 为两亲性线性聚合物,PEG 具有亲水性,脂质体形成过程中,DSPE 端可与磷脂膜结合,达到修饰表面的效果。
d. 通常脂质体的理化性质、表面性质、膜流动性和大小等因素是影响脂质体稳定性和在血液中清除速率的主要因素[11]。血液中蛋白成分会导致脂质体聚集,并由于网状内皮吞噬作用导致其从血流中迅速清除,脂质体带有的负电荷可以增加药物的循环时间,血浆和血细胞带有负电荷,具有负表面电荷的脂质体可以通过静电相互作用减小相互接触,防止其聚集和黏附。采用mPEG-DSPE 修饰脂质体,使其包在脂质体的表面,可以避免脂质体被网状内皮系统识别。PEG长链结构通过其亲水性和空间排斥作用显著减少与蛋白质的非特异性相互作用,可在脂质体表面形成电晕,提供空间稳定性并赋予“隐形”性质,预防蛋白质吸收。基于肝脏过滤、组织外渗、组织扩散和肾脏排泄等生理参数,粒径是长循环脂质体达到治疗效果的关键,粒径与蛋白质吸收之间存在相关性,小粒径脂质体的血浆清除速率会更小,这可能是因为小粒子的表面会有更大的表面PEG 密度。脂质体表面暴露出亲水性的多羟基基团,减少与血浆中血浆蛋白的结合,降低了血液成分对脂质体的清除率,从而增加其在血液中的稳定性,增大体内循环时间,提高药物在大鼠体内的生物利用度。
