单宁酸与大豆分离蛋白相互作用研究
2019-11-20由耀辉熊林颖孙绪兵
由耀辉,熊林颖,陈 虹,彭 洋,王 丹,欧 洁,孙绪兵
(1.内江师范学院 化学化工学院,四川 内江641000; 2.内江师范学院 果蔬类废弃物资源化四川省高等学校重点实验室,四川 内江641000)
大豆分离蛋白是一类资源丰富、价格低廉、环境友好的植物蛋白,具有良好的成膜性、食品安全性及营养价值,在食品包装领域展现出良好的应用前景[1]。然而,天然大豆分离蛋白膜的物理化学性能尚不能完全满足应用需求,需要对其进行改性处理。在众多改性方法中,交联改性是一种改善大豆分离蛋白膜性能的有效策略,醛类化合物、环氧化合物、京尼平、碳化二亚胺、谷氨酰胺转氨酶等常用于对大豆分离蛋白交联改性以形成互穿网状结构[2-4],从而改善大豆分离蛋白性能,但是作为食品包装材料,这些交联剂在成本及安全性等方面尚存在较大的问题。单宁酸是一类来源广泛的植物多酚,其与蛋白质有良好交联能力,并且具有一定的抗氧化和抑菌能力,被认为是一种安全的食品添加剂[5-6]。近年来,已有研究将单宁酸用于对大豆分离蛋白膜改性[7-9]。然而,这些研究工作主要聚焦于单宁酸对大豆分离蛋白膜宏观性能的影响,鲜有从分子水平揭示单宁酸对大豆分离蛋白结构的影响。
基于此,本文通过荧光光谱研究单宁酸与大豆分离蛋白的作用方式,采用同步荧光光谱、紫外光谱及圆二色谱等方法,研究单宁酸对大豆分离蛋白构象的影响,为开发单宁酸-大豆分离蛋白基复合材料提供理论指导。
1 材料与方法
1.1 试验材料
大豆分离蛋白(SPI),食品级,临沂山松生物制品有限公司;单宁酸(相对分子质量为1 701.2),分析纯,上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
F-4600荧光分光光度计,日本日立公司;UV-2000 紫外可见分光光度计;Chirascan圆二色谱仪,英国应用光物理公司。
1.2 试验方法
1.2.1 样品的制备
用0.01 mol/L磷酸盐缓冲液(pH 6.8)分别配制0.2 g/L的大豆分离蛋白溶液、10×10-6mol/L的单宁酸溶液及一系列大豆分离蛋白-单宁酸混合溶液,使混合溶液中大豆分离蛋白溶液的质量浓度固定为0.2 g/L,单宁酸浓度分别为0、1×10-6、2×10-6、4×10-6、6×10-6、8×10-6、10×10-6mol/L(相对大豆分离蛋白质量分数的0、0.85%、1.7%、3.4%、5.1%、6.8%、8.5%)。
1.2.2 荧光光谱
将大豆分离蛋白-单宁酸混合溶液分别在293、313、333 K下作用30 min后测定荧光光谱。内源荧光光谱测试条件:激发波长280 nm,激发和发射狭缝均为5 nm,扫描速度1 200 nm/min,以混合溶液中对应浓度的单宁酸溶液校零,波长扫描范围295~450 nm。同步荧光光谱测定条件:在293 K下,发射波长与激发波长的差值分别固定15 nm和60 nm。
1.2.3 紫外光谱
在293 K下,以大豆分离蛋白-单宁酸混合溶液中对应浓度的单宁酸溶液校零,于240~350 nm范围测定大豆分离蛋白-单宁酸混合溶液的紫外吸收光谱。
1.2.4 圆二色谱
取0.2 g/L的大豆分离蛋白溶液、10×10-6mol/L 的单宁酸溶液及对应浓度的大豆分离蛋白-单宁酸溶液,于293 K下作用30 min,在波长190~260 nm、光径1 mm条件下,扫描远紫外区圆二色谱,通过扣除磷酸盐缓冲液及单宁酸溶液背景获得大豆分离蛋白及大豆分离蛋白-单宁酸的圆二色谱图。取大豆分离蛋白平均残基摩尔质量为115 g/mol,将圆二色谱的y轴椭圆率(单位mdeg)转换为蛋白质的平均残基摩尔椭圆率(单位deg·cm2/dmol)。通过CDPro软件处理数据,选择算法为CONTINLL,参考蛋白为SMP56,计算α-螺旋、β-折叠、β-转角和无规卷曲的含量。
2 结果与分析
2.1 单宁酸与大豆分离蛋白的作用方式
2.1.1 单宁酸对大豆分离蛋白内源荧光光谱的影响
蛋白质内源荧光的变化可直接反映生色基团自身和周围微环境的变化。通常认为,当激发波长为280 nm时,可同时激发蛋白质色氨酸和酪氨酸残基,其中以色氨酸的贡献为主[10]。以280 nm为激发波长,以大豆分离蛋白-单宁酸溶液在293 K下作用30 min为例,考察不同浓度单宁酸对大豆分离蛋白内源荧光光谱的影响,结果如图1所示。

图1 不同浓度单宁酸对大豆分离蛋白荧光光谱的影响
由图1可见,随着单宁酸浓度增加,大豆分离蛋白荧光强度显著降低,表明单宁酸对大豆分离蛋白的内源荧光产生猝灭作用。同时亦可发现,随着单宁酸浓度增加,大豆分离蛋白的最大荧光发射波长从335 nm红移至345 nm。通常认为,最大荧光发射波长红移表示荧光基团所处微环境更加亲水,这一现象表明单宁酸与大豆分离蛋白发生相互作用导致色氨酸和酪氨酸残基微环境亲水性增强。
2.1.2 单宁酸与大豆分离蛋白相互作用的猝灭类型、结合常数及结合位点数
荧光猝灭大致可分为动态猝灭和静态猝灭两类。动态猝灭是指激发态的荧光分子通过与猝灭剂分子的碰撞作用,以能量转移或电荷转移的机制丧失其激发能而返回基态。静态猝灭是指荧光分子与猝灭剂分子形成了不发光的基态复合物。在动态猝灭中,动态猝灭常数会随温度升高而增大;而在静态猝灭中,静态结合常数会随温度升高而减小[11-12]。为了探讨单宁酸对大豆分离蛋白的荧光猝灭类型,假设其荧光猝灭过程为动态猝灭,利用Stern-Volmer方程[13-14],即:
F0/F=1+Kqτ0=1+Ksv[Q]
(1)
式中:F0和F分别为无单宁酸和有单宁酸时大豆分离蛋白的荧光强度;Kq为扩散碰撞猝灭速率常数(该值越大猝灭效应越显著),L/(mol·s);τ0为无单宁酸存在时大豆分离蛋白的荧光寿命(通常生物大分子的荧光平均寿命约为10-8s);Ksv为Stern-Volmer 动态猝灭常数,L/mol;[Q]为猝灭剂单宁酸浓度,mol/L。
以F0/F对[Q]作图,见图2,相关参数如表1所示。

图2 单宁酸对大豆分离蛋白的Stern-Volmer荧光猝灭图

温度/KKsv/(L/mol)Kq/(L/(mol·s))R22932.056×1052.056×10130.971 33131.920×1051.920×10130.986 73331.289×1051.289×10130.999 1
由图2可知,当单宁酸浓度小于等于6×10-6mol/L时,F0/F与[Q]具有良好的线性关系。当单宁酸浓度超过6×10-6mol/L时,F0/F与[Q]曲线向上弯曲,意味着猝灭作用同时存在着静态猝灭和动态猝灭[15]。这可能是因为单宁酸浓度越高,其与大豆分离蛋白碰撞概率越大,将引起部分动态猝灭效应。
由表1可知,当温度为293、313 K和333 K时,单宁酸对大豆分离蛋白的扩散碰撞猝灭速率常数Kq分别为2.056×1013、1.920×1013、1.289×1013L/(mol·s),远大于文献[16]得到的各类猝灭剂对生物大分子的最大扩散碰撞猝灭速率常数2.0×1010L/(mol·s)。此外,随着温度升高,动态猝灭常数Ksv值减少,这一结果与典型的动态猝灭特征相反。因此,可以认为单宁酸浓度在0~6×10-6mol/L范围时,其对大豆分离蛋白的荧光猝灭作用主要以静态猝灭为主。
对于静态猝灭过程,可采用下式计算结合常数和结合位点数[10]:
lg[(F0-F)/F]=lgKa+nlg[Q]
(2)
式中:Ka为结合常数,L/mol;n为结合位点数。
以lg[(F0-F)/F]对lg[Q]作图,由拟合直线的斜率和截距可获得结合位点数及结合常数,相关参数如表2所示。
由表2可知,大豆分离蛋白与单宁酸之间的结合位点数n近似为1,表示大豆分离蛋白与单宁酸形成1∶1复合物。大豆分离蛋白与单宁酸之间的结合常数Ka数量级为106,说明大豆分离蛋白与单宁酸具有较强的结合能力,并且随着温度升高结合常数Ka变大,意味着大豆分离蛋白与单宁酸的结合是吸热过程。

表2 单宁酸与大豆分离蛋白作用的结合位点数、结合常数及热力学参数
2.1.3 单宁酸与大豆分离蛋白的热力学参数和作用力
小分子与蛋白质大分子之间的作用力包括氢键、范德华力、疏水作用力和静电引力等。小分子与蛋白质的相互作用能否自发进行取决于体系的吉布斯自由能(ΔG),ΔG<0时有利于反应自发进行。根据反应体系熵变(ΔS)和焓变(ΔH)可大致确定二者之间的作用力:当ΔH>0、ΔS<0时,分子间作用力主要是静电引力和疏水作用力;当ΔH>0、ΔS>0时,分子间作用力主要是疏水作用力;当ΔH<0、ΔS<0时,分子间作用力主要是范德华力、氢键等作用;当ΔH<0、ΔS>0时,分子间作用力主要是静电引力[17-18]。假设在试验温度范围内焓变的变化较小,则计算公式为:
ln(K2/K1)=-(ΔH/R)(1/T2-1/T1)
(3)
ΔG=-RTlnKa
(4)
ΔS=(ΔH-ΔG)/T
(5)
式中:R为气体状态常数,8.314 J/(K·mol);T为试验温度,K;K代表相应温度下反应体系的结合常数Ka,L/mol。由公式(3)、(4)、(5)计算出的热力学参数见表2。由表2可知,体系ΔH>0,表明大豆分离蛋白与单宁酸之间的相互作用为吸热反应,升温有利于反应的进行,同时这也与结合常数Ka随着温度的升高而增大的结论相吻合。体系ΔG<0,表明大豆分离蛋白与单宁酸的结合是自发进行的。体系ΔH>0和ΔS>0说明大豆分离蛋白与单宁酸之间的作用力主要是疏水作用力。
2.2 单宁酸对于大豆分离蛋白构象的影响
2.2.1 单宁酸与大豆分离蛋白相互作用的同步荧光光谱
普通荧光光谱不能将蛋白质中色氨酸和酪氨酸相互重叠的荧光峰区分,而同步荧光光谱具有灵敏度高和选择性好等优点,通过选择合适的波长差可将色氨酸和酪氨酸残基的荧光峰分开。当波长差为15 nm 时仅表现为酪氨酸残基的荧光,当波长差为60 nm 时则显示色氨酸残基的荧光[19]。同步荧光光谱最大发射波长的变化,亦可反映氨基酸残基所处微环境的变化。固定Δλ为15 nm和Δλ为60 nm,研究不同浓度单宁酸对大豆分离蛋白同步荧光光谱的影响,结果如图3所示。

图3 单宁酸对大豆分离蛋白同步荧光光谱的影响
由图3可知,随着单宁酸浓度的增加,大豆分离蛋白的酪氨酸和色氨酸残基荧光强度均发生明显猝灭作用,并且色氨酸残基的最大发射波长红移幅度(从275 nm红移至288 nm)大于酪氨酸残基红移幅度(从285 nm红移至291 nm),这一现象表明单宁酸对大豆分离蛋白的色氨酸残基微环境影响更为显著[20]。
2.2.2 单宁酸-大豆分离蛋白复合体系的紫外光谱
紫外光谱是表征蛋白质与小分子化合物相互作用的有效方法。不同浓度的单宁酸对于大豆分离蛋白溶液紫外光谱的影响如图4所示。

图4 单宁酸对大豆分离蛋白紫外光谱的影响
由图4可知,大豆分离蛋白在280 nm波长附近存在一个宽吸收峰,被认为是肽链上酪氨酸和色氨酸等芳香杂环的π-π*跃迁引起[21],随着单宁酸浓度增加,该吸收峰强度明显增强。这可能是因为单宁酸的加入导致大豆分离蛋白酪氨酸和色氨酸残基趋向于暴露水相(前文荧光光谱结果),导致吸收峰增强。此外,单宁酸自身具有芳香性,其与大豆分离蛋白形成复合物后有利于π电子的传递。
2.2.3 圆二色谱分析
蛋白质二级结构主要包括α-螺旋、β-折叠、β-转角和无规卷曲。远紫外区域圆二色谱可定量分析蛋白质溶液中各类型二级结构的相对含量,单宁酸对大豆分离蛋白圆二色谱的影响如图5所示,经CDPro软件计算得到的α-螺旋、β-折叠、β-转角和无规卷曲结构的相对含量如表3所示。
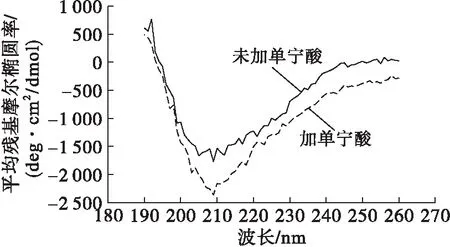
图5 单宁酸对大豆分离蛋白圆二色谱的影响

样品α-螺旋β-折叠β-转角无规卷曲大豆分离蛋白4.242.021.432.2单宁酸-大豆分离蛋白4.841.822.031.5
由图5和表3可知,大豆分离蛋白的二级结构中主要以β-折叠为主,在测试范围内,单宁酸对大豆分离蛋白的二级结构有轻微的影响,但并无显著性差异。薛燕斌等[22]研究表明高良姜素可以与人血清白蛋白相互作用,但对其二级结构的影响较小;Cheng等[23]研究表明顺、反式白藜芦醇对α-乳白蛋白、β-乳球蛋白及牛血清白蛋白的二级结构均没有显著影响。
3 结 论
单宁酸对大豆分离蛋白的内源荧光有较强的猝灭作用,在低浓度范围时,猝灭类型以静态猝灭为主,在高浓度范围时,同时存在静态猝灭和动态猝灭。通过疏水作用,单宁酸与大豆分离蛋白相互作用,并且导致大豆分离蛋白分子链舒展,分子中色氨酸、酪氨酸残基微环境亲水性增强。
