复合手术室智能移动三维导航技术在近肾型腹主动脉瘤腔内治疗中的应用效果评价
2019-11-19黄文诺张喜成吕朋华叶靖王书祥孙陵陈兆雷孙元徐淼王福安徐川
黄文诺 张喜成 吕朋华叶靖 王书祥 孙陵陈兆雷 孙元徐淼王福安 徐川
经典血管腔内腹主动脉瘤修复术(endovascular aneurysm repair,EVAR)要求瘤颈1.5 cm以上。随着介入技术的进步及器械的发展,累及肾动脉的腹主动脉瘤(abdominal aortic aneurysm,AAA)也可以通过开窗、烟囱等技术进行腔内治疗。累及肾动脉的AAA位置特殊,EVAR术中肾动脉的重建是手术能否成功的关键,采用数字减影血管造影二维成像(2D-DSA)引导超选肾动脉,当超选困难及释放支架时常需变换角度,需要术中反复多次造影确认,此时准确的肾动脉及分支血管开口实时显示对术者尤为重要,但2D-DSA不能达到此要求。我院自2015年引进智能移动介入机器人GE IGS730 DSA,利用术中数字减影血管造影三维成像(3D-DSA)导航技术,在三维空间实时显示重要脏器的血管开口,指导治疗7例近肾型AAA,明显弥补了2DDSA的不足,效果较好,报告如下。
资料与方法
一、一般资料
选取2015年2月至2017年12月在我院复合手术室行近肾型AAA瘤腔内治疗的患者7例,其中男 5 例,女 2 例;年龄 32~77(56.6±11.2)岁。其中5例因发现腹部搏动性包块就诊,2例为体检发现。所有患者术前均行胸腹部CT血管造影(CTA)检查,4例累及单肾动脉,2例累及双肾动脉,1例累及副肾动脉。瘤体直径5.2~7.8 cm。本研究通过苏北人民医院伦理委员会批准。
二、设备
采用智能移动介入机器人系统GE IGS730 DSA,3D图像自动传输至AW 4.7后处理工作站,选取阈值获取3D-DSA容积成像(VR)、梯度成像(GR)和最大密度投影(MIP)重建图像。
三、术前准备
术前与患者家属就手术风险进行充分沟通,评估脏器功能,高血压者控制收缩压在140 mmHg(1 mmHg=0.133 kPa)以内。术前经Endosize软件评估腹主动脉情况,包括瘤颈长度、直径及其与主动脉分叉的距离,内脏各分支动脉距离及直径,髂内动脉开口位置等各项指标。备好各种腔内治疗器材,对需要预开窗或分支支架的患者,根据测量结果对覆膜支架进行释放前相应改制处理,即做好支架预开窗及预缝分支覆膜支架,并将覆膜支架束径后重新装回输送器内。
四、术中3D-DSA采集
患者全身麻醉后,在GE IGS 730 DSA手术平台常规穿刺后,将导管置于腹主动脉,3D-DSA造影参数:腹主动脉 15~18 ml/s,总量 90~108 ml。3D 采集范围 RAO108°-LAO96°,速度 40°/s,采集帧数294幅。
五、手术方法
常规穿刺双侧股动脉后,每侧使用预置两把Proglide血管缝合器,经股动脉插管行腹主动脉造影,确定内脏动脉分支及双侧髂内动脉开口位置。于左侧肱动脉切开置鞘,置入导管导丝供超选内脏动脉使用。
利用三维导航技术将腹主动脉瘤的三维图像与实时透视图像叠加融合。在三维图像的导引下,协助导丝导管定位超选入靶血管中,对采用烟囱技术的患者,将肱动脉入路导丝导管选入并预置在肾动脉内。对于采用开窗或分支支架的患者,则送入备好的覆膜支架系统(Ankura覆膜支架,深圳先健科技公司;Endurant覆膜支架,美国美敦力公司)。送入预定位置后,将覆膜支架主体部分释放,在3D导航指引下,经肱动脉入路的导丝导管从窗口或分支支架内送入分支动脉内。再先后释放主体及分支支架,补充髂腿支架。完成EVAR后,即刻行主动脉造影,评价支架植入效果。
结 果
7例患者术中在3D图像导航下,导丝导管均成功导入靶血管内,单根靶血管导入时间3~22 min,造影剂用量150~180 ml。7例EVAR均手术成功,术后即刻造影提示分支血管显影通畅,无内漏(图1、2)。术后6、12个月及以后每年复查CTA,均提示支架在位,1例术后6个月复查显示轻度2型内漏,但瘤径并无增加,继续随访中。
讨 论
目前治疗AAA的主要手术方式有开放手术和EVAR,与创伤巨大的开放手术相比,EVAR具有创伤小、恢复快、安全性高等优点,已成为AAA的一线治疗方法[1]。近肾型AAA因锚定区常累及肾动脉、肠系膜上动脉等重要脏器血管分支,给EVAR技术带来挑战。目前,随着介入技术的进步及器具的革新,采用烟囱、开窗及分支支架技术进行腔内治疗近肾动脉瘤已逐步开展[2],其中精准的分支血管开口定位是治疗成功的关键。
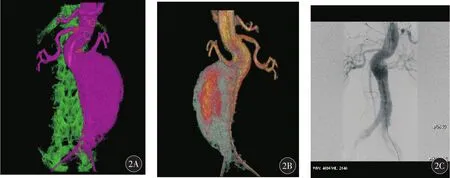
图2 典型病例2(女性,75岁,近肾腹主动脉瘤)行腹主动脉支架+左肾动脉支架释放前后造影图
近肾型腹主动脉瘤的腔内治疗需要术前精准的测量和设计,术中定位内脏动脉开口并顺利导入导丝导管是治疗成功的前提。腹主动脉瘤解剖成像采用了多种成像方式,包括超声、CT和MRI[3],其中MRI和CT更多用于准确诊断和术前评估。EVAR的传统适应证要求瘤颈要有足够的长度,又不能过度扭曲。随着技术的进步,许多解剖条件不良的腹主动脉瘤行EVAR治疗也获得良好的疗效[4],近年发展起来的影像融合技术为复杂型腹主动脉瘤的腔内治疗提供了良好的硬件条件。
多模态影像融合技术是建立在2个或多个来源影像信息融合的基础上,获得对同一影像更为准确、全面、可靠的图像描述。目前常用术前CTA或三维血管造影图像导入血管造影系统的坐标空间,与术中2D-DSA二维图像透视合并,对于常规主干支架的导航和置入,术前CTA的融合导航技术可以满足临床需要[5],但对于近肾型腹主动脉瘤,受患者体位及硬性材料进入引起的血管变形等影响,CTA融合影像的肾动脉开口定位对于指导支架准确释放存在一定的局限性[6]。
在影像融合中,易引起整体配准误差的因素有3个:患者运动、刚性血管移位和血管变形。首先,术前CTA一般采用双臂上位,EVAR一般采用双臂下位;其次,由于腹部器官的可变形性,术前CTA与术中X线图像之间可能存在血管结构弹性变形;最后,EVAR过程中导丝或导引导管进入髂动脉,使得髂动脉发生明显变形,引起腹主动脉运动导致血管开口位置发生变化,使二维/三维定位难以完全对合[7]。因此,自动的二维/三维图像配准可以在图像引导工作流中提供无缝集成的图像融合,在3D图像之间找到最佳匹配工作角度,允许术者不断看到从3D-DSA中提取出来的腹主动脉及内脏血管开口的详细解剖结构,从而利于EVAR实施,减少手术时间和造影剂使用剂量[8]。
本研究中的7例腹主动脉配准分两个步骤进行:①利用脊柱作为可靠的三维约束,实现腹主动脉(目标器官)的精确定位。②针对腹主动脉的解剖,进一步采用分层配准的方法。特别是将三维图像分为肾动脉、髂动脉和腹主动脉3个部分。将分段刚体变换单独应用于这3个部分,对3个部分的完整图形进行局部变形估计,保持它们的连接性,为EVAR提供精准影像导航[9]。
内漏是EVAR最常见的并发症,腹主动脉瘤患者的血管条件、术前及术中测量误差、手术操作失误均是导致内漏的主要原因。研究表明在硬材料插入腹主动脉分支后,血管会有明显移位[10-11]。笔者的经验是:腹主动脉的变形主要是植入器械引起的弯曲,但变形后血管长度基本保持不变,可以根据手术需要,对兴趣区进行调整,而不必在意全程血管的一致性[12]。笔者还采用了一种新的工作流程:骨盆上边界自动检测方法。将检测到的骨盆上边界在支架置入过程中叠加到透视图像上,在血管三维图上,保持配准时相邻两点之间的距离一致,通过实时的骨盆骨外线叠加,可以立即观察患者的运动情况,如果观察到患者的运动情况,可以在EVAR过程中触发腹主动脉的二维/三维自动再注册,以弥补这一缺陷。3D-DSA与常规CTA三维导航相比,有如下优势:①复杂腹主动脉解剖结构可视化;②准确的肾动脉开口解剖定位;③术前模拟手术过程,尤其是对于血管迂曲者更具有意义。
在目前临床运用的影像融合技术中,3D-DSA融合导航也存在一些不足:二维/三维配准涉及多个校准的二维成像平面;许多情况下,用一个二维图像覆盖三维体的投影并不能保证这一点所有三维空间要素与患者准确叠加。因此,随着未来融合技术更加完善,使得在术前预判可能出现的状况,以更安全、快捷、有效的技术来帮助制定手术方案,指导手术精准实施。
