多年生牧草种植对苹果园土壤真菌群落特征的影响
2019-11-18钱雅丽王先之来兴发李峻成沈禹颖
钱雅丽,王先之,来兴发,李峻成,沈禹颖*
(1.兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020;2.草业科学国家级实验教学示范中心,甘肃 兰州 730020)
陇东黄土高原是我国苹果(Malusdomestica)种植的优势区域之一[1]。传统果园通常采用清耕的管理方式,长期清耕会造成土壤板结、微生物多样性衰减[2]、苹果产量下降和果品质量变差等问题[3],给该地区苹果园的健康、可持续发展提出了严峻挑战。果园生草覆盖是一种有效的土壤管理制度[4],具有改善土壤养分、减轻病虫危害和提高土壤微生物多样性等功能[5]。有研究表明,苹果园生草能提高土壤水解氮、速效磷、速效钾的含量,有利于苹果对营养元素的吸收,且种植豆科牧草后土壤有机质的提升效果要强于禾本科牧草[6]。
土壤真菌作为土壤微生物的重要组分,能够参与有机物质分解与合成[7],与土传病害、植物互作等亦有密不可分的关系[8-9]。孙计平等[10]研究生草梨(Pyrusspp.)园的结果表明,长期生草能提高表层土壤真菌数量。陈月星等[11]在苹果园进行的生草试验也有类似结论。不同草种释放的根系分泌物不同,会影响土壤微生物群落生长代谢和群落结构[12]。因此,不同生草类型可以通过土壤微生物群落组成和结构的变化进而影响土壤微生物栖息环境[13-14]。前人对苹果园不同植被条件下土壤酶活性以及真菌数量等方面已经开展了研究工作[15-16],而关于生草苹果园土壤真菌群落结构的研究报道尚少,且这些研究多采用传统的平板培养计数法和稀释平板法等,不能准确地反映自然田间状态下土壤真菌群落的组成和特异性[17]。明晰生草后土壤真菌群落变化特征,对土壤微环境调节的深入揭示具有重要理论意义。为此,本研究采用高通量测序法,以黄土高原区苹果园为研究对象,研究鸭茅(Dactylisglomerata)、白三叶(Trifoliumrepens)和紫花苜蓿(Medicagosativa)3种生草模式以及清耕处理下0~10 cm土层土壤真菌群落组成和多样性特征,以探明苹果园生草后土壤真菌群落组成变化及特异菌属组成。研究结果在理论上有助于从分子角度揭示种植不同牧草后对土壤真菌群落特征的影响,在实践上可为果园生草草种选择提供一定指导意义。
1 材料与方法
1.1 试验地概况
本试验在庆阳市西峰区什社乡境内的甘肃省庆阳草地农业研究观测站(N 35°39′-E 107°51′,海拔1297 m)内进行。年均降水量为564 mm(1970-2015年),年降水总量的70%主要集中在6-9月。年均气温9.2 ℃,年极端最高、最低气温分别为39.6、-22.4 ℃,>5 ℃的年平均积温3446 ℃。生长期255 d。试验地土壤类型为黑垆土,质地为粉壤土,其0~10 cm基况为:土壤有机质16.2 g·kg-1,全氮1.2 mg·g-1,pH值8.1,土壤容重1.4 g·cm-3。
1.2 试验设计
试验采取随机区组排列,以试验站内13龄秦冠苹果园(行距4 m,株距4 m)为试验区进行生草试验。于2014年4月分别在试验区建植多年生牧草鸭茅、白三叶和紫花苜蓿,采用单播的方法,播量均为15 kg·hm-2,以清耕(CK)为对照。每处理3个重复,共12个小区,小区面积为30.0 m×2.6 m。生草区均为行间生草,行内清耕,生草带距树干距离为0.7 m。每年5、7和9月对小区进行刈割管理,并定期除杂。
1.3 样品采集与处理
取样时间为2015年9月24日,每小区“S”型5点取样,去除表层凋落物后,用φ=40 mm土钻采集0~10 cm土层土壤,混匀,去除植物残体和石砾等杂质,共计12个样。每次取样前后对土钻均用75%的酒精进行消毒,防止样品被污染。所取样品均被放入灭菌袋用冰盒带回实验室,于-80 ℃冰箱中保存,供土壤微生物DNA提取及后续测定。
1.4 土壤微生物总DNA提取及ITS rRNA基因高通量测序
土壤真菌ITS rRNA的测定工作由北京安诺优达基因科技有限公司进行。采用FastDNA®SPIN Kit for Soil (MP Biomedicals)试剂盒提取,对提取到的基因组DNA进行1.0%的琼脂糖电泳检测DNA样品是否有降解以及杂质存在;用NanoPhotometer分光光度计检测样品纯度;Qubit2.0 Flurometer检测DNA样品浓度,取适量的样品于离心管中,用无菌水稀释样品至1 ng·μL-1。选择V3+V4区,以稀释的基因组DNA为模板,使用341F(5′-CCTACGGGNGGCWGCA-3′)-805R(5′-GACTACHVGGGTATCTAATCC-3′)扩增引物进行PCR,确保扩增效率和准确性。PCR扩增条件为:95 ℃,3 min;(95 ℃,30 s;55 ℃,30 s;72 ℃,30 s)25个循环;16 ℃ 10 min。每个样品3个重复。获得PCR扩增产物后,通过2.0%琼脂糖凝胶电泳检测产物纯化浓度。将土壤样品16S rRNA基因的PCR纯化产物等摩尔数混合,利用Thermo Scientific公司的GeneJET胶回收试剂盒。使用New England Biolabs公司的NEB Next UltraDNA Library Prep Kit for Illumina (NEB,USA)试剂盒进行文库构建,构建好的文库经过Qubit@2.0荧光计(Life Technologies,CA,USA)和安捷伦科技公司生物分析仪2100系统定量和文库检测合格后,进行上机测序,测序平台为IlluminaHiseq PE250,每个样品3个重复。然后对所有样品的全部序列进行聚类,以97%的相似度将序列聚类成分类操作单元 (operational taxonomic units, OTUs),然后对OTUs的代表序列进行物种注释,在Unite库比对,得到OTUs的分类学信息。
1.5 数据分析
使用QIIME软件(1.8.0版)分析数据,得出土壤真菌Alpha多样性指数(Shannon和Simpson)、菌群丰富度指数(Chao1和Observed_species)。Beta多样性中样本间距离采用Unifrac方法计算。采用Excel 2007进行数据分析及制图,采用SPSS 19.0软件对土壤真菌门、属水平不同生草模式下真菌相对丰度进行单因素方差分析,使用Duncan法进行多重比较。
2 结果与分析
2.1 土壤真菌OTUs水平分析
对真菌ITS区进行测序分析,过滤去除原始数据中的低质量序列后,获得的原始读数为214944条,其中高质量序列所占比例大于70%,说明测序质量很好(表1)。在相似度大于97%分类水平下将其聚类为用于物种分类的OTUs,12个样品共产生2381个OTUs。由表1可知,紫花苜蓿处理下土壤真菌OTUs数最多,其次是白三叶处理,鸭茅处理最少。与对照相比,建植紫花苜蓿后土壤真菌OTUs数量增加了17.11%,建植鸭茅后则减少了1.60%。
2.2 土壤真菌群落Alpha多样性

表1 不同生草模式下土壤真菌读数(Reads)及OTUs数Table 1 Sequence readings and OTUs of soil fungi under different grass planting patterns
注:CK为未种植生草处理。下同。
Note: CK is unplanted grass treatment. The same below.
紫花苜蓿生草处理下土壤真菌群落Shannon指数最高,比对照提高27.02%,Simpson指数也最高,因此其真菌多样性(Shannon)在4个处理中最高,为4.09(表2)。其后依次为白三叶>鸭茅>CK;表明苹果园生草能够提高土壤真菌多样性。4个处理中紫花苜蓿下土壤真菌丰富度(Chao1和Observed_species)最高,为216.15和159.66;与紫花苜蓿处理相比,鸭茅处理丰富度指数降低14.77%和12.47%。
2.3 土壤真菌群落Beta多样性
样本间距离是指样本之间的相似程度,可以通过数学方法估算。样本间越相似,距离数值越小,0表示两个微生物群落间OTUs的种类一致,其余数字越接近于1表示处理间群落差异越大。鸭茅、白三叶和紫花苜蓿生草处理与清耕处理相比样本间距离均大于0.42,大于生草处理间样本距离,说明3个生草处理与清耕处理群落有明显差异。样本间距离在紫花苜蓿处理与清耕处理间越大,说明两者间群落差异更明显(图1)。
2.4 不同分类水平下土壤真菌群落组成
本研究中苹果园4个模式下OTUs的分类结果表明,土壤真菌群落隶属于4门12纲24目24科22属。在门水平土壤真菌主要门类为子囊菌门(Ascomycota)、接合菌门(Zygomycota)、 担子菌门(Basidiomycota)和球囊菌门(Glomeromycota),还有部分未能分类的真菌(图2)。其中,子囊菌门的相对丰度最高,占所有真菌门类的32%~42%。鸭茅、白三叶和紫花苜蓿3个处理中优势菌群均为子囊菌门(42.58%、37.67%和32.33%)和接合菌门(10.02%、9.13%和7.67%)。不同生草模式之间土壤真菌门类相对丰度有差异(图2),种植鸭茅、白三叶和紫花苜蓿土壤中接合菌门相对丰度比对照增加196.15%、169.82%和126.92%。而担子菌门相对丰度则减少68.75%、25.00%和55.00%(P<0.05)。鸭茅、白三叶和紫花苜蓿3个处理中球囊菌门相对丰度均高于对照,但差异不显著。
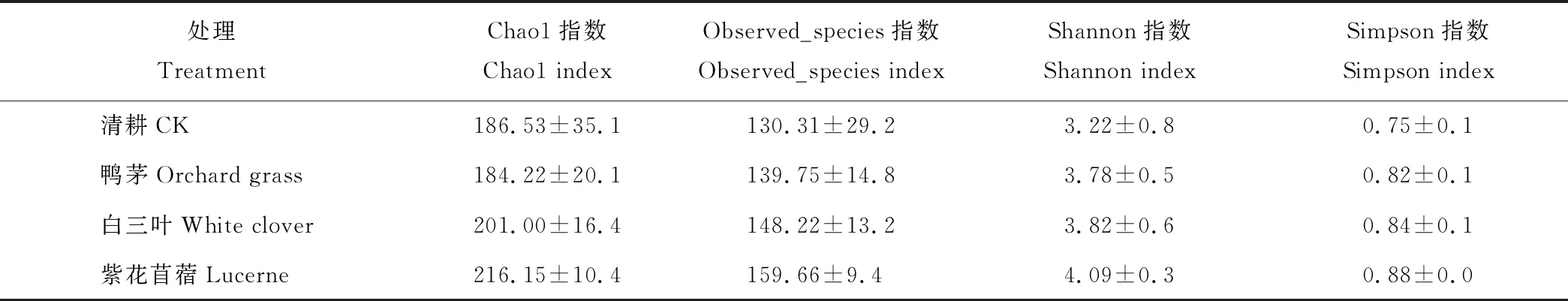
表2 不同生草模式下土壤真菌Alpha多样性Table 2 Alpha diversity of soil fungal communities under different grass planting patterns

图1 不同生草模式下土壤真菌Unweighted UniFrac距离矩阵Fig.1 Unweighted UniFrac distance matrix diagram of soil fungi under different grass planting patternsQG(CK): 清耕 Clean tillage; YM: 鸭茅 Orchard grass; SYC: 白三叶 White clover; MX: 紫花苜蓿 Lucerne. 下同 The same below.

图2 不同生草模式下土壤在门水平上的真菌群落组成Fig.2 Composition of soil fungi community at phylum level under different grass planting patterns Ascomycota:子囊菌门;Zygomycota:接合菌门;Basidiomycota:担子菌门;Glomeromycota:球囊菌门。不同小写字母代表在不同生草模式下土壤真菌相对丰度间差异显著(P<0.05)。下同。Different lowercase letters represent significant differences of soil fungi relative abundances among different grass planting patterns (P<0.05). The same below.
在属的分类水平,全部真菌序列至少有22个属,主要包括:Gloeotinia、镰孢霉属(Fusarium)、被孢霉属(Mortierella)、茎点霉属(Phoma)、毛壳菌属(Chaetomium)、Mrakia、内养囊霉属(Entrophospora)、漆斑菌属(Myrothecium)、Bionectria、Microdochium、周刺座霉属(Volutella)、Geomyces、Ilyonectria、轮枝菌属(Verticillium)、Stephanonectria、Tetracladium、Neonectria、Haematonectria、赤霉菌属(Gibberella)、Hanseniaspora、Metarhizium和Dactylella等。22个属中有11个的相对丰度≥0.02%(图3)。4个处理下土壤各真菌属所占相对丰度大小存在差异,其中镰孢霉属相对丰度在生草处理均高于对照,且鸭茅和紫花苜蓿与对照相比差异显著(P<0.05);而3个生草处理下被孢霉属相对丰度均低于对照,且白三叶和紫花苜蓿与对照相比差异显著(P<0.05)。内养囊霉属在鸭茅处理下相对丰度显著高于白三叶和紫花苜蓿处理(P<0.05);茎点霉属在白三叶处理中相对丰度较高且与对照相比差异显著(P<0.05);紫花苜蓿处理中Ilyonectria菌属相对丰度显著高于其他3个处理(P<0.05)。
2.5 土壤真菌特异菌属组成

图4 不同生草模式下土壤真菌Venn图Fig.4 Venn diagram of soil fungi under different grass planting patterns
清耕(对照)、鸭茅、白三叶和紫花苜蓿4个处理下土壤真菌群落组成分布特征如图4,4个处理共同拥有190个相同的OTUs,特有的OTUs数分别为34、24、27和43,白三叶和紫花苜蓿处理比鸭茅处理分别增多12.5%和79.17%。白三叶和紫花苜蓿生草下共同含有的OTUs数为248个,高于其他两两处理共同含有OTUs数,说明白三叶和紫花苜蓿处理下真菌群落相似度高。经筛选比对发现,对照的特异菌属主要有节丛孢属(Arthrobotrys)、隐球菌属(Cryptococcus)、拟青霉属(Paecilomyces)和弯孢聚壳属(Eutypella)等;鸭茅处理特异菌属为嗜热真菌属(Thermomyces)、单端孢霉属(Trichothecium)和火菇属(Flammulina)等;白三叶处理的特异菌属主要有葡萄穗霉属(Stachybotrys)、放射毛霉属(Actinomucor)、Rhizopycnis属、Wickerhamomyces属、白僵菌属(Beauveria)、核瑚菌属(Typhula)和刺盘孢属(Colletotrichum)等;紫花苜蓿种植下特异菌属主要有支顶孢属(Acremonium)、枝孢属(Cladosporium)、壳色单隔孢属(Diplodia)、葡萄座腔菌属(Botryosphaeria)和多孢菌属(Pleospora)等。
3 讨论
3.1 不同生草模式下土壤真菌群落多样性
土壤微生物群落结构越丰富,物种越均匀,多样性越高时,对抗病原菌的综合能力就越强[18],研究表明,单一作物中加入草会对土壤真菌多样性有所影响[19]。本研究结果表明,建植紫花苜蓿的土壤真菌丰富度和多样性在4个处理中最高,种植紫花苜蓿有利于土壤真菌的生长和繁殖,这与土壤真菌丰度提高结果相符[20]。这是由于紫花苜蓿有益于土壤肥力和有机碳含量的提高、增强微生物活性,从而提高土壤真菌丰富度[21]。3个生草处理的多样性均高于对照,紫花苜蓿真菌多样性最高,这与苹果园生草后能够有效减少土壤蒸发,稳定土壤温度,有利于真菌的生长有关[22]。同时紫花苜蓿的根系属于直根系,向土壤中深入,其穿透活动可以疏松土壤,将地下残根和地面枯枝落叶经过腐解后形成腐殖质[23],更有利于土壤有机质累积,对土壤真菌多样性的提升作用也更明显[24]。3个生草处理与清耕处理相比,群落差异明显,但在3个生草处理间群落差异不明显。可见,地上植被加入和物种多样性的增加可以稳定和增加土壤微生物群落结构[25],这与Gelsomino等[26]的研究结果一致。
3.2 不同生草模式下土壤真菌群落组成分析
不同作物种植类型对土壤真菌群落组成会造成影响[27]。本研究中,在门水平上,清耕、鸭茅、白三叶和紫花苜蓿处理土壤真菌群落隶属于子囊菌门、接合菌门、担子菌门和球囊菌门4个菌门,这与肖礼等[28]对黄土高原梯田种植类型土壤真菌群落组成的研究一致。苹果园生草后土壤真菌接合菌门相对丰度增加,说明生草会影响土壤接合菌门相对丰度,这是由于苹果园生草后产生的枯落物和根系,会转化为腐殖质,提供碳源以增加土壤有机碳[29],而接合菌门大多是腐生菌,能很好地利用腐生环境[30],适宜生存在生草果园。苹果园生草后土壤真菌担子菌门相对丰度较清耕处理降低,这是由于果园生草后会降低土壤pH[31],提供的酸性环境对担子菌门生长不利[32]。
本试验中苹果园生草后镰孢霉属相对丰度显著增加,镰孢霉属通常在土壤里营腐生性生活[33],它的许多镰刀菌是昆虫的病原真菌,与控制害虫虫口密度、生物防治有一定关联[34],这与生草果园能够为天敌活动提供适宜生长环境,从而减轻病虫害[35]的结论一致。茎点霉属是多分布在豆科牧草中的一种植物病原菌[36],其次生代谢产物可能对病原菌和害虫危害有一定的抑制和防治作用[37]。茎点霉属相对丰度在白三叶和紫花苜蓿处理中较高,认为这可能是紫花苜蓿与果树没有共生病虫害,且能为病虫害天敌提供寄宿环境[38]。Ilyonectria属广泛分布在草本植物的根内以及土壤中,为植物病原菌,可能会引起植物根腐病和黑腐病等[39],这类菌属在建植紫花苜蓿的土壤中表现出较高丰度。
3.3 不同生草模式下土壤真菌特异菌组成
经筛选比对发现,4个处理均有各自特异菌属存在。节丛孢属出现在清耕土壤中,节丛孢属最佳生长条件为pH 6.0~6.5,温度20~25 ℃[40],多生长在土壤、腐烂的树叶枝条等处,与动物线虫的防治有密切联系[41]。嗜热真菌属是建植鸭茅后出现的特异菌属,其具有的高活力和热稳定性的纤维素酶、蛋白酶等[42],对降解高分子多糖和蛋白质具有促进作用[43]。苹果园建植白三叶后在其土壤中发现葡萄穗霉属、放射毛霉属和刺盘孢属,葡萄穗霉属和放射毛霉属分泌的植物组织分解酶类均能分解植物中纤维素和半纤维素,转化成各种糖类,有利于植物对原料的利用及微生物的生长[44-46]。刺盘孢属又名炭疽菌属,是一种豆科植物的病原真菌,能够引起豆科植物的炭疽病[47]。支顶孢属、枝孢属、壳色单隔孢属和葡萄座腔菌属是紫花苜蓿生草处理下的特异菌属,支顶孢属又称为顶孢属,是一类很重要的抗生素产生菌,对植物致病真菌有明显的抗性作用[48],而枝孢属和葡萄座腔菌属均为植物病原菌,可能会引发植物病害[49],从而影响到果树生长、果实产量和品质[50]。这几种特异菌属与土壤真菌生长的关系,对于土壤病虫害防治的作用等还需要通过进一步的病虫害,果品鉴定和果实产量等试验研究证明。
4 结论
本研究采用高通量测序技术研究了黄土高原苹果园不同生草模式下土壤真菌群落特征。结果显示,苹果园种植鸭茅、白三叶和紫花苜蓿后会提高土壤真菌多样性和丰富度。3个生草处理土壤真菌群落与清耕相比有明显差异。土壤真菌优势菌门为子囊菌门和接合菌门;主要菌属为Gloeotinia属、镰孢霉属和被孢霉属。生草后土壤中均发现真菌特异菌属,鸭茅处理下为嗜热真菌属;白三叶处理下出现葡萄穗霉属和放射毛霉属;紫花苜蓿处理下为支顶孢属。4个处理下土壤真菌群落组成相似,但在生草处理下土壤真菌有益菌属、特异菌属相对丰度增加。
