高寒草甸嵩草、珠芽蓼根际优良植物根际促生菌的分离筛选及促生特性研究
2019-11-18高亚敏姚拓李海云罗慧琴张建贵杨琰珊刘婷
高亚敏,姚拓,李海云,罗慧琴,张建贵,杨琰珊,刘婷
(甘肃农业大学草业学院,草业生态系统教育部重点实验室, 甘肃 兰州 730070)
我国过量施用化肥和农药致使农业生态环境(土壤、水源和空气等)严重污染。近年来,生物肥料以其高效、环保、绿色、无污染、无毒害等特性倍受国内外学者关注,其中,植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)菌剂研发是关注热点[1-6]。PGPR来源多样,在农田、草地、沙地和森林等研究中均有报道,研究发现不同生境中PGPR菌株促生特性和适应性均存在差异[7],且对宿主植株和非宿主植物的促生效果各异。近年来,关于PGPR的作用机理、促生效果、菌株特性(溶磷、固氮、分泌植物激素)等方面,已从不同角度做了大量研究[6-14]:发现PGPR能够通过分泌有机酸、酶和植物激素(plant hormones,PHs)来改变根际土壤微环境及养分含量,影响植株的生长和产量,如在不影响作物产量的情况可替代15%~30%的化肥[1-4];PHs是植物—微生物互作的信使[6],细菌产生的吲哚乙酸(indole-3-acetic acid,IAA)、赤霉素(gibberellin,GA3)和反式玉米素(trans-zeatin,t-Z)分别促进侧根、不定根和初生根的形成和伸长[8-11]。研究表明欧文氏菌属(Erwinia)、沙雷菌属(Serratia)、黄杆菌属(Flavobacterium)、肠杆菌属(Enterbacter)、四联球菌(Micrococcus)[12-14];圆褐固氮菌(Azotobacter)、温氏氮单胞菌(Azomonaswinogradsky)、拜叶林克氏菌属(Beijerinckia)[15];土壤杆菌属(Agrobacterium)、固氮螺菌属(Azospirillum);不动细菌属(Acinetobacter)、赖氨酸芽胞杆菌(Lysinibacillus);杆菌(Bacillus);假单胞菌(Pseudomonas)[9]等菌属的PGPR可以溶磷固氮和产IAA、GA3、t-Z。然而,大量文献表明对菌种特性和适应性及菌肥施用方式的前期研究(PGPR来源地、自然状态PGPR根际分布规律)依旧不够重视,尤其缺少对青藏高原高寒草甸(alpine meadow)的相关研究。鉴于此,本研究从高寒草甸优势植株[嵩草(Kobresiamyosuroides)和珠芽蓼(Polygonumviviparum)]根际分离PGPR,并研究其分布规律和促生特性(溶磷、固氮、分泌植物激素),为退化天然高寒草甸生物学修复和复合生物菌肥的研发提供菌种资源和科学依据。
1 材料与方法
1.1 试验材料
2015年6月在天祝高山草原试验站(37°40′ N,102°32′ E,海拔2960 m)用5点取样法采集嵩草和珠芽蓼植株。剪去植物地上部分后,离植株5 cm处用灭菌铁锹取土和根系(长×宽×高=10 cm×10 cm×25 cm),装入自封袋低温保存,并迅速带回实验室,24 h内分离细菌。
1.2 培养基
牛肉膏蛋白胨培养基(NA)、金氏培养基(KB)、Pikovaskaia′s培养基(PKO)、蒙金娜培养基、无氮培养基(NFM)和溶菌肉汤培养基(LB)[20-22]。NA培养基:牛肉膏 3.00 g、蛋白胨 10.00 g、NaCl 5.00 g、琼脂 18.00 g、H2O 1000.00 mL,pH=7.2~7.4。KB培养基:蛋白胨 20.00 g、KH2PO41.50 g、MgSO41.50 g、琼脂 18.00 g、H2O 1000.00 mL,pH=7.0~7.4。PKO培养基:Ca3(PO4)25.00 g、蔗糖10.00 g、(NH4)2SO40.50 g、MgSO4·7H2O 0.10 g、NaCl 0.20 g、KCl 0.20 g、MnSO4·4H2O 0.002 g、FeSO4·7H2O 0.002 g、酵母膏 0.50 g、琼脂 18.00 g、H2O 1000.00 mL,pH=6.8~7.2。蒙金娜培养基:CaCO35.00 g、蔗糖 10.00 g、(NH4)2SO40.50 g、卵磷脂 0.20 g、NaCl 0.30 g、KCl 0.30 g、MnSO4·4H2O 0.03 g、FeSO4·7H2O 0.03 g、酵母膏 0.40 g、琼脂 18.00 g、H2O 1000.00 mL,pH=7.0~7.5。NFM培养基:苹果酸 5.00 g、KOH 4.50 g、K2HPO40.50 g、CaCl2·2H2O 0.02 g、NaCl 0.10 g、K2MnO4·2H2O 0.002 g、FeSO4·7H2O 0.002 g、生物素 10.00 μg、5%溴麝香草酚蓝 5.00 mL、琼脂 15.00~20.00 g,pH=7.0。LB固体培养基:胰酪蛋白胨 10.00 g、酵母膏 5.00 g、NaCl 10.00 g、琼脂 20.00 g、H2O 1000.00 mL,pH=7.0。
1.3 植物根际细菌分离与纯化
用平板涂布法[20]在NA和KB培养基上分离根表土壤(soil adhering to roots,RS)、根系表面(rhizoplan or surface of roots,RP)和根内(histoplan or interior of roots,HP)的细菌。方法如下:超净工作台中抖落根系根际以外的土后,称0.5 g根系放入4.5 mL灭菌生理盐水(0.85%)中,在4 ℃离心2 min (1000 r·min-1),上清液即根表土10-1稀释液;离心后的根系放入离心管并加2~3粒无菌玻璃珠和4.5 mL无菌生理盐水,方法同上离心,上清液为10-1根表菌液;石蜡将上述根系两端密封,用0.1% HgCl2灭菌1 min,无菌水冲洗,再用75%酒精灭菌2 min,无菌水冲洗4~5次,吸干表面水分,剪去石蜡,称取根系1 g,研磨,加入9 mL生理盐水并离心5 min (1000 r·min-1),上清液为10-1根内组织梯度悬液。并按稀释梯度法制备10-2、10-3、10-4梯度的根表土壤、根系表面和根内含菌悬液。用平板涂布法将制备好的各梯度稀释液分别接种到NA和KB培养基中,每个梯度重复3次,28 ℃培养箱中培养3 d,筛选生长快速的菌落,并用交叉划线进行纯化,获得纯菌株。点接法将上述筛选株菌分别接种于NFM、PKO、蒙金娜培养基中,置于28 ℃培养箱中培养3 d,挑取NFM培养基中生长较快、菌落形态较大的不同单菌落,即为固氮菌株;挑取PKO和蒙金娜培养基中具有溶磷圈的菌落即为溶磷菌。将其保存于4 ℃备用。
1.4 菌株促生特效测定
用溶磷圈法[23]定性测定溶磷特性。用游标卡尺测量1.3中培养7 d的溶磷菌的溶磷圈直径(diameter of phosphate dissolving ring, D)与菌落直径(diameter of colony, d)。用钼蓝比色法[24]定量测定,在无菌条件下,将1.3选出的溶磷菌株分别接种在50 mL PKO和蒙金娜液体培养基中,每株菌重复3次,以不接菌的培养基为对照。并在28 ℃、180 r·min-1的摇床上培养12 d。用紫外可见光分光光度计测定OD700并计算溶磷量,计算公式如下:

式中:P表示显色液的溶磷量(μg·mL-1);V表示显色液的体积(mL);Ts表示分取倍数;V0表示发酵液的体积(mL)。
固氮特性测定:采用乙炔还原法测定菌株固氮酶活性[25]。挑取一环固氮菌接种于西林瓶中(5.0 mL NFM半固体培养基)并用棉花塞密封,每株菌重复3次,以不接菌培养基为对照,28 ℃恒温培养2 d。在无菌操作台中迅速将棉花塞换为橡胶塞;用1.0 mL医用无菌注射器抽出1.0 mL混合空气,并加入等量的C2H2气体,蜡质封口膜密封;28 ℃的培养箱中培养2 d。用微量进样器抽取混合气体50 μL注入气象色谱仪气体进样柱内,测定固氮酶活性,计算公式如下:
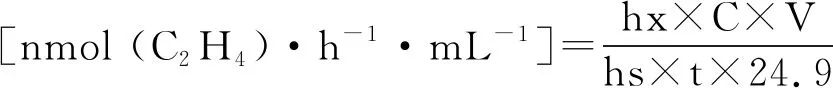
式中:N表示产生C2H4的浓度即固氮酶活性[nmol (C2H4)·h-1·mL-1];hx表示样品C2H4峰面积值;C表示样品C2H4质量浓度(nmol·mL-1);V表示西林瓶容积(mL);hs表示标准C2H4峰面积值;t表示样品培养时间(h);24.9表示标准C2H4气体在测试时的体积(mL)。
分泌植物激素特性:采用液相色谱法(high performance liquid chromatography, HPLC)测定[25]上述复筛菌株产的植物激素(IAA、GA3和t-Z)含量。HPLC色谱条件为:固定相为Agilent ZORBAX Eclipse Plus C18 column(4.6 mm×250 mm,5-Micron),流动相为二元混合溶剂(体积比甲醇∶0.2%冰乙酸溶液=2∶3),检测波长为210 nm,柱温为30 ℃,流速为1.0 mL·min-1,进样量为20 μL。将1.3筛选出的菌株接种于50 mL LB液体培养基中,每株菌重复3次。28 ℃、180 r·min-1摇床中培养3 d。发酵液在4 ℃离心10 min (10000 r·min-1)收集上清液,用氮气在室温下吹至1 mL,甲醇定容至2 mL,HPLC进行分析。
1.5 数据分析
采用SPSS 19.0 软件对数据进行One-way ANOVA 分析,采用Duncan法进行方差分析和显著性检查并用Excel作图。
2 结果与分析
2.1 PGPR分离和溶磷、固氮菌的筛选及分布
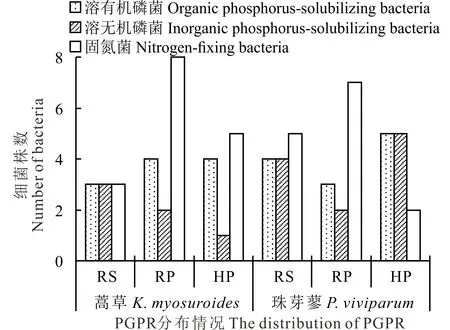
图1 细菌菌株在植物根际的分布情况Fig.1 The distribution of bacteria strains in rhizosphere of plant RS:根表土壤Soil adhering to roots;RP:根系表面Rhizoplan or surface of roots;HP:根内Histoplan or interior of roots.
共分离出细菌68株,并经过(PKO、蒙金娜固体培养基、无氮培养基)复筛获得溶磷固氮菌株43株;嵩草、珠芽蓼根际分别筛出18和25株(图1)。PGPR数量分布呈现出RP显著高于RS和HP区域,其中嵩草、珠芽蓼根际不同区域(RS、RP、HP)PGPR占总数的44.44%、52.00%,33.33%、26.00%和22.22%、26.00%。同时溶解有机、无机磷菌株16株,占无机磷菌株总数的94.12%、有机磷菌株总数的69.57%,ZNRP3只能溶解无机磷。蒿草和珠芽蓼RS、RP和HP区域中PGPR溶有机、无机磷菌株数目分别为3、4、4,3、2、1株和4、3、5,4、2、5株。共获得固氮菌30株。其中,嵩草和珠芽蓼根际RS、RP、HP区分别为3、5,8、7和5、2株。固氮菌在根际RP区域数量明显高于RS和HP区域,在嵩草和珠芽蓼根际RP分布数量均占其总固氮菌数量的50%。
2.2 菌株溶磷特性
溶解有机无机磷的D/d值和溶解量范围分别为1.28~3.79 μg·mL-1、1.08~1.55 μg·mL-1、10.37~72.82 μg·mL-1和9.39~94.79 μg·mL-1,各菌株的D/d值和溶磷量差异显著(P<0.05);ZNRS2溶解无机磷能力强、SNRP4溶解能力弱,且15株菌的溶磷量大于20.00 μg·mL-1;SKHP3溶解有机磷能力强、SNHP2溶解能力最弱;溶磷量大于20.00 μg·mL-1的菌株有18株。蒿草RS、RP和HP区域中PGPR溶有机磷量的范围分别为28.01~55.62 μg·mL-1、37.05~63.42 μg·mL-1和10.37~72.82 μg·mL-1;RS中PGPR溶无机磷量的范围为22.80~34.55 μg·mL-1,RP和HP中只有SNRP2和SNHP2具有溶解无机磷能力。珠芽蓼RS、RP和HP中PGPR溶有机磷量范围分别为21.06~39.85 μg·mL-1、17.19~48.26 μg·mL-1和18.94~53.95 μg·mL-1;其RS和HP区PGPR溶无机磷量范围分别为10.83~94.79 μg·mL-1和20.83~70.01 μg·mL-1,RP区ZNRP3能溶解无机磷。综上,蒿草根际各区域的PGPR溶有机磷能力强于珠芽蓼根际菌株能力,而珠芽蓼根际各区域溶无机磷PGPR菌数目多于蒿草根际菌株数目(表1)。
2.3 菌株固氮酶活性
各菌株固氮酶活性范围为3.79~3193.07 nmol (C2H4)·h-1·mL-1,SKRP2固氮酶活性最高、菌株ZNRP5最低(表2)。其中,固氮酶活性大于100.00 nmol (C2H4)·h-1·mL-1的菌有3株;固氮酶活性小于100.00 nmol (C2H4)·h-1·mL-1的菌株27株,占固氮菌总数量的90%;10株菌固氮酶活性小于10.00 nmol (C2H4)·h-1·mL-1。蒿草和珠芽蓼RS、RP和HP区域中PGPR菌株固氮酶活性范围分别为13.17~48.81 nmol(C2H4)·h-1·mL-1、5.94~3193.07 nmol(C2H4)·h-1·mL-1、5.96~713.29 nmol(C2H4)·h-1·mL-1和3.83~388.35 nmol(C2H4)·h-1·mL-1、3.79~50.12 nmol(C2H4)·h-1·mL-1、4.17~22.11 nmol(C2H4)·h-1·mL-1。综上发现固氮酶活性较强的菌株多分布在蒿草的根系表面和根内以及珠芽蓼的根表土中。
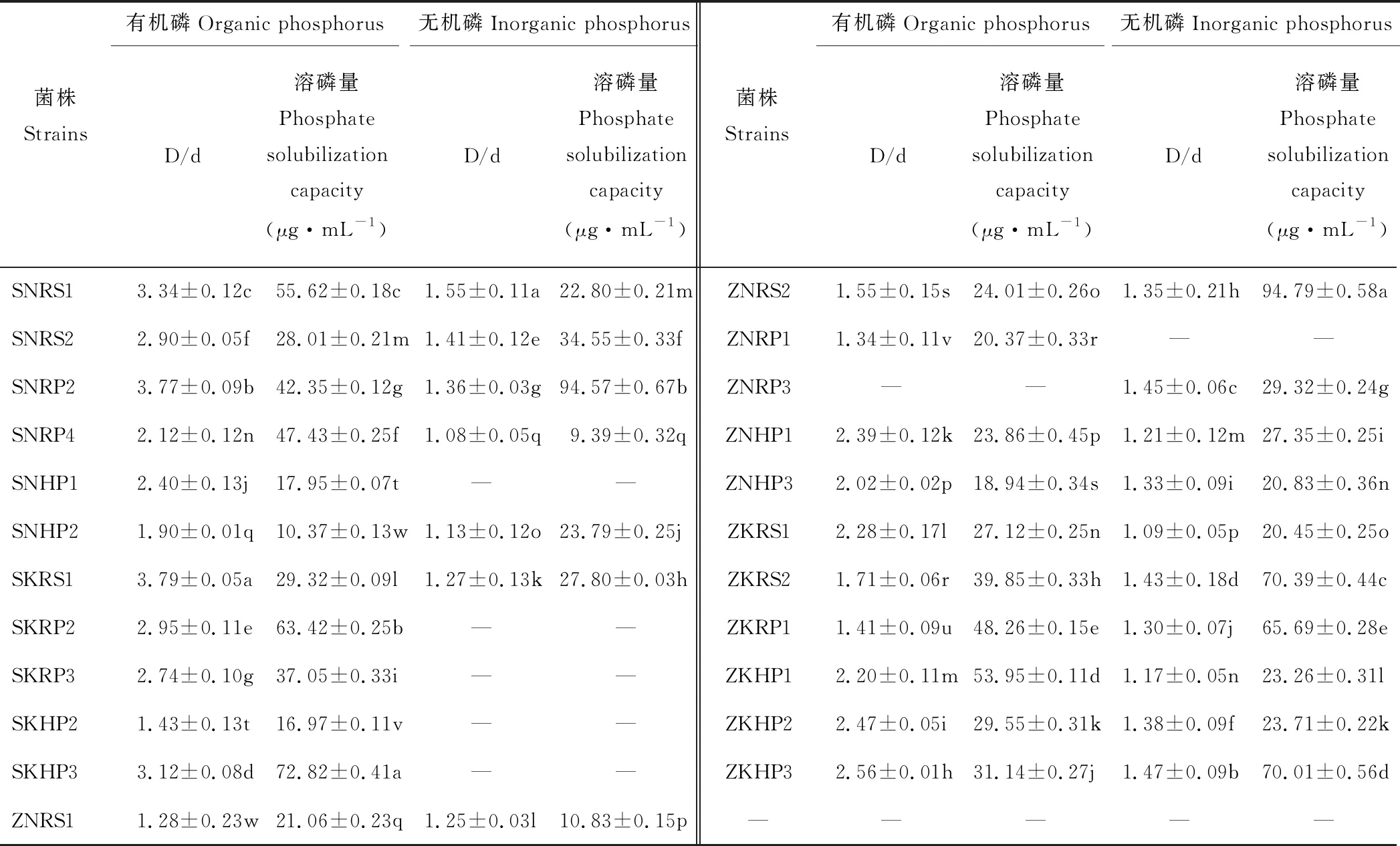
表1 溶磷菌株溶解有机无机磷能力Table 1 The capacity of dissolving inorganic or organic phosphorus of phosphate-solubilizing strains
注:不同小写字母表示所有菌株溶磷量在0.05水平显著差异(P<0.05);D/d:溶磷圈直径/菌落直径;S:蒿草,Z:珠芽蓼;N: NA培养基,K: KB培养基;RS:根表土壤;RP:根系表面;HP:根内;1, 2, 3, 4表示菌株数目,下同。
Note: Different lowercase letters indicate significant differences in the amount of phosphorus dissolved in all strains at 0.05 level (P<0.05); D/d: diameter of phosphate dissolving ring/diameter of colony; S:K.myosuroides, Z:P.viviparum; N: beef extract peptone. K: KB medium. RS: soil adhering to roots; RP: rhizoplan or surface of roots; HP: histoplan or interior of roots; 1, 2, 3, 4 indicates the number of strains, the same below.
2.4 菌株产植物激素
43株PGPR均能分泌植物激素(PHs),分泌3种植物激素(PHs: IAA、GA3、t-Z)的PGPR有16株;分泌2种植物激素(PHs)的PGPR有19株;分泌1种植物激素(PHs)的PGPR有8株。分泌IAA(0.24~69.98 μg·mL-1)的菌占PGPR总数的60.47%,ZKRP6分泌IAA最多;从根际的分布范围上来看,蒿草和珠芽蓼根表土(2,4株)、 根系表面(4,8株)和根内(5,3株)中PGPR分泌IAA能力的范围分别为9.26~12.43 μg·mL-1、2.14~26.21 μg·mL-1、0.46~15.21 μg·mL-1和0.24~33.57 μg·mL-1、 3.38~69.98 μg·mL-1、 2.77~25.82 μg·mL-1。产GA3的PGPR有32株,蒿草和珠芽蓼RS(4,6株)、RP(6,8株)和HP(4,4株)中PGPR菌株泌GA3能力的范围为6.46~31.54 μg·mL-1、7.20~65.52 μg·mL-1、0.34~37.61 μg·mL-1和1.41~50.17 μg·mL-1、1.31~68.87 μg·mL-1、1.30~21.76 μg·mL-1, ZKRP2分泌GA3能力最强; 36株PGPR分泌t-Z,占PGPR总数的83.72%,蒿草和珠芽蓼RS(4,4株)、RP(7,12株)和HP(4,5株)中PGPR菌株泌t-Z能力的范围为0.11~32.59 μg·mL-1、1.45~28.03 μg·mL-1、9.92~15.52 μg·mL-1和3.58~47.59 μg·mL-1、2.36~26.21 μg·mL-1、2.07~21.92 μg·mL-1。总体而言,分泌植物激素(PHs)的能力大小和菌株数量上均表现出t-Z>GA3>IAA的趋势(表3)。

表 2 固氮菌株的固氮酶活性Table 2 Nitrogenase activity of nitrogen-fixing strains [nmol (C2H4)·h-1·mL-1]

表 3 样品中植物激素的含量Table 3 The contents of plant hormones in samples (μg·mL-1)
2.5 优良PGPR的综合评价
综合上述菌株特性,发现菌株特性优良的PGPR有12株(表4),ZKRS2菌株有较为全面的促生特性,可以作为下一步深入研究的供试菌株。ZNRS2、SNRP2、ZKHP3、ZKRP1有较强的溶磷能力;SKRP2、SNHP1、ZNRS3固氮酶活性较高;SKHP3、ZNHP2、ZKRS2、ZKRP1、ZKRP2可以分泌较多的植物激素,可以作为微生物复合菌剂的菌种来源。

表4 优良植物根际促生菌Table 4 Excellent plant rhizosphere promoting bacteria
3 讨论
在中国,过量使用化肥致使农业生态环境遭到破坏,迫切需要绿色高效可持续肥料来代替化肥,并改善土壤微环境,PGPR菌肥应运而生。研究发现PGPR的作用方式多样,菌株特性和对不同生境的适应性存在差异限制了PGPR的应用[25-27],因此筛选更多优良PGPR菌株就显得十分迫切。本研究在高寒草甸优势种(蒿草、珠芽蓼)根际筛选出细菌68株,其中溶磷固氮菌43株;且从珠芽蓼根际筛选出的PGPR多于嵩草根际;在植物根际促生菌PGPR分布呈RP显著高于RS和HP的趋势。究其原因可能是植株根系代谢产生的糖类等物质是PGPR的主要碳源,使细菌在根表富集;还可能是固氮细菌Azoarcus产生较少的果胶酶,使细菌不能有效侵入根中;同时还和细菌分泌的内切-1,4-β-葡聚糖酶、Exo-1,4-纤维二糖水解酶、β-葡萄糖苷酶的酶活性有关[28]。此外,珠芽蓼PGPR含量较多可能与植物根系分泌物有关,有研究表明细菌定殖具有趋化性,枯草芽胞杆菌NCD-2对棉花(Gossypiumhirsutum)根系分泌物表现出类似趋性[29],这与姚拓[30]和张英等[31]在该地区取得的研究成果相似。
本研究发现溶解无机磷菌17株(溶磷量:9.39~94.79 μg·mL-1),溶解有机磷菌22株(溶磷量:10.37~72.82 μg·mL-1);固氮菌株30株[固氮酶活性:3.79~3193.07 nmol (C2H4)·h-1·mL-1]。其中,溶磷固氮菌株有10株,SKRP2固氮酶活性高、ZNRS2溶解无机磷能力强、SKHP3溶解有机磷能力强,蒿草PGPR溶解有机磷能力强于珠芽蓼,但溶无机磷PGPR数目和能力相反。宋金秋等[23]分离绞股蓝(Gynostemmapentaphyllum)PGPR菌株并发现JDG122、JDG127和JDG223菌株溶磷量范围为0.1~3.4 mg·L-1。这主要和菌株代谢活动有关,研究表明酶解作用是有机磷降解的重要途径,微生物向外界分泌磷酸酶、植酸酶、核酸酶、脱氢酶等使有机物去磷酸化来分解有机磷化合物、细菌产酸来分解无机磷化合物[32],且溶磷能力的强弱与细菌自身代谢能力、周围土壤环境等诸多因素有关,还有待进一步研究。同时,研究表明固氮酶活性能够直接影响生物固氮作用,固氮酶活性和微生物体内铁蛋白、钼铁蛋白及其复合体,还和铁钼辅因子中底物的络合、还原相关,不同微生物体内铁蛋白、钼铁蛋白等的数量和结构存在差异,表现出固氮酶活性的强弱差距[33],另外界自然生境不同也可能是使固氮酶活性出现变化的诱因。
本研究还发现,43株PGPR均检测到可分泌植物激素(PHs),在分泌PHs的能力、菌株数上均表现出t-Z>GA3>IAA的趋势;其中,珠芽蓼根表中含有较多分泌PHs的PGPR;菌株分泌3种PHs(IAA、GA3、t-Z)范围分别为0.24~69.98 μg·mL-1、0.34~68.87 μg·mL-1和0.11~47.59 μg·mL-1。究其原因可能是和激素稳定性有关,研究发现IAA见光易分解、GA3对pH和温度敏感,而T-Z相对稳定性最高[34];另也有研究表明细菌分泌PHs含量与培养基成分有关[9];此外,根表富含根系分泌物,能为较多种细菌提供生长必需的养分,促使菌株数量和生长代谢增加,从而表现出PHs分泌增加[35]。
4 结论
1)共筛选出细菌68株,其中具溶磷、固氮和分泌植物激素能力的菌株43株,其中溶解无机磷菌株17株,溶解有机磷菌株22株,固氮菌株30株;26株可分泌IAA,32株分泌GA3和36株分泌t-Z;2)在单株植物(蒿草、珠芽蓼)中整体表现出RP区细菌数目显著高于RS和HP区;蒿草PGPR溶解有机磷能力强于珠芽蓼PGPR,但溶无机磷PGPR数目和能力相反。3)菌株分泌植物激素(PHs)的能力大小和数量上均表现出t-Z>GA3>IAA的趋势。4)其中11株菌可以用于后期微生物肥料制作和相关研究。
