运用高通量RNA测序探讨当归多糖对角质形成细胞的影响
2019-11-15刘林莉廖倩汪瀚文欧阳飞鲁青莲刘婷婷房慧万焰于春水
刘林莉 ,廖倩 ,汪瀚文 ,欧阳飞 ,鲁青莲 ,刘婷婷 ,房慧 ,万焰 ,于春水
(1.遂宁市中心医院,四川遂宁629000;2.遵义医学院,贵州遵义563003)
当归多糖(Angelica polysaccharide,APS)为当归中提取的活性物质,其有提高免疫、抗肿瘤、抗氧化、抗辐射等多种功能。永生化角质形成细胞(HaCaT)是一种永生化的、有潜在分化能力的细胞,常作为研究角质形成细胞生理功能的模型。高通量测序是近年来一个热门的技术,主要特点是测序通量高,测序时间和成本显著下降。本研究中,我们运用高通量RNA测序APS对HaCaT细胞的影响,寻找差异基因(DEGs),进行DEGs的功能富集,探讨APS对角质形成细胞的影响。以期为角化异常的皮肤疾病的治疗机制提供理论支持。
1 材料与方法
1.1 一般资料 选取HaCaT细胞置于MEM培养基于37℃培养,每2天换液、传代,取3代或4代HaCaT细胞的单细胞混悬液。从伞形科植物当归的干燥根中提取APS,标志性成分(APS)经UV检测,本实验设定浓度为200 ng/μL。3组HaCaT细胞用同样浓度(200 ng/μL)的APS处理后作为实验组;3组不加APS培养的HaCaT为对照组。6组标本送往上海庚思生物有限公司进行高通量RNA测序。
1.2 主要试剂、仪器 RNAiso Plus(Trizol)(厂商Takara,货号 9109)、Qubit2.0 RNA 检测试剂盒(厂商 Life、货号 Q32855)、Qubit2.0荧光计(型号Q32866,厂商Invitrogen)、台式高速低温离心机(型号Thermo Scientific Sorvall Legend Micro 21R、生产商Thermo)、电泳仪(型号DYY-11,厂商北京市六一仪器厂)、生物电泳图像分析系统(型号FR-980A、厂商复日科技)。
1.3 实验方法
1.3.1 RNA提取 在6组HaCaT细胞中分别加入Trizol试剂(Takara,货号 9109)混匀,按照 Trizol试剂说明书提取总RNA。再使用Qubit2.0RNA检测试剂盒(厂商Life,货号Q32855)予以RNA纯化。
1.3.2 RNA文库的构建及测序 总RNA用琼脂凝胶电泳分离后予以回收纯化,纯化回收产物予以PCR扩增,扩增后采用Illumina Hiseq平台进行测序。
1.3.3 测序数据分析 Illumina Hiseq平台的测序数据经以下流程进行分析:①数据评估及质控:对测序的原始数据通过FastQC进行质量评估,通过Trimmomatic进行质量剪切,得到相对准确的有效数据。②表达水平分析:使用StringTie和已知的基因模型评估基因的表达量;使用WGCNA进行基因共表达分析;基于样本的表达量矩阵进行样本比较分析等多方向的统计分析和探索。③表达差异分析:使用DESeq2进行基因表达差异分析,对表达差异分析结果进行可视化;将DEGs映射到STRING蛋白互作网络数据库上进行蛋白互作网络构建;基于差异分析结果,绘制韦恩图、热图,并进行聚类分析。④基因富集分析:使用top(Gene Ontology GO)进行GO富集分析;使用clusterProfiler进行KEGG通路富集分析。
1.4 统计学处理 采用DESeq2进行基因表达差异分析,用topGO进行GO富集分析,使用ClusterProfiler进行KEGG通路富集分析。所有统计分析均使用SPSS 20.0分析,P<0.05为差异有统计学意义。
2 结果
2.1 DEGs表达结果 DEGs的筛选需要严格的标准,其筛选条件设定为:qValue<0.05且差异倍数|FoldChange|>2。本实验中,经APS处理后的HaCaT和对照组比较,共有84个显著性DEGs表达,其中有33个显著基因表达上调,51个显著基因表达下调,其表达差异火山图见图1。
横轴为基因在不同组样本间的表达差异倍数fold-change[log2(B/A)]值,纵轴为代表基因表达量变化的统计学显著程度pValue,pValue越小,-log10(pValue)越大,差异越显著。图中每个点代表一个基因,其中红色表示上调基因,绿色表示下调基因,黑色表示非DEGs。
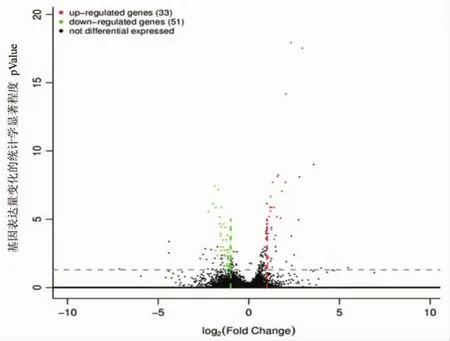
图1 比较组表达差异火山图
2.2 GO功能富集分析 根据P<0.05筛选出2组的差异表达基因进行GO富集。GO是一个国际标准化的基因功能分类体系,以全面描述生物体中基因和基因产物的属性。分别从基因的分子功能(Molecular function)、细胞组分(Cellular component)、生物过程(Biological process)这3个方面来进行GO功能富集分析。主要结果显示为Ⅰ型干扰素(IFN)信号通路、免疫反应、细胞因子应答等生物过程表达下调,见表2。
2.3 京都基因和基因组百科全书富集通路分析(KEGG) KEGG是一个有关生物系统较完善的数据库,整合了基因组、化学物质和系统功能信息。选出DEGs后,研究DEGs在注释功能中的分布状况将阐明样本差异在基因功能上的体现。本实验部分显著性DEGs的富集通路主要集中在生物激素的合成、氨基酸的代谢等通路,见表3。
3 讨论
当归是一种传统的药用和食用植物,长期用于补益,补血,活血化瘀,止痛,润肠,治疗女性月经不调和闭经[1]。APS为当归中提取的一种高活性物质,主要有提高免疫、抗氧化、抗肿瘤、抗辐射、抗衰老、消炎镇痛、保肝作用以及降血糖和神经保护等多种作用[2]。在皮肤方面,王刚等[3]发现,APS通过对转化生长因子(TGF)-β 及白细胞介素(IL)-1α 的表达有显著的调节作用,影响真皮成纤维细胞Ⅲ型胶原的分泌,从而促进成纤维细胞增殖,提示APS可能在皮肤创面愈合中起重要作用。也有研究表明,APS可以抑制肥大细胞的活化,从而抑制炎细胞因子和变应性介质的释放,有一定的抗过敏作用[4]。已经证实APS对角质形成细胞的凋亡有促进作用[5],同时可抑制核转录因子(NF)-κB活化、减少IFN-γ分泌,从而对银屑病发挥治疗作用[6]。HaCaT细胞是永生化的人角质形成细胞,常常作为银屑病的研究模型。

表2 通过P<0.05筛选得到APS实验组和对照组的DEGs,对DEGs进行GO功能富集
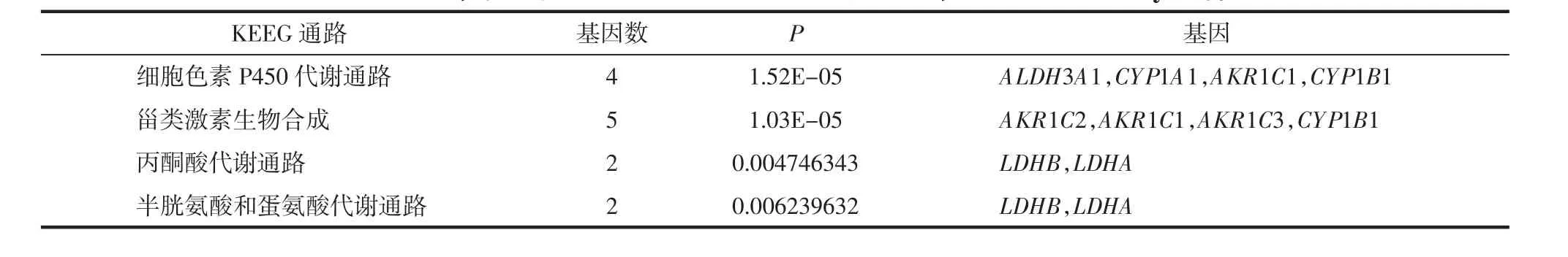
表3 根据P<0.05,筛选得到APS实验组和对照组的DEGs,对其进行Pathway显著性分析
本研究中,笔者采用的RNA-seq的方法,检测了APS处理HaCaT后的差异基因,并予以GO功能富集和KEGG通路富集分析。在DEGs表达中,共有84个显著性DEGs表达,其中有33个显著基因表达上调,51个显著基因表达下调。GO功能富集显示为Ⅰ型IFN信号通路、免疫反应、细胞因子应答等生物过程表达下调,说明APS可抑制Ⅰ型IFN信号通路、免疫反应、细胞因子应答等生物过程。最显著的为Ⅰ型IFN信号通路表达下调。银屑病是多基因遗传背景下的T细胞介导的自身免疫性疾病,主要以角质形成细胞过度增生、炎症细胞浸润、新生血管形成作为组织病理改变。银屑病患者的皮肤中,Ⅰ型IFN信号传导途径被激活,Ⅰ型IFN信号传导组分的表达显着增加[7]。根据IFN的来源、序列、活性等可将其分为Ⅰ型IFN和Ⅱ型IFN。Ⅰ型IFN是针对病毒和细菌感染而产生的,并且在宿主的防御机制中起关键作用。Ⅱ型IFN包括IFN-γ,IFN-γ主要由活化的T细胞、树突细胞和NK细胞产生,参与适应性免疫应答。Ⅰ型IFN中IFN-α和IFN-β最丰富。据文献报道,IFN-α可诱发银屑病的发生[8]。IFN-α诱发银屑病的机制可能如下:①由于IFN-α信号传导通路的活化,使得表皮中的浸润性CD8+T细胞对IFN-α过度反应;②增加的IFN-α介导的反应包括IFN-γ的产生;③IFN-γ触发树突细胞的成熟和活化,以及角质形成细胞的活化和过度增殖,由树突细胞和角质形成细胞生长因子,趋化因子,黏附分子,和炎性介质随后表达使得炎症的持久浸润,最终维持慢性银屑病损伤[9]。所以IFN-α在银屑病发病机制中起间接作用。本研究中发现,APS可以抑制Ⅰ型IFN信号通路,抑制IFN-α的活化,减轻免疫反应,减少炎症的浸润,从而缓解银屑病的损伤,对于慢性银屑病可以起到治疗作用。同时银屑病也是多种细胞因子参与应答而导致免疫异常的疾病,而富集通路显示APS可以抑制免疫反应,抑制细胞应答,从而发挥对银屑病的治疗作用。
本实验从平基因表达水平来研究APS对角质形成细胞的影响,发APS有抑制角质形成细胞异常免疫的作用,从而以达到治疗银屑病的作用。但本实验数据较泛杂,有待深入研究来探讨APS是如何具体来抑制角质形成细胞的异常免疫,为未来角质异常的皮肤的治疗开拓新的路径和基础。
