AJUBA在口腔鳞癌中的表达和意义及其相关机制
2019-11-13姚晓峰金锐陶英杰郭文宇
姚晓峰 金锐 陶英杰 郭文宇
口腔鳞癌(oral squamous cell carcinoma,OSCC)是头颈部常见的第二大高发恶性肿瘤,约占口腔颌面部恶性肿瘤的90%。OSCC是对于口腔中恶性肿瘤的统称,包括舌、牙龈、唇、颊、口底、软硬腭等部位发生的癌症,具有侵袭性强、易早期淋巴结转移的特点。AJUBA(ajuba LIM protein)基因位于人类染色体14q11.2[1],蛋白结构与LIM 家族的其他成员相似,通过LIM 或者preLIM 结构与其他多种蛋白或DNA 结合,作为支架蛋白参与多种生物学过程,发挥多种生物学作用[2]。在肿瘤的发生发展中,AJUBA参与多种信号通路的调节。在恶性间皮瘤中,AJUBA 通过调控Hippo信号转导抑制细胞增殖[3]。此外,AJUBA通过加强β-catenin 和GSK-3β 之间的结合促进GSK-3β介导的β-catenin 磷酸化,从而对Wnt 信号通路进行负调节[4]。目前,AJUBA 在OSCC 中的研究鲜见报道,其在OSCC中的表达情况及对肿瘤细胞增殖和侵袭的影响仍有待探究。
1 材料与方法
1.1 临床资料
收集2010年2月至2015年12月天津医科大学肿瘤医院OSCC组织标本共120例。其中男性75例,女性45 例;年龄≤60 岁54 例,>60 岁66 例;T1+T2 期73例,T3+T4期47例。
1.2 方法
1.2.1 免疫组织化学法 石蜡包埋切片后,常规脱蜡,3%H2O2处理30 min,柠檬酸钠抗原修复,一抗4℃过夜孵育,加入二抗孵育30 min 后,DAB 显色,苏木素复染,脱水后中性树胶封片,采集图像并分析AJU⁃BA表达情况。根据阳性肿瘤细胞所占百分数进行阳性率评分,≤5%、5%~25%、25%~50%、≥50%分别计0~3 分;染色强度评分:无着色为0 分,淡黄色为1分,黄色为2分,棕褐色为3 分,两项评分相乘所得分数为最终评分。120 例OSCC 组织标本按评分升序排列,低表达60例,高表达60例。
1.2.2 RNA 提取与qPCR 采用Trizol 法提取28 对OSCC 及癌旁组织总RNA,定量后吸取1 μg RNA,通过逆转录试剂盒将其逆转录成cDNA。通过SYBR Green mix 对cDNA 进行qPCR 实验,以GAPDH 作为内参,检测AJUBA及Snail的表达情况。
1.2.3 细胞培养 人OSCC细胞系Tca8113和TSCCA均购于中国科学院细胞库,采用含10%胎牛血清的RPMI 1640培养基,置于37℃,5%CO2细胞培养箱中培养。
1.2.4 质粒及siRNA转染 OSCC细胞接种于6孔板中,融合度达70%~80%时,利用Lipofectamine 3000将2.5 μg质粒DNA转染至Tca8113和TSCCA细胞中。AJUBA特异性siRNA及阴性对照购于吉玛基因(苏州)。当6孔板中细胞融合度达40%时,采用RNAiMax转染30 pmol si-AJUBA至Tca8113和TSCCA细胞中,48 h后进行表达检测或功能实验研究。
1.2.5 MTT实验 将OSCC细胞消化计数后,接种于96 孔板中(1×103个细胞/孔)。分别于第1、2、3、4、5天采用MTT法检测细胞增殖情况。具体步骤:100 μL培养基加入10 μL MTT 溶液,37℃孵育4 h 后吸去上清,加入150 μL DMSO 室温孵育10 min,490 nm 波长检测OD并分析。
1.2.6 Western blot 将OSCC 细胞用PBS 清洗2 遍,加入细胞裂解液冰上裂解30 min,12 000 r/min,4℃离心15 min,收集上清采用BCA 法进行蛋白定量。蛋白变性后,SDS-PAGE电泳。转膜完成后,5%脱脂牛奶封闭1 h,相应一抗4℃过夜孵育。TBST 洗涤3 次后,加入相应二抗室温孵育1 h,ECL化学发光法曝光检测蛋白的表达情况。
1.2.7 克隆形成实验 Tca8113和TSCCA细胞接种于6孔板中(5×102个细胞/孔),培养14 d后,冰甲醇固定15 min,0.1%结晶紫染色,PBS清洗后,采集图像并计数。
1.2.8 划痕实验 OSCC细胞消化后铺于6孔板中,当细胞融合度约100%时,使用10 μL 移液枪枪头对孔中细胞划痕,PBS清洗以去除脱落细胞。24 h后采集图像,并采用Image J 图像处理软件对细胞迁移面积进行分析。
1.2.9 Tranwell 实验 OSCC 细胞消化后用无血清培养基重悬,计数后加入已预铺好Matrigel 的Transwell小室中,小室下方加入600 μL含20%胎牛血清的RP⁃MI 1640 培养基。培养24 h 后,用棉签擦拭掉小室膜上方细胞,甲醇固定15 min,0.1%结晶紫染色,PBS清洗后采集图像并分析。
1.3 统计学分析
采用SPSS 17.0统计学软件进行分析,数据以表示,实验数据通过3次独立实验获得。两组样本间比较采用t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 AJUBA在OSCC组织中的表达及与预后的关系
通过qPCR 检测及TCGA 数据库分析发现,AJU⁃BA 在OSCC 组织中的表达水平显著升高(图1A,1B)。免疫组织化学法结果显示OSCC组织中AJUBA表达显著高于癌旁正常组织(图1C)。同时发现AJU⁃BA表达与OSCC的T分期、淋巴结转移及复发呈正相关,其表达越高,肿瘤分化越差(表1)。与AJUBA 低表达患者相比,AJUBA 高表达患者的预后相对较差(图1D,P=0.019)。
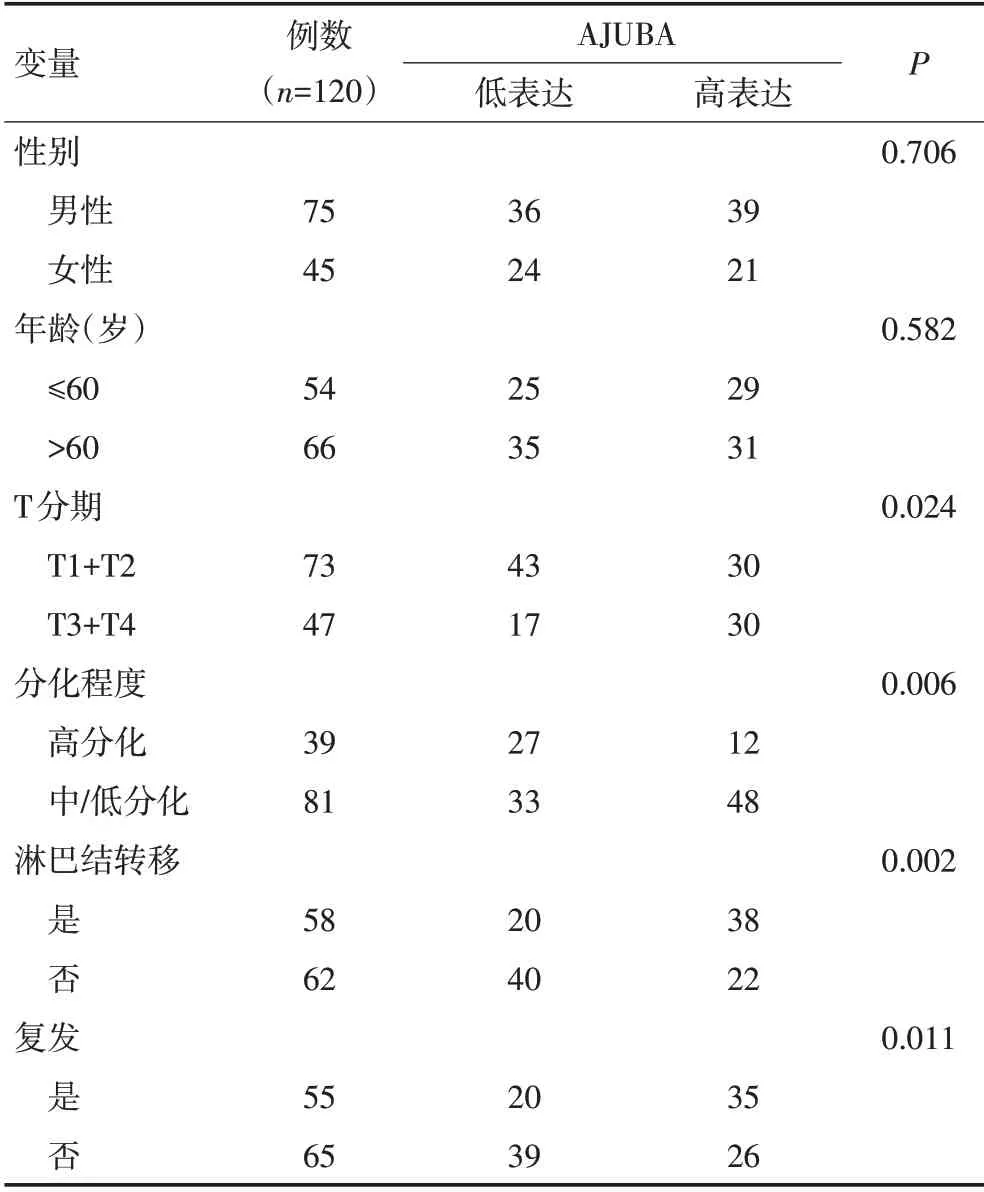
表1 AJUBA表达与OSCC临床病理指标的关系
2.2 AJUBA对OSCC细胞的增殖和侵袭
在Tca8113 和TSCCA 中敲降AJUBA 后,肿瘤细胞的增殖能力受到显著削弱(图2A)。通过克隆形成实验发现敲降AJUBA 能够抑制Tca8113和TSCCA 细胞的克隆形成(图2B)。此外,与阴性对照组相比,si-AJUBA 组的划痕面积较大,表明AJUBA 表达下调能够导致OSCC 细胞的迁移能力降低(图2C)。随后进行Transwell 实验进一步探究AJUBA 对OSCC 细胞侵袭的影响。结果显示敲降AJUBA 后,Transwell 小室膜下方的肿瘤细胞数显著减少,OSCC 细胞的侵袭能力受到显著抑制(图2D)。
2.3 AJUBA对OSCC细胞Snail表达的影响
Western blot检测结果表明,过表达AJUBA后,OSCC细胞中Snail表达升高,同时N-cadherin和Vimentin表达增加,E-cadherin表达下降。而敲减AJUBA导致Snail、N-cadherin和Vimentin表达降低,E-cadherin表达上调(图3)。以上结果表明AJUBA可能通过调控Snail影响OSCC的上皮间质转化。
2.4 OSCC中AJUBA与Snail的相关关系
通过qPCR检测发现,OSCC组织中的Snail mRNA水平显著高于正常组织(图4A,P=0.00 1)。Spearman相关性分析显示AJUBA与Snail表达呈正相关(图4B,P=0.001)。通过TCGA数据库分析发现Snail表达升高,提示OSCC患者预后不良(图4C)。
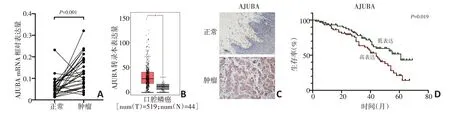
图1 AJUBA在OSCC中高表达及预后
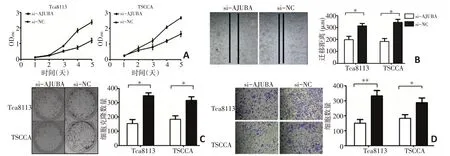
图2 AJUBA对OSCC细胞的增殖和侵袭
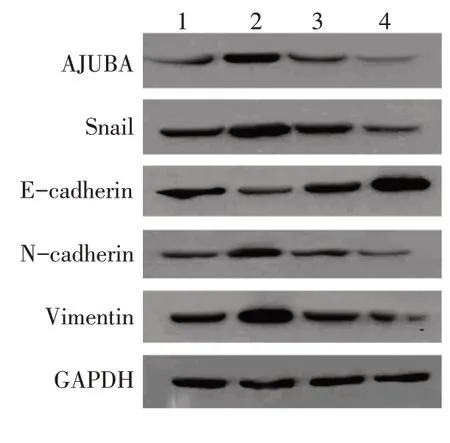
图3 AJUBA对OSCC细胞Snail及下游蛋白表达的影响

图4 Snail在OSCC中的表达及与AJUBA表达的相关关系
3 讨论
研究表明AJUBA 能够促进多种肿瘤进展,AJU⁃BA可与SP1形成复合体,诱导下游基因表达,促进胰腺癌的增殖[5]。在食管鳞癌中,AJUBA能够通过上调MMP10 和MMP13 的表达从而增强肿瘤细胞的运动侵袭能力[6]。然而也有证据显示,AJUBA可以通过调控β-catenin 和YAP 通路,抑制肝癌细胞生长从而发挥抑癌基因的作用[7]。这可能与不同的细胞背景有关[8]。目前,AJUBA 在OSCC 中的研究较少,其发挥的功能及相关调控机制仍有待探究。本研究首先检测AJUBA 在OSCC 中的表达情况,结果显示AJUBA在OSCC中显著高表达,并且提示不良预后。因此推断AJUBA可能促进OSCC进展。
此外,免疫组织化学法结果显示AJUBA 的表达与T 分期及淋巴结转移呈正相关,因此AJUBA 可能在OSCC 的增殖和侵袭过程中发挥重要作用。通过功能实验发现敲降AJUBA 能够显著抑制OSCC 细胞的增殖和侵袭能力。这充分证实了AJUBA 在OSCC中发挥着促癌基因的作用,而AJUBA 调控的具体机制则需进一步探究。
上皮间质转化(epithelial-mesenchymal transi⁃tion,EMT)是上皮细胞获得间质表型或成纤维样特性时出现的暂时、可逆的生物学过程[9],解释了肿瘤转移的起始步骤,在肿瘤研究中受到越来越多的关注[10]。EMT发生后,上皮细胞失去极性、细胞间连接降解、细胞骨架结构重组、细胞形态改变,而这些改变使细胞获得了更高的迁移、侵袭和降解细胞外基质的能力[11]。因此,本研究进一步检测AJUBA对OS⁃CC 细胞EMT 的影响,发现敲减AJUBA 后,上皮样标志物E-cadherin 表达上调,而间质样标志物Vimentin及N-cadherin 表达下降,这表明AJUBA 能够通过调控EMT发生而促进OSCC的侵袭转移。
大量研究表明Snail是调控EMT过程的重要转录因子,在多种肿瘤中(如胰腺癌、结直肠癌、乳腺癌、OSCC 及恶性黑色素瘤等)均可转录抑制E-cadherin的表达来促进EMT 的发生[12-14]。本研究发现敲降AJUBA 能够抑制Snail 的表达,同时在OSCC 中,两者的表达呈正相关。因此本研究提示,AJUBA 通过影响Snail 表达从而下调E-cadherin 并促进EMT 的发生。但AJUBA 与Snail 之间的具体调控机制仍值得深入发掘。
综上所述,本研究发现AJUBA 在OSCC 中高表达,且提示不良预后。AJUBA能够调控Snail表达,从而影响OSCC的细胞增殖、侵袭及EMT发生。本研究初步揭示了AJUBA在OSCC中的功能及调控机制,为OSCC的临床诊疗提供了理论依据和新的思路。
