大曲液化酶活力测定方法的对比研究
2019-11-12张梦阳李宜波刘忠杰
马 群,张梦阳,李宜波,刘忠杰,向 征
(湖北白云边酒业股份有限公司,湖北松滋 434200)
大曲是大曲酒的糖化发酵剂,它是以大麦、小麦、豌豆等为主要原料,经粉碎、加水拌料、压制成型后,在一定的温度、湿度条件下培育而成。大曲中主要含有霉菌、酵母菌和细菌等微生物,是一种多菌种混合发酵曲。大曲在酿造的过程中既是糖化发酵剂,又是酿酒原料,对形成酒的风格和提高酒质起着决定性的作用。目前大曲的质量检验除了常规的感官检验外,还包括部分理化指标的检测。
在理化指标的检测中,大曲的液化力体现了大曲中的微生物及酶降解淀粉的能力,是一项重要的检测指标。液化型淀粉酶(又称α-淀粉酶),能将淀粉分子链中的α-1,4葡萄糖苷键随机切断成长短不一的短链糊精、少量的麦芽糖和葡萄糖,而使淀粉对碘呈蓝紫色的特性反应逐渐消失,呈现棕红色,其颜色消失的速度与酶活性有关,据此可以测定液化酶活力。在各酿酒企业中,均对大曲的此项指标进行了检测,而且检测方法基本采用传统的比色法。随着科学技术的进步和借助先进的仪器设备,应用分光光度计测定液化酶活力的方法也应运而生。本文着重对比分析了这两种方法在大曲液化酶活力检测中的应用,为后续大曲液化酶活力检测方法的选用提供一定的参考。
1 材料与方法
1.1 材料、试剂及仪器
材料:滴定管、恒温水浴锅、自动移液器、25mL试管、250mL烧杯、100mL容量瓶、150mL三角瓶。
仪器:分光光度计。
淀粉溶液(20 g/L):称取10.00 g 预先于100~105 ℃烘干2 h 的可溶性淀粉,用水调成糊状,不断搅拌下注入400 mL 沸水,继续煮沸至透明。冷却后,在500 mL 容量瓶中定容至刻度,摇匀。此溶液必须现配现用,若用量较少,可按比例适当减少配制量。
原碘液:称取11 g 碘,22 g 碘化钾,置于研钵中,加入少量水,研磨至碘完全溶解,用水稀释至500 mL,摇匀。贮存于棕色瓶中静置过夜。
稀碘液:量取2 mL 原碘液,加入20 g 碘化钾,用水稀释至500 mL,摇匀。贮存于棕色瓶中静置过夜。
糊精溶液:称取0.3 g 糊精溶于50 mL 水中,加热溶解。
磷酸缓冲溶液(pH6.0):称取45.23 g 磷酸氢二钠(Na2HPO4·12H2O)和8.07 g 柠檬酸(C6H8O7·H2O),用水溶解并定容至100 mL,再用pH 计校正后使用。
盐酸溶液[c(HCl)=0.1 mol/L]:按GB/T 601配制。
可溶性淀粉溶液(4 g/L):称取1.000 g(精确至0.001 g)可溶性淀粉(以绝干计)于烧杯中,用少量水调成浆状物,边搅拌边缓缓加入70 mL 沸水中,然后用水多次冲洗装淀粉的烧杯,洗液倒入其中,搅拌加热至完全透明,冷却定容至250 mL。溶液现配现用。注:可溶性淀粉采用酶制剂专用可溶性淀粉。
1.2 传统比色方法
1.2.1 标准颜色的配制
在50 mL 试管中加入5 mL 稀碘液,再滴入1~2滴糊精溶液,摇匀。
1.2.2 固体曲浸出液的制备
称取5 g 大曲粉(精确至0.0001 g),用少量磷酸缓冲液充分溶解,于40 ℃水浴锅中浸取2 h,每隔15 min 搅拌1 次(保证酶液完全浸取出来,并将大曲自身的淀粉消耗殆尽),将上清液小心倾入容量瓶中,若有剩余残渣,再加少量磷酸缓冲液充分研磨,最终样品全部移入100 mL 容量瓶中,用磷酸缓冲液定容至刻度,摇匀。用4 层纱布过滤,滤液待用。
吸取25 mL 20.0 g/L 可溶性淀粉溶液和5 mL磷酸缓冲溶液于100 mL 试管中于35 ℃水浴中保温10 min 后,加入固体曲浸出液V mL(因高温曲和中温曲液化力差异较大,测试高温曲时加入20 mL固体曲浸出液,若测试的是中温曲则加入2 mL 固体曲浸出液),再加入10 mL 水,充分摇匀,开始计时。继续于40 ℃保温,定时取出1滴反应液加入装有稀碘液的试管内,观察颜色变化。当碘液颜色与标准颜色一致时即反应终点,此刻立即记录液化时间t(min)。
1.2.3 计算
固体曲液化力的定义:在35 ℃,1 g 大曲1 h 液化可溶性淀粉的质量。
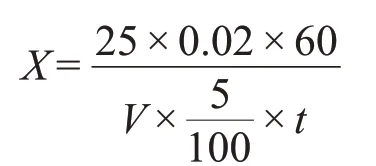
式中:X——液化力(可溶性淀粉,g/g·h);
25.0——可溶性淀粉溶液用量(mL);
0.020——可溶性淀粉溶液浓度(g/mL);
V——加入的固体曲浸出液的体积(mL);
60——1 h换算成的分钟数(min);
t——液化时间(min)。
1.3 分光光度法
α-淀粉酶活力定义:1 g 固体酶粉(或1 mL 液体酶),于60 ℃、pH6.0 的条件下,1 min 液化1 mg可溶性淀粉,即为1 个酶活力单位,以“U/g(U/mL)”表示。
1.3.1 待测酶液的制备
称取10 g 大曲粉(精确至0.0001 g),后续待测酶液制备方法同1.2.2。
1.3.2 制作淀粉溶液浓度梯度与吸光度的标准曲线
淀粉标准溶液的制备:称取1.5 g 淀粉,定容至250 mL容量瓶中。制作淀粉浓度为0 g/L、0.075 g/L、0.15 g/L、0.30 g/L、0.45 g/L、0.60 g/L、0.90 g/L 的标准溶液,用自动移液器吸取1.00 mL淀粉溶液(空白对照样加入1.00 mL 磷酸缓冲液)加到预先盛有0.5 mL盐酸溶液和5.00 mL稀碘液的试管中,摇匀,并以0.5 mL 盐酸溶液和5.00 mL 稀碘液为空白,于660 nm 波长下,测定其吸光度(A)。并制作淀粉浓度与吸光度标准曲线,见图1。
1.3.3 测定
吸取10.0 mL 浓度为4 g/L 可溶性淀粉溶液、10 mL无菌水、5 mL磷酸缓冲溶液于150 mL三角瓶中,摇匀后,置于60 ℃的恒温水浴中预热8 min。加入1.00 mL稀释好的待测酶液立即计时,摇匀,准确反应10 min。立即用自动移液器吸取1.00 mL 反应液(空白对照样加入1.00 mL 磷酸缓冲液),加到预先盛有0.5 mL 盐酸溶液和5.00 mL 稀碘液的试管中,摇匀,并以0.5 mL 盐酸溶液和5.00 mL 稀碘液为空白,于660 nm波长下,测定其吸光度(A)。
根据标准曲线的公式y=0.8475x-0.0145,假设y0为空白对照样淀粉浓度,y 为待测样淀粉浓度。代入公式计算反应过程中淀粉的消耗量,y0-y=0.8475(x0-x),根据α-淀粉酶活力定义计算α-淀粉酶活力X:

式中:X——样品的酶活力,U/mL;
c——测试酶样浓度,g/mL;
v——反应中加入待测酶液量,mL;
t——反应时间,(min)。
式中c=0.1 g/mL;v=1.00 mL;t=10 min。
2 结果与分析
为了比较两种检测方法的优劣,我们随机选取原料车间粉碎好的两个高温曲样作为试验样品,分别从反应所需时间和检测结果的准确度和精密度方面进行比较。
2.1 反应时间
2.1.1 传统检测方法的反应时间
由1.2.2 可知,前期准备工作除外,固体曲浸出液的制备需要120 min,液化所需时间跟成品曲液化力大小相关。根据1.2.3 固体曲液化力的计算公式,由于试验的是高温曲,式中v=2 mL,代入公式计算。而白云边公司高温曲液化力的检验合格标准是0.2~0.6 g/g·h。而当液化力为0.2 g/g·h 时,反应时间t 为150 min;当液化力为0.6 g/g·h 时,反应时间为50 min。假设前期准备工作和中途液化反应液的制备共需要30 min,那么合格曲的液化力检测时间在200~300 min 之间,成品曲入库之前,会有部分液化力偏低的不合格曲,这些不合格曲的检测时间更长。
2.1.2 分光光度计法的反应时间
分光光度计法测定酶活中前期药品配制等准备工作除外,假设大曲粉浸提前的准备工作需要15 min,淀粉溶液的配制等准备工作可以在酶液提取的过程中进行,酶液提取时间2 h,预热反应8 min,酶解10 min,最后测定吸光度,检测时间5 min。分光光度法测定酶活,耗时158 min。因为反应底物浓度的变化由吸光度大小决定。所以无论成品曲液化力多少,反应时间都是固定的。
2.2 比较检测结果的准确度和精密度
将试验曲分别设为样品1 和样品2。为了比较两种检测结果的准确度和精密度,分别用传统法和分光光度法两种试验方法检测,即称为方法一和方法二。每种方法测定了7 组数据。测定结果见表1和表2。
2.2.1 准确度的比较
准确度是指测量值与真实值之间相符合的程度。准确度的高低常以误差的大小来衡量。即误差越小,准确度越高;误差越大,准确度越低。由于样本的真实值是不可知的,在日常分析工作中,需对试样作平行测定,取其算术平均值作为真实值。从表1 可知,用方法一测得样品1 液化力的平均值为0.432 g/g·h,可以作为方法一测得的真实值用于计算该组数据的相对误差。用方法二测得样品1酶活力的平均值为0.584 U/mL,可以作为方法二测得的真实值用于计算该组数据的相对误差。同理,表2 中样品2 液化力的平均值为0.251 g/g·h,酶活力的平均值为0.385 U/mL。均可作为这两组数据的真实值计算相对误差。相对误差是指误差在真实值中所占的百分率。相对误差的表示方法是:
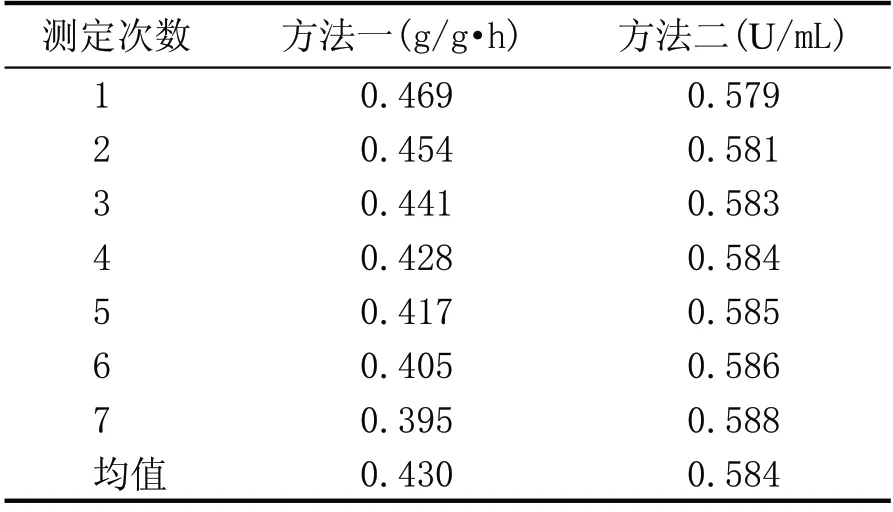
表1 样品1两种试验方法检测结果对照表

表2 样品2两种试验方法检测结果对照表

样品1 和样品2 两种方法测定相对误差结果对比柱形图见图2、图3。由图2 和图3 可以看出,无论是样品1 还是样品2,用传统检测法测定的相对误差值明显要比分光光度法大。也就是说分光光度法测定成品曲酶活力的准确度要显著高于传统测液化力方法。(注:柱形图的比较更具直观性,数据处理时按大小顺序排列,并非测量先后顺序。)
2.2.2 精密度的比较
精密度是指在相同条件下n 次重复测定结果彼此相符合的程度。精密度的大小用偏差表示,偏差愈小,说明精密度愈高。绝对偏差表示单个样本的精密度,用测定值减平均值来表示。

图2 样品1两种方法测定结果相对误差对比图

图3 样品2两种方法测定结果相对误差对比图
在数理统计中,一般测定次数有限,常用样本标准偏差来表示精密度,其数学表达式(贝塞尔公式)为:
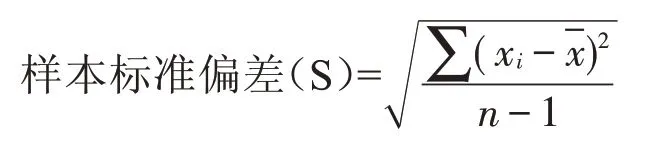
式中xi为单个样本值为样本平均值。(n-1)在统计学中称为自由度,意思是在n 次测量中,只有(n-1)个独立可变的偏差,因为n 个绝对偏差之和等于零,所以只要知道(n-1)个绝对偏差,就可以确定第n个的偏差值。
通过表3 和表4 的绝对偏差值(xi)代入贝赛尔公式计算。
样品1样本标准偏差(S)分别为:
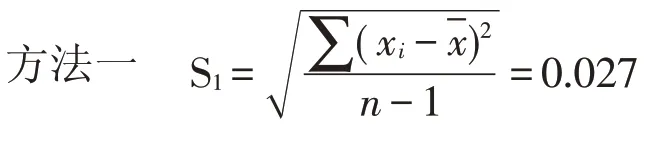
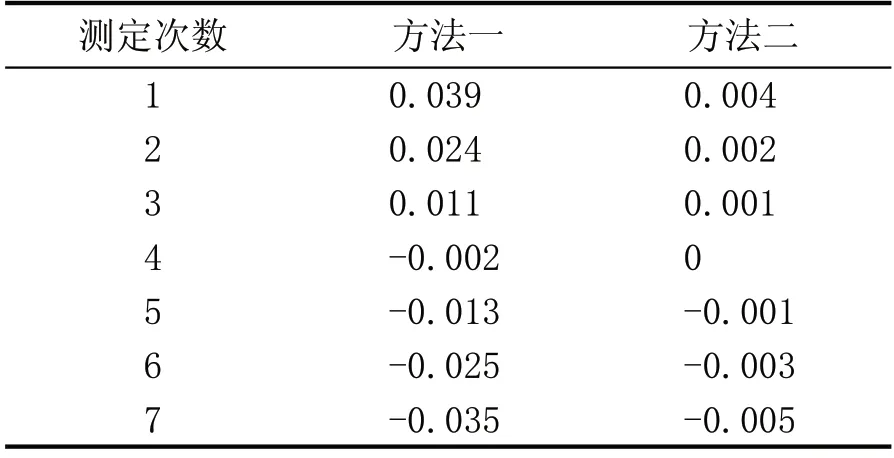
表3 样品1测定值绝对偏差对照表
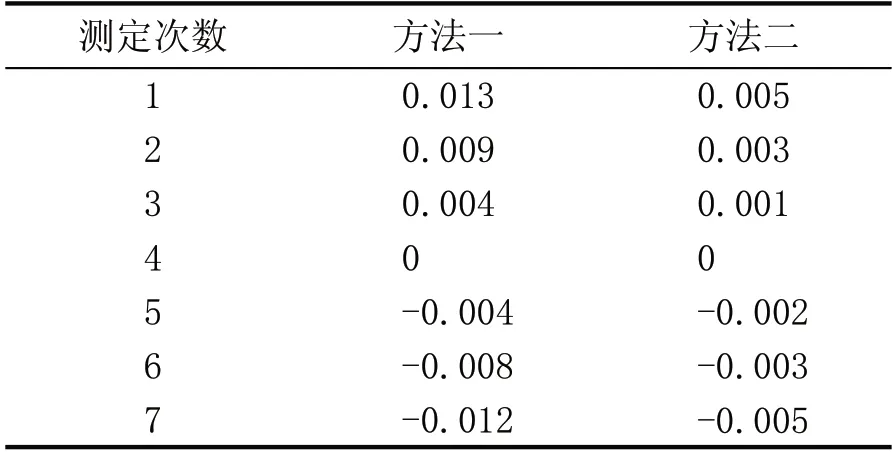
表4 样品2测定值绝对偏差对照表
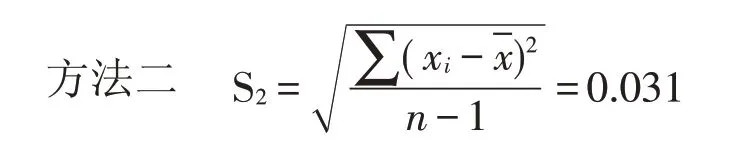
样品2的样本标准偏差(S)分别为:

比较两个样品分别用传统方法和分光光度法检测数据的样本标准偏差S1和S2可以说明使用分光光度法检测所得数据的精密度高。因为该组数据较集中并接近标准数据。由此可见,欲使准确度高,首先必须要求精密度也高,但精密度高并不说明准确度也高,因为可能在测定中存在系统误差,但精密度是保证准确度的先决条件。
3 讨论与结论
3.1 反应时间
分光光度法检测大曲粉酶活力反应时间需要158 min。传统液化力检测法反应时间和测试所用成品曲的液化力相关,合格曲的液化力检测时间在200~300 min 之间,液化力偏低的不合格曲的检测时间更长。两种检测方法反应原理相同,都是通过在一定温度下发生酶解反应,使碘遇淀粉呈现的蓝紫色反应逐渐消失,其颜色消失的速度与测定的液化酶活力是相关的。传统检测法需要等待淀粉酶将淀粉彻底酶解至蓝紫色消失,这与测试样的液化力相关,所以耗时长。而分光光度法则是让待测试样统一反应10 min后,利用分光光度计检测试样颜色深浅的变化,即利用试样颜色消失的速度来衡量酶活力的高低,通过反应后的吸光度计算酶活力。这样会大大缩短检测时间。
3.2 测定结果的准确度与精密度
通过图1 和图2 可知,传统检测法的相对误差要明显高于分光光度法。而准确度的高低用相对误差来衡量。所以分光光度法检测结果的准确度高于传统检测法。通过比较利用两种方法检测的样品1 和样品2 的样本标准偏差S1和S2可以说明,使用分光光度法检测所得数据的精密度高。因为传统检测法是定时取出一滴反应液于加入装有稀碘液的试管内,观察颜色变化,我们试验中是待颜色变浅时每隔2 min 测试一遍,测试也需要间隔时间,所以间隔时间不能再缩短,而遇到液化力大的试样,颜色变化极快,仍然会带来时间上的延迟误差。且肉眼观察,也会带来终点颜色的判断误差。而分光光度法可以避免上述误差的出现。
俗话说:“曲乃酒之骨。”大曲对白酒产量和质量起着决定性作用。其淀粉酶活力直接影响酒醅中淀粉的转化率及出酒率。准确测定大曲淀粉酶活力,生产中合理配比成曲用量至关重要。分光光度法测定酶活力相比传统液化力检测法既快速又准确。现代科技进步日新月异,先进的检测方法必将逐渐取代传统检测法。
