调节性T细胞在子痫前期中的作用
2019-11-11王伟嘉杜明月官秀婷李莉平
王伟嘉,杜明月,官秀婷,李莉平
(广州医科大学附属广州市第一人民医院妇产科,广东 广州 510180)
子痫前期(preeclampsia,PE)是一种妊娠期特有的高血压综合征,严重危害母婴安全。其表现为孕20周后出现的高血压和蛋白尿,严重时合并其他多器官系统病变,或胎儿生长受限[1]。全世界大约3%-8%的孕妇受到PE的威胁[2]。
免疫平衡在妊娠过程中扮演了重要的角色,成功的妊娠需要母体免疫细胞相互协调[3]。PE的发生和发展与先天免疫系统和适应性免疫系统中免疫细胞的数量或功能的变化有关[4]。有研究发现,炎性细胞因子如肿瘤坏死因子(tumor necrosis factor-α,TNF)-α、干扰素(interferon,IFN)-γ、白细胞介素(interleukin)-6、IL-17以及氧化应激等与PE的发生密切相关[5]。
调节性T (regulatory T,Treg)细胞是具有免疫调节功能的特定的CD4+T细胞子集。Treg细胞核内高表达转录因子叉头框p3 (forkhead box p3,Foxp3)[6]。Treg细胞还表达较高水平的CD25、细胞毒性T淋巴细胞白血病抗原4 (cytotoxic T-lymphocyte-associated protein 4,CTLA-4)[7],以及细胞因子TGF-β和IL-10等[8]。
大量研究表明,Treg细胞可能在母胎耐受和妊娠维持中具有重要作用[9-10]。然而Treg细胞在PE发病中作用尚未阐明。有研究表明,PE患者外周血Treg细胞较正常对照组数量减少,并且免疫调节功能下降[7,11]。然而,也有研究显示,PE孕妇外周血Treg细胞比率与正常对照组相比无明显差异[12]。研究报道,Treg细胞亚群的免疫抑制活性较健康孕妇显著降低[13-14]。此外,Sasaki等采用免疫组化研究方法[15]发现,PE患者蜕膜Treg细胞较健康孕妇明显减少。Gharesi-Fard等[16]发现蜕膜Treg细胞相关转录因子Foxp3的表达较健康孕妇降低。
迄今为止,鲜有研究同时探讨PE患者外周血、蜕膜和脐带血Treg细胞数量和细胞内因子水平。本研究采用流式细胞术,同时探讨PE患者外周血、蜕膜和脐带血Treg细胞占CD4+T细胞的比率及其细胞内TGF-β和IL-10水平,以期阐明Treg细胞在PE发生中的作用。我们研究发现,与正常孕妇比较,PE患者无论是外周血还是蜕膜Treg比率均显著下降,并且细胞内因子TGF-β和IL-10的水平也均明显降低。
1 材料和方法
1.1 病例
本研究通过了广州市第一人民医院伦理委员会的审批。受试者在参加研究之前均签署了知情同意书。实验组由2018年1月至2018年10月在广州医科大学附属广州市第一人民医院妇产科收治的10名PE患者组成。PE定义为妊娠20周后持续升高的血压(收缩压≥140 mmHg,或者舒张压≥90 mmHg)和蛋白尿(24小时尿蛋白≥300 mg或者尿蛋白/肌酐比值≥0.3)[17]。另外选取8名正常足月孕妇作为对照组,因社会因素要求剖宫产结束分娩。
妊娠孕周通过早期B超确认。排除既往高血压病史、多胎妊娠,妊娠合并其他原发性疾病,如糖尿病、内分泌疾病、自身免疫性疾病、心血管疾病、肾脏疾病以及肝脏疾病等。所有孕妇均未临产,并均采用剖宫产结束分娩。实验组和对照组临床特征见表1。
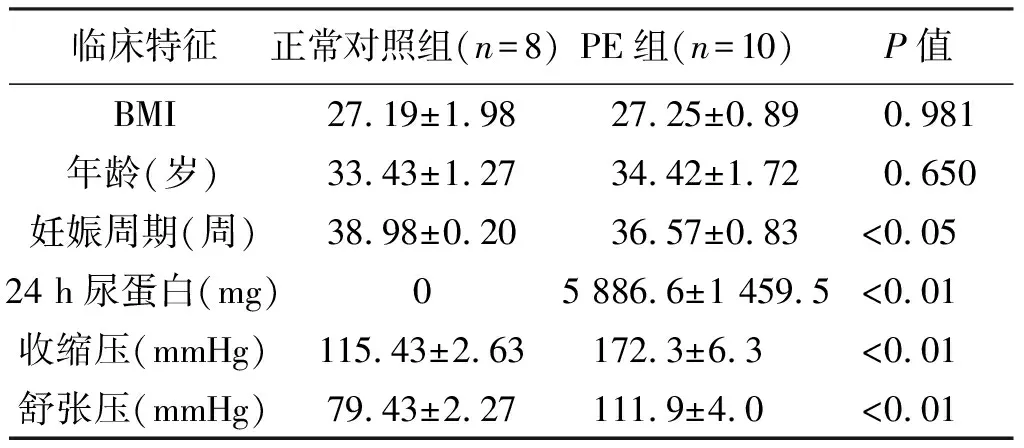
表1 孕妇临床特征
1.2 标本采集及处理
在孕妇手术前30分钟抽取外周血2 mL,乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA,BD Biosciences,San Jose,USA)抗凝。胎儿娩出后抽取脐静脉血2 mL,EDTA抗凝。在胎盘娩出后,用于无菌纱块擦拭胎盘附着处子宫壁,收集蜕膜组织,放置于预冷的含有10% 胎牛血清(fetal bovine serum,FBS,Hyclone,Los Angeles,USA)的RPMI 1640培养基(Hyclone,Los Angeles,USA)中。
1.3 外周血和脐带血单个核细胞的分离
外周血及脐带血标本使用RBC Lysis Buffer (Biolegend,San Diego,CA) 进行裂红处理,用PBS洗涤2次。使用6 mL50% Percoll分离液(Sigma-Aldrich,St.Louis,USA)重悬于15 mL离心管中,从底部缓慢加入3 mL70% Percoll分离液,800×g常温差速离心20 min。从中间层小心吸取单个核细胞,用PBS洗涤2次。用含10% FBS的RPMI 1640完全培养基重悬细胞,计数并调整细胞浓度为1×106/mL。
1.4 蜕膜单个核淋巴细胞的分离
使用眼科剪剪碎蜕膜组织<1 mm3大小后,将其加入15 mL工作浓度为1 mg/mL胶原酶Ⅳ(Collagenase IV,Gibco,California,USA)和工作浓度为0.01 mg/mL DNA酶(Thermo Scientific,California,USA)的RPMI 1640培养基制成的消化液中。在水平摇床上以37 ℃,60 r/min消化30 min。通过300目尼龙筛网过滤掉剩余组织至50 mL离心管,离心后以6 mL50% Percoll分离液重悬细胞至15 mL离心管,从底部缓慢加入3 mL70% Percoll分离液,800×g常温差速离心20 min。从中间层小心吸取单个核细胞,PBS洗涤2次,用含10% 的FBS的RPMI 1640培养基重悬细胞,调整细胞浓度为1×106/mL。
1.5 细胞培养和流式细胞术
将细胞加入20孔细胞培养板,1 mL/孔,每毫升加入终浓度分别为100 ng/mL的佛波酯(Phorbol 12-myristate 13-acetate,PMA,Biogems,USA)、500 ng/mL的离子霉素(Ionomycin,Biogems,USA)及5 μg/mL的布雷非德菌素A(Brefeldin A,BFA,Biolegend,San Diego,CA),在37 ℃、5%CO2培养箱避光培养4 h。收集细胞并洗涤,每106细胞与PerCP/Cy5.5标记的抗人CD4,FITC标记的抗人CD25及APC标记的抗人CD127 (Biolegend,San Diego,CA)室温避光孵育20 min。PBS洗涤2次,加入500 μL的固定液(Fixation Buffer,Biolegend,San Diego,CA),室温避光固定30 min。直接加入2 mL细胞内染色破膜缓冲液(Intracellular Staining Permeabilization Wash Buffer,Biolegend,San Diego,CA),放置2.5 min后,1 400 r/min,5 min离心2次。弃去上清,用50 μL Intracellular Staining Permeabilization Wash Buffer重悬细胞。与PE标记的抗人TGF-β及PE/Cy7标记的抗人IL-10 (Biolegend,San Diego,CA )室温避光孵育30 min。用Intracellular Staining Permeabilization Wash Buffer离心洗涤1遍,再用PBS洗涤1次。加入500 μL的固定液室温避光孵育30 min以固定细胞。同时设立与荧光标记的同型对照抗体温育的对照组。采用FACSCanto II流式细胞仪(BD Bioscience)检测Treg细胞(CD4+CD25+CD127-细胞)占CD4+细胞的百分率以及Treg细胞内TGF-β和IL-10的比率。全部样品采用FlowJo软件(FlowJo,LLC,Ashland,OR)进行分析。
1.6 统计分析

2 结果
2.1 外周血Treg细胞百分率以及Treg细胞内TGF-β和IL-10的阳性率
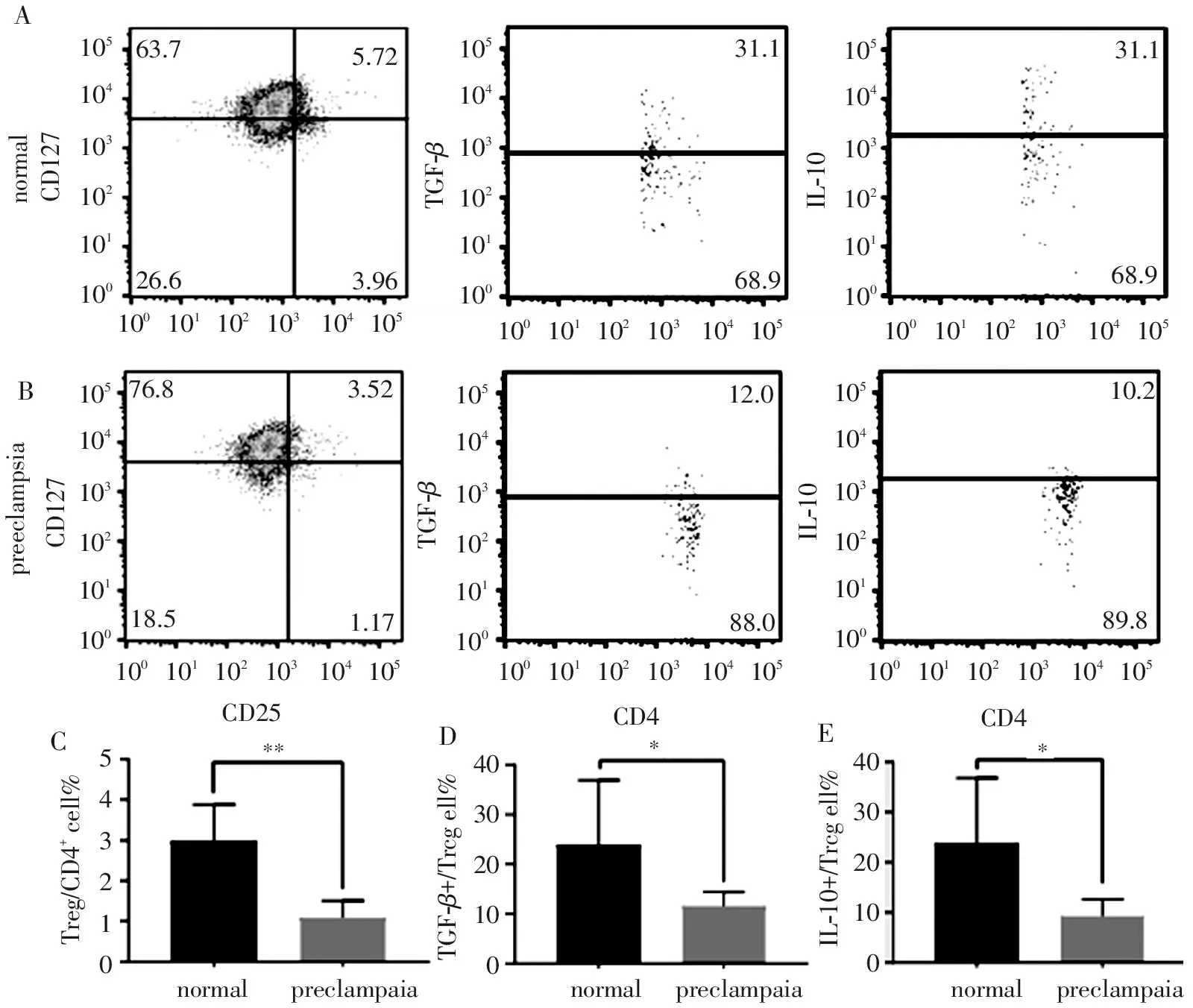
实验结果表明,相对于健康孕妇,PE患者外周血Treg细胞百分率显著降低(P<0.01,图1A-C)。另外,Treg细胞内TGF-β和IL-10的表达也显著降低(P均<0.05,图1B,D和E)。
63.75.7226.63.96105104103102101100CD127normal100101102103104105preeclampsiaCD127105104103102101100105104103102101100105104103102101100105104103102101100105104103102101100TGF-βTGF-βIL-10IL-10100101102103104105100101102103104105100101102103104105100101102103104105100101102103104105CD25CD4CD431.168.912.088.01.1718.576.83.5231.168.910.289.8543210Treg/CD4+cell%**normalpreclampaia*403020100TGF-β+/Trcgell%normalpreclampaianormalpreclampaia*403020100IL-10+/Trcgell%ABCDE
注:A和B分别代表正常孕妇和PE患者外周血Treg细胞占CD4+T细胞的百分率以及Treg细胞内TGF-β和IL-10的表达的流式图。独立样本t检验对比正常孕妇和PE患者外周血Treg细胞占CD4+T细胞的百分率(C)以及Treg细胞内TGF-β (D)和IL-10 (E)的表达。*P<0.05,**P<0. 01。
图1 外周血Treg细胞占CD4+T细胞的百分率以及Treg细胞内TGF-β和IL-10的表达
2.2 蜕膜中Treg细胞占CD4+ T细胞的百分率以及TGF-β、IL-10的比率
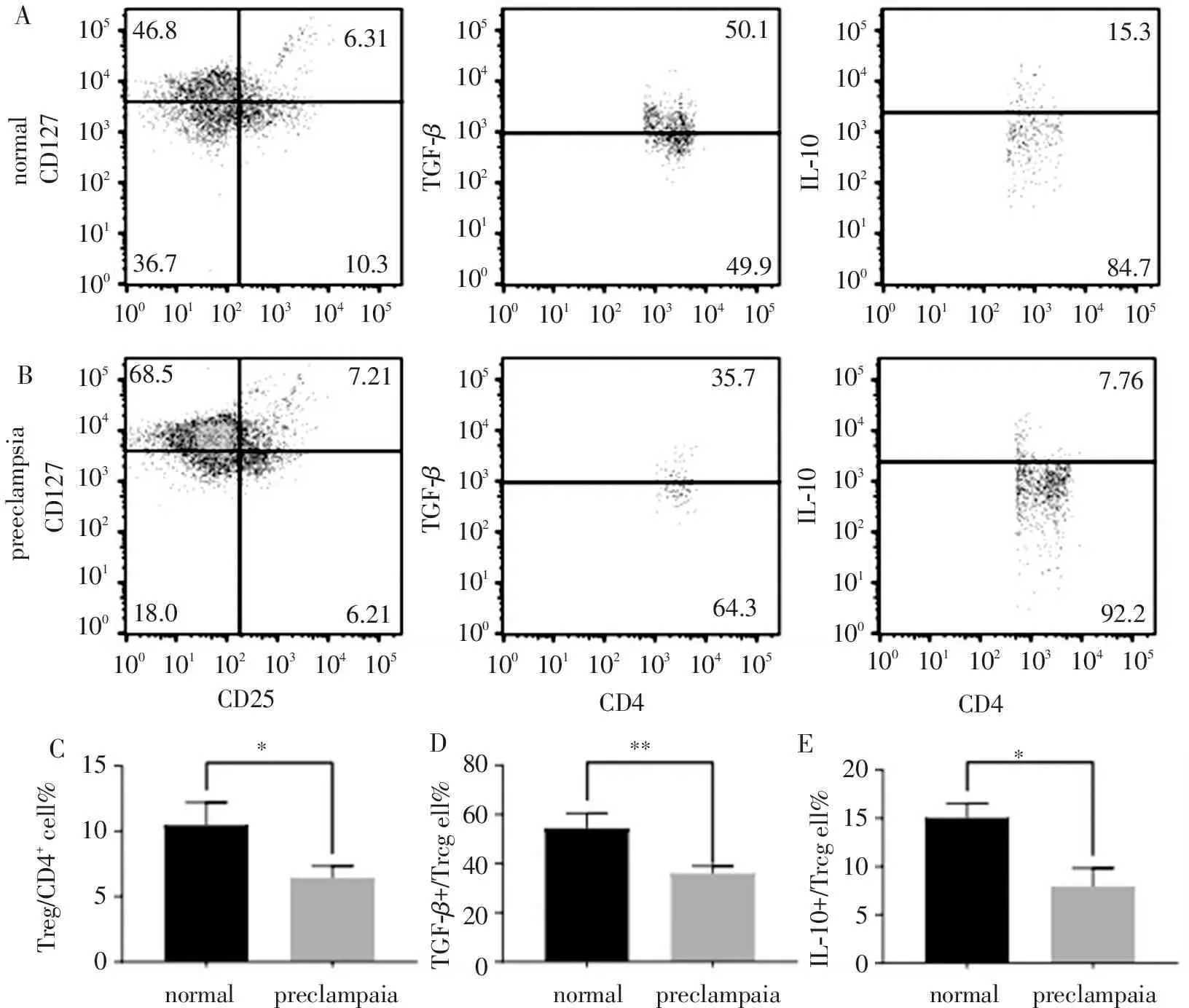
蜕膜所代表的母胎界面的免疫环境是直接影响胎儿健康的重要因素。实验结果表明,相对于健康孕妇,PE孕妇蜕膜Treg细胞百分率明显降低(图2C)。另外,PE孕妇蜕膜Treg细胞内TGF-β和IL-10的表达也明显降低(图2D,2E)。
2.3 脐带血Treg细胞占CD4+ T细胞的比率以及Treg细胞内TGF-β和IL-10的表达
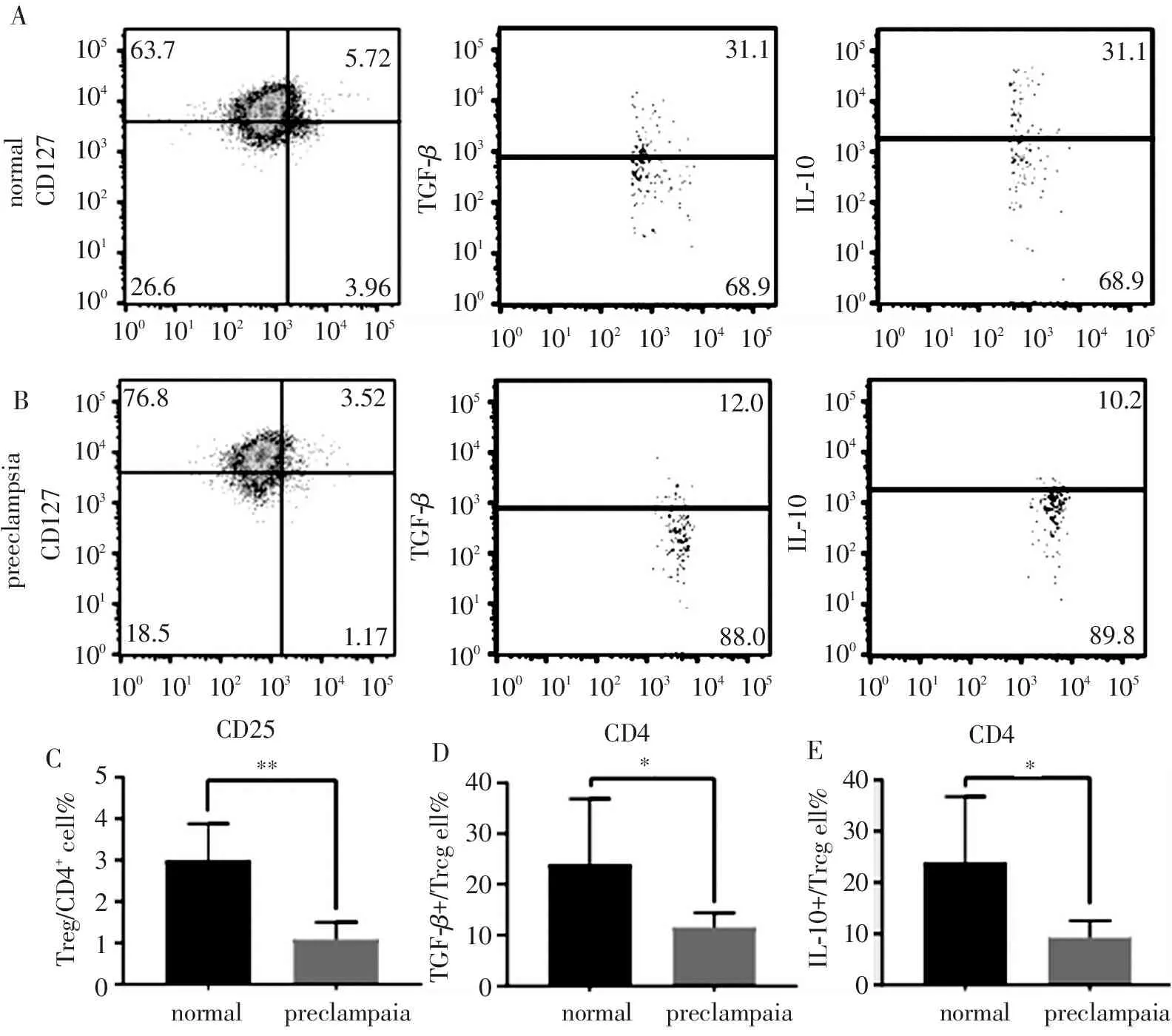
结果表明,PE患者脐带血中的Treg细胞在CD4+T细胞中的比率及其细胞内TGF-β和IL-10的阳性率与健康孕妇无显著差异。
3 讨论
本研究运用临床标记CD4+CD25+CD127-来代表Treg细胞,既往研究发现,CD4+CD25+CD127-Treg细胞与CD4+CD25+FOXP3+-Treg细胞流式分布相似,均发现在PE患者体内降低[18]。Banham等人[19]研究发现以Foxp3+为标准,CD127-表达与CD4+CD25+组合能够分选出更高纯度的Treg细胞。我们研究发现,PE患者外周血Treg细胞百分率均较正常对照明显减少。此结果与Darmochwal-Kolarz及Santner-Nanan等人的研究结论相同[7,20]。此外,我们还发现PE患者外周血Treg细胞内TGF-β和IL-10的表达较正常孕妇显著降低。目前暂未发现Treg细胞中TGF-β和IL-10水平的研究报道,既往研究都是检测母体血浆中TGF-β和IL-10等细胞因子,一些研究表明子痫前期母体循环中IL-10会降低[21-22],也有研究却发现无显著差异[23],有些研究者甚至发现IL-10升高[24]。血浆来源的TGF-β似乎在子痫前期中升高[25-26],另一项研究却发现无显著差异[27]。这些差异可能源于不同的实验方法或技术因素,另外细胞因子在人体内可能的脉冲式释放和半衰期短为检测体内细胞因子产生了障碍[28]。Darmochwal-Kolarz等[7]进行的Treg细胞分离及体外功能实验直接反映了Treg细胞的抑制功能受损。
46.86.3136.710.3105104103102101100CD127normal100101102103104105preeclampsiaCD127105104103102101100105104103102101100105104103102101100105104103102101100105104103102101100TGF-βTGF-βIL-10IL-10100101102103104105100101102103104105100101102103104105100101102103104105100101102103104105CD25CD4CD450.149.935.764.36.2118.068.57.2115.384.77.7692.2151050Treg/CD4+cell%**normalpreclampaia*806040200TGF-β+/Trcgell%normalpreclampaianormalpreclampaia*20151050IL-10+/Trcgell%ABCDE
A和B分别代表正常孕妇和PE患者蜕膜Treg细胞占CD4+T细胞的百分率以及Treg细胞内TGF-G和IL-10的表达的流式图。独立样本t检验对比正常孕妇和PE患者蜕膜Treg细胞占CD4+T细胞的百分率(C)以及Treg细胞内TGF-β (D)和IL-10 (E)的表达。*P<0.05,**P<0. 01。
图2 蜕膜Treg细胞占CD4+T细胞的百分率以及Treg细胞内TGF-β和IL-10的表达
63.75.7226.63.96105104103102101100CD127normal100101102103104105preeclampsiaCD127105104103102101100105104103102101100105104103102101100105104103102101100105104103102101100TGF-βTGF-βIL-10IL-10100101102103104105100101102103104105100101102103104105100101102103104105100101102103104105CD25CD4CD431.168.912.088.01.1718.576.83.5231.168.910.289.8543210Treg/CD4+cell%**normalpreclampaia*403020100TGF-β+/Trcgell%normalpreclampaianormalpreclampaia*403020100IL-10+/Trcgell%ABCDE
A和B分别代表正常孕妇和PE患者脐带血Treg细胞占CD4+T细胞的百分率以及Treg细胞内TGF-β和IL-10的表达的流式图。独立样本t检验对比正常孕妇和PE患者脐带血Treg细胞占CD4+T细胞的百分率(C)以及Treg细胞内TGF-β (D)和IL-10 (E)的表达。
图3 脐带血Treg细胞占CD4+T细胞的百分率以及Treg细胞内TGF-β和IL-10的表达
本研究发现, PE孕妇蜕膜中Treg细胞百分率和Treg细胞内TGF-β和IL-10比率较正常孕妇显著降低。与我们研究类似,Jung等[29]和Hsu等[18]分别利用免疫组化和流式细胞术皆证实PE患者蜕膜Treg细胞百分率较正常对照显著下降。Gharesi-Fard也发现PE患者蜕膜Foxp3基因的表达较正常对照显著下降[16]。此外,我们还发现,PE患者蜕膜Treg细胞内TGF-β和IL-10的比率较正常对照显著减少,说明PE患者母胎界面Treg细胞的免疫调节功能受损。多项研究也表明母胎界面TGF-β和IL-10水平降低[30-31]。而且CD4+T细胞向Treg细胞的分化需要高水平的TGF-β[8],TGF-β的分泌减少进一步影响Treg细胞的生成。
既往研究发现,正常孕妇脐带血Treg细胞比率差异较大[32-33]。我们研究发现,PE患者脐带血Treg细胞约占CD4+T细胞的6%,与正常对照组无明显差异。我们研究结果与Prins等[34]的研究结果类似。与此相反,El-Chennawi等[35]研究发现,PE患者脐带血中Treg细胞的比率相对于正常孕妇显著降低。我们尚不清楚研究结果不同的原因,可能与病例的选择或实验手段的不同相关。此外,我们还发现,脐带血Treg细胞内TGF-β和IL-10比率与正常对照组也无显著差异。
研究表明,Treg细胞在妊娠维持和母胎耐受中具有重要作用[36]。其产生的免疫调节因子IL-10和TGF-β可以通过抑制特定的NK表型和炎性细胞因子的分泌[37],促进Treg细胞的分化,以及抑制Th17细胞的分化发挥免疫调节作用[38]。
我们研究发现,PE患者无论是外周血还蜕膜Treg细胞百分率及其细胞内TGF-β和IL-10水平均较正常孕妇下降,说明PE患者系统和母胎界面的Treg细胞数量和功能均受到显著抑制,鉴于Treg细胞在母胎耐受和妊娠维持中的作用,我们推测Treg细胞数量和功能抑制可能在PE的发生中具有一定作用。此外,我们并未发现PE患者的脐带血Treg细胞比率和细胞内因子水平与对照组存在明显差异。结果说明,胎儿来源的Treg细胞可能在PE的发生中并不起主要作用。鉴于PE患者试图通过期待疗法延长孕周,可能导致胎儿死亡和孕产妇并发症增加的风险[39],本研究选用的病例在妊娠周期有差异性,需要进一步探究妊娠晚期Treg细胞的差异性。
