β3肾上腺素能受体上调对慢性心力衰竭大鼠左心室p38 MAPK表达的影响
2019-11-11关信民张小梅王淑香李彪何芸魏远玲曾芳赵强
关信民,张小梅,王淑香,李彪,何芸,魏远玲,曾芳,赵强*
(1.广州市红十字会医院,暨南大学医学院附属广州市红十字会医院急诊科,广东 广州 510220;2.广州医科大学附属顺德医院心内科,广东 佛山 528315;3.广州市花都区人民医院ICU,广东 广州 510800;4.广州市红十字会医院,暨南大学医学院附属广州市红十字会医院心内科,广东 广州 510220)
左心室重构是慢性心力衰竭(chronic heart failure,CHF)发生发展的主要病理基础。β3肾上腺素能受体(β3受体,β3-adrenergic receptor,β3-AR)属于G蛋白偶联受体(G protein-coupled receptors,GPCRs)超家族,由一个细胞外糖基化的氨基末端(N)、一个细胞外的羟基末端(C)和三个细胞内环、细胞外环连接的七个疏水跨膜区组成[1]。研究证实,与抑制型G蛋白(inhibitory G protein,Gi)偶联的β3-AR参与了CHF的心室重构和心室功能下降[2,3]。分裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)家族是信号转导过程中一组主要的信号分子,作为MAPK家族重要的成员酶,p38 MAPK在心肌肥厚、心室重构、心肌细胞凋亡中发挥着重要的作用[4-6]。研究提示β-AR可能与MAPK偶联参与心室肥厚[7,8]。本研究拟在前期研究基础上,通过建立CHF大鼠模型及在此基础上心室β3-AR进一步上调的大鼠模型,初步探讨CHF大鼠左心室β3-AR上调是否对p38 MAPK表达水平产生影响。
1 材料与方法
1.1 实验动物
12周龄的雄性Wistar大鼠18只,体质量为230~250 g,由广东省医学实验动物中心提供,实验期间笼养于暨南大学实验动物中心。
1.2 药物
BRL-37344(美国Sigma公司);注射用青霉素钠(中国哈药集团制药总厂)。
1.3 主要试剂
兔抗大鼠磷酸化-p38 MAPK多克隆抗体(p-p38 MAPK)(英国Abcam公司);辣根过氧化物酶标记山羊抗兔IgG(美国Bioworlde公司);二氨基联苯胺(DAB)显色试剂盒(中国LG公司);苏木素染液(中国上海化学试剂有限公司);Trizol试剂盒(美国Invitrogen公司);逆转录系统(美国Promega公司);磷酸缓冲盐溶液(PBS)(中国武汉博士德生物工程有限公司);喹啉酸(BCA)法蛋白含量测定试剂盒(中国南京凯基生物发展有限公司);RIPA细胞裂解液(中国上海BestBio贝博生物);苯甲基磺酰氟(PMSF)蛋白酶抑制剂(中国上海BestBio贝博生物);十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒(中国上海碧云天生物技术研究所);生物素标记的分子量Marker(10~100 KD)(美国FERMETAS公司);β-微管蛋白(Tublin)、5%牛血清白蛋白、ECL显影剂均购自美国Bioworlde公司。
1.4 主要仪器
BL-420生物机能实验系统(中国四川成都泰盟科技有限公司);倒置光学显微镜摄影系统(日本Olympus公司);病理图像分析系统(德国Leica公司);核酸蛋白分析仪(美国Beckman公司)电泳仪、微型电转移装置、电泳槽、凝胶成像分析系统均购自美国Bio-Rad公司。
1.5 方法
1.5.1动物模型制作及分组 Wistar大鼠随机分为假手术组(n=6)和模型组(n=12)。采用腹主动脉缩窄法建立CHF大鼠模型[2]。大鼠经腹腔注射10%水合氯醛(300 mg/1 kg)麻醉后,钝性分离腹主动脉,于左肾动脉与腹主动脉分叉上方2 mm处将腹主动脉与9号钝头探针(外径为0.8 mm)一起结扎,小心抽出针头,结扎线留置,以持续缩窄腹主动脉。假手术组进行假手术处理,但不予腹主动脉缩窄。大鼠缝合腹腔时均经腹腔注射青霉素钠以预防感染。饲养12周后,假手术组大鼠全部存活,模型组大鼠死亡1只。11只大鼠再分为CHF组(n=5)和BRL组(n=6)。BRL组大鼠经尾静脉注射BRL-37344(0.4 nmol/kg/min),每次持续10 min,每周2次,共4周;假手术组、CHF组大鼠经尾静脉注射同等剂量的生理盐水。4周后三组大鼠均全部存活。
1.5.2血流动力学检测 10%水合氯醛(300 mg/kg)腹腔注射麻醉大鼠,经右颈总动脉插管(传感器)入左心室,应用BL-420生物机能实验系统进行血流动力学检测。待大鼠稳定10 min后,测定左心室收缩末压(left ventricular end systolic pressure,LVESP)、左心室舒张末压(left ventricular end diastolic pressure,LVEDP)、左心室内压最大上升速率(the maximal rate of rise of left ventricular pressure,+dp/dtmax)及左心室内压最大下降速率(the maximal rate of fall of left ventricular pressure,-dp/dtmax)。所有指标均取10个心搏的平均值。
1.5.3心脏称重、HE染色及免疫组化 过量乌拉坦处死大鼠后,测体质量。开胸取出心脏,小心分离出左心室。用电子天平(精确到0.01 mg)称取左心室(包括室间隔)湿质量(left ventricular absolute mass,LVAM,mg),与体质量(g)相除,得到左心室质量指数(the index of left ventricular mass,LVMI)。左心室组织4%多聚甲醛固定24 h。取出标本,流水冲洗15 min,切取合适大小组织块(厚度约0.2 cm)。乙醇、二甲苯脱水和透明后,石蜡包埋并切片。标本进行HE染色和镜检。标本经脱蜡、水化、抗原修复后,分别滴加p-p38 MAPK一抗和二抗孵育,经DAB显色和复染后,脱水、透明、封固、镜检。
1.5.4逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction, RT-PCR) 采用二步法RT-PCR测定大鼠左心室β3-AR mRNA表达。按照Trizol试剂盒提取大鼠左心室总RNA,核酸蛋白分析仪计算总RNA浓度。取总RNA 2 μL经逆转录系统合成cDNA。β3-AR(444 bp)引物设计参照既往试验方法[3],由上海生工生物工程股份有限公司合成。引物序列:上游5’-AGT GGG ACT CCT CGT AAT G-3’,下游5’-CGC TTA GCT ACG ACG AAC-3’。以β-actin(187 bp)作为内参照,引物序列为:上游5’-GAC AAC GGC TCC GGC ATG TG-3’,下游5’-TGA GGA TGC CTC TCT TGC-3’。cDNA扩增经94 ℃ 3 min,40个循环(94 ℃ 45 s,60 ℃ 45 s,72 ℃ 60 s),72 ℃ 10min。取7 μL PCR产物经2%琼脂糖凝胶电泳,凝胶成像分析系统分析、计算mRNA表达的强度。
1.5.5蛋白免疫印迹法 剪取左心室冷冻组织0.1 g,PBS缓冲液冲洗。加入2 mL细胞裂解液,剪碎组织并加入液氮充分研磨,提取组织液至离心管。将含有组织液的离心管置冰上裂解30 min,裂解液移至离心管中,然后在4 ℃下12 000 r/min离心8 min,取上清分装于0.5 mL离心管中并置于-20 ℃冰箱中保存。采用BAC法测定样本蛋白浓度。根据目的蛋白的分子量选取配制12%的分离胶及5%的浓缩胶,样本每孔上样20 μL、Marker 5 μL,进行SDS-PAGE电泳。卸胶、剪取硝酸纤维素膜。将凝胶、硝酸纤维素膜、转膜滤纸放入转膜台进行转膜。取膜后,5%牛血清白蛋白室温封闭2 h。TBST缓冲液洗膜10 min,3次;加入一抗(1∶1 000)、内参(15 000),4 ℃摇床中孵育过夜。次日TBST缓冲液洗膜10 min,3次;加入二抗(1∶5 000),室温下摇床中孵育1 h。将ECL显影剂滴加于硝酸纤维素膜上孵育5 min。暗室下,采用Quality图像分析系统对图片进行分析。以β-Tublin(分子量: 55 kD)作为内参照,计算p-p38MAPK(分子量: 41 kD)与β-Tulblin积分光密度值。
1.6 统计学方法

2 结果
2.1 3组大鼠血流动力学指标及LVMI的比较
与假手术组比较,CHF组和BRL组大鼠的LVESP、±dp/dtmax的绝对值均显著降低(P<0.01),LVEDP显著升高(P<0.01)。与CHF组比较,BRL组LVESP、±dp/dtmax绝对值降低(P<0.01),LVEDP升高(P<0.05) ,见表1。
3组大鼠体质量比较,差异无统计学意义 (P>0.05)。与假手术组(1.680±0.078)比较,CHF组(2.596±0.017)及BRL组(2.733±0.045)大鼠LVMI均显著增加(均P=0.000);BRL组大鼠LVMI显著高于CHF组(P=0.003)。

表1 三组大鼠左心室血流动力学指标比较
注:LVESP:左心室收缩末压,LVEDP:左心室舒张末压,+dp/dtmax:左心室内压最大上升速率,-dp/dtmax:左心室内压最大下降速率。与假手术组比较,aP<0.001;与CHF组比较,bP<0.01,cP<0.05。
2.23组大鼠HE染色及免疫组化结果
HE染色显示,假手术组大鼠左心室肌细胞排列整齐,无细胞水肿及坏死;CHF组大鼠心肌细胞可见明显水肿,细胞排列紊乱,肌纤维断裂;BRL组大鼠心肌细胞水肿进一步加重,细胞明显肥大,肌纤维断裂(图1)。免疫组织化学染色显示,3组大鼠左心室肌组织中均有p-p38 MAPK表达,其表达部位在细胞核中(图2)。

假手术组CHF组BRL组
图1 3组大鼠左心室肌组织HE染色结果(×20)

假手术组CHF组BRL组
图2 免疫组织化学法检测3组大鼠左心室肌组织p-p38MAPK表达(上图×10,下图×20)
2.3 3组大鼠左心室β3-AR mRNA 表达
RT-PCR结果显示,3组大鼠左心室组织中均有β3-AR表达(图3)。与假手术组(0.611±0.169)比较,CHF组(1.442±0.143)和BRL组(1.906±0.079)大鼠左心室β3-AR mRNA表达水平均上调(均P=0.000);其中BRL组大鼠β3-AR表达水平较CHF组显著升高 (P=0.001)。
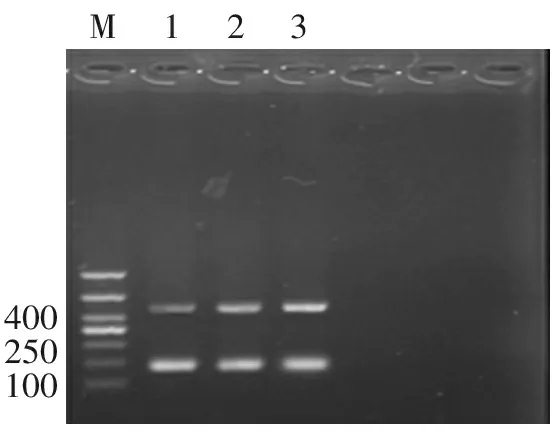
400250100M123
M:marker;1:假手术组,2:CHF组,3:BRL组;上条:β3-AR,下条:β-actin
图3 大鼠左心室肌组织β3-AR mRNA表达
2.4 3组大鼠蛋白免疫印迹检测结果
蛋白免疫印迹结果显示,3组大鼠左心室组织中均有p-p38MAPK表达(图4)。与假手术组(0.328±0.023)比较,CHF组(0.634±0.054)和BRL组(0.689±0.031)大鼠左心室p-p38MAPK表达水平均升高(均P=0.000),其中BRL组大鼠p-p38MAPK表达水平较CHF组有升高的趋势,但差异无统计学意义(P=0.065)。
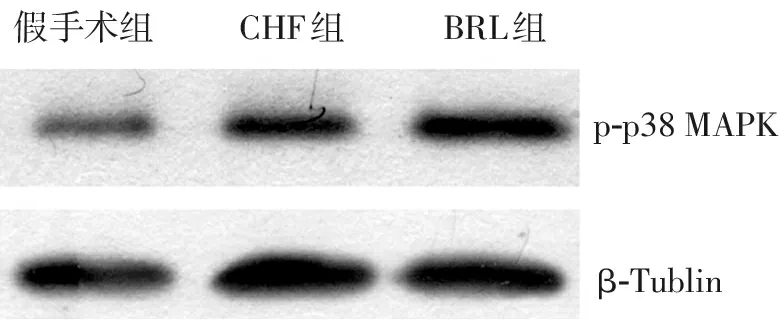
p-p38MAPKβ-Tublin假手术组CHF组BRL组
图4 3组大鼠左心室肌组织p-p38 MAPK蛋白表达
3 讨论
β3-AR作为G蛋白偶联受体超家族的成员,在心室内偶联于Gi-NO-cGMP信号通路。在CHF早期 β3-AR 代偿性上调可能是为阻止 β1-AR、 β2-AR 的过度刺激,避免心肌细胞进一步损伤的一种补救途径。但CHF进展至晚期,β3-AR持续增多,加之 β3-AR不会因长期激动剂刺激而脱敏[9],这种代偿机制将失衡,持续的负性肌力作用导致心功能的进展性恶化,在循环儿茶酚胺增加时这种作用更明显,目前认为 β3-AR 也是治疗的靶点[10,11]。
β3-AR的负性肌力作用参与了心室重构和心功能恶化,主要机制为β3-AR激动抑制L型Ca2+通道电流(L-type calcium current,Ica,L)或钙瞬变[12,13]。非选择性β-AR激动剂异丙肾上腺素使豚鼠心室肌细胞Ica,L密度增加210%;但在BRL-37344(10-7mol/L)存在的情况下,Ica,L密度仅有对照组的58%[12]。Zhao等[2]的研究采用主动脉缩窄法建立CHF大鼠模型,与假手术组比较,CHF大鼠LVMI及右心室质量指数均显著增加(P<0.01);左心室、右心室β3-AR mRNA表达有2~3倍上调(P<0.01),且β3-AR表达与心室质量指数呈正相关。CHF大鼠尾静脉注射BRL-37344进一步加重了心脏重构:左心房内径,左心室舒张末内径(LVEDD)、收缩末内径(LVESD),舒张期室间隔及左心室后壁厚度,左心室质量均显著增加(P<0.05或0.01);左心房射血分数、左心室射血分数(left ventricular ejection fraction,LVEF)、左心室短轴缩短率(fraction shortening,FS)均显著降低(P<0.05或0.01)[14]。Kayki-Mutlu等[15]的研究以糖尿病大鼠为研究对象,结果发现BRL-37344呈剂量依赖性的降低LVDP、±dp/dtmax;此效应可以被SR 59230阻断;同时,心肌Giα2 mRNA表达上调。Montaudon等[16]选取Lewis大鼠为研究对象,结果发现选择性β3-AR激动剂SR 58611A显著减少左心室肌细胞缩短率(39.71±4.9%,P<0.05),此效应可以被Gi蛋白抑制剂百日咳毒素阻断。β3-AR激动显著增加LVEDD (P<0.05)。β3-AR表达上调的同时,±dp/dtmax、左心室发展压(left ventricular developed pressure,LVDP)均显著下降(P<0.05)。Zhang等[3]的研究选择2型糖尿病大鼠,结扎左前降支建立心肌梗死模型。与假手术组比较,心肌梗死大鼠LVEDD、LVMI显著增加(P<0.05),LVEF及左心室后壁收缩期增厚率显著降低(P<0.01);免疫组化显示心肌胶原容积分数(CVF)显著增加(P<0.05)。同时,心肌β3-AR和Gi蛋白表达水平显著增加。景佳妮等[17]结扎SD大鼠左前降支建立心肌梗死模型,术后4周发生心力衰竭(心衰)的大鼠,随机接受腹腔注射选择性β3-AR阻滞剂SR 59230A或生理盐水。结果显示SR 59230A使心衰大鼠心肌细胞排列紊乱和心肌纤维断裂减轻,炎性细胞减少。本研究中,BRL-37344进一步上调大鼠衰竭心室肌β3-AR mRNA表达,伴随着大鼠左心室血流动力学指标进一步恶化。同时,BRL-37344使CHF大鼠衰竭左心室肌的病理学改变进一步加重。因此,β3-AR激动进一步加重了CHF大鼠心室重构和功能下降。
p38 MAPK激活在心脏重构中起着重要作用。双特异性磷酸酶14(Dusp14)是MAPK通路重要的负向调节因子。Li等[18]的研究选择Dusp14基因敲除大鼠和心脏特异性表达Dusp14的转基因大鼠,以野生型大鼠为对照,主动脉缩窄法建立心肌肥厚模型。结果发现,Dusp14基因敲除大鼠心脏质量指数,左心室胶原含量及间质CVF显著增加;LVEDD、LVESD显著增加,LVEF及FS显著降低;心肌纤维化标志物如I型胶原蛋白、III型胶原蛋白、结缔组织生长因子表达水平显著上调。而在心脏特异性表达Dusp14的转基因大鼠中,主动脉缩窄导致的心脏重构、纤维化及收缩功能下降会减轻。同时,与野生型大鼠比较,Dusp14基因敲除大鼠心肌p-p38 MAPK蛋白表达显著上调;而在心脏特异性表达Dusp14的转基因大鼠,主动脉缩窄上调心肌p-p38 MAPK表达的作用会减弱。β-AR信号通路刺激可激活一系列压力激活的蛋白激酶,其中就包括p38 MAPK,β-AR激动可通过介导p38 MAPK 参与心室重构[19,20]。Peter等[19]的研究发现,心脏过表达β1-AR或β2-AR的小鼠,均出现心率明显增快,LVEDD、LVESD显著增加,LVEF及FS显著降低;LVMI、心肌细胞凋亡及间质纤维化显著增加。在p38α MAPK显性负性突变体转基因小鼠中,心脏过表达β2-AR对心脏重构、收缩功能、心肌细胞凋亡及间质纤维化的效应会被减弱。另一项研究显示,下调p38 MAPK表达,可减轻异丙肾上腺素诱导的CHF大鼠心室重构,改善收缩和舒张功能[21]。
本研究结果显示,CHF组和BRL组大鼠左心室p-p38 MAPK蛋白表达水平均高于假手术组(均P<0.01);BRL组大鼠p-p38 MAPK表达水平较CHF组有升高的趋势,但差异无统计学意义(0.689±0.031 vs 0.634±0.054,P=0.065)。分析原因可能为:①β3-AR激动可能不偶联于p38MAPK信号通路。②选择的研究对象不同,CHF大鼠尾静脉注射BRL-37344上调心室β3-AR表达、表达人β3-AR的仓鼠卵巢细胞亚株[22],或原代培养的支持细胞[23]等;不同的β3-AR特异性激动剂激活p38 MAPK可能具有不同的效能[22];β3-AR可能尚与激动型G蛋白(stimulatory G protein,Gs)-环磷酸腺苷(cyclic adenosine monophosphate,cAMP)-蛋白激酶A(protein kinase A,PKA)通路偶联[24]等原因。
综上所述, BRL-37344进一步加重CHF大鼠左心室重构和功能下降,上调了β3-AR的表达,但β3-AR激动可能对p38 MAPK表达无明显影响。下一步可通过选择不同β3-AR激动剂、分离大鼠心室肌细胞等方法继续研究,以明确CHF时β3-AR激动是否与MAPK信号通路存在关联。
