猪重要病毒性病原多重PCR检测方法建立及应用
2019-11-11王朋冲姜艳芬周宏超李春燕李鑫鑫罗丽华郭抗抗
王朋冲,姜艳芬,周宏超,李春燕,李鑫鑫,罗丽华,冯 秀,郭抗抗
(西北农林科技大学动物医学院,陕西杨凌712100)
目前对养猪业危害最大的主要是病毒性传染病,常见的病原有猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2),伪狂犬病病毒(PRV)和猪细小病毒(PPV)等。CSFV引发的猪瘟(CSF)是猪的一种高度传染性病毒性疾病,传染性强、死亡率高、经济损失大[1-2];PPV能引起母猪产死胎、弱胎、木乃伊胎,感染猪场会经常出现母猪繁殖失败的现象[3]。PRV、PCV2、PRRSV除了导致感染发病猪死亡外,还会造成猪群隐性感染,猪群长期带毒[4]。临床上准确检测这些病毒是对其有效防控的基础,目前猪群很少存在单一病原感染的情况,多种病原的混合感染或继发感染较为常见[5-6]。病毒检测常用的实验室方法有病毒的分离鉴定、血清学检测、免疫学检测、分子生物学检测等。分子生学技术由于具有快速、操作简单、结果可靠、敏感性高等优势,在畜禽病毒检测中广泛应用,应用最多的是聚合酶链式反应(PCR)技术,以及在其基础上发展产生的各项技术,如反转录PCR、多重PCR、实时定量PCR等[7]。多重PCR技术就是在一个反应体系中加入针对不同病原的特异性引物,可以实现一个反应检测多个病原的目的,具有高通量检测的优势而被广泛的应用于病原的检测[8-9]。
在猪场疾病防控和调研工作中,我们发现一些猪场存在多种病毒感染的情况,主要有CSFV、PRRSV、PCV2、PRV和PPV,需要建立快速、敏感的检测方法。结合对猪场病毒性病原感染情况的调查,针对猪场和基层单位技术能力,分别建立了核酸为RNA的CSFV和PRRSV的双重RT-PCR检测方法,核酸为DNA的PCV2、PRV和PPV的三重PCR检测方法,为这些病毒的快速、大批量检测提供了可供选择的方法。
1 材料与方法
1.2 病毒和血清样品 猪瘟病毒石门株灭活毒、PRRSV美洲株、PRV、PPV、PCV2、猪流行性腹泻病毒(PEDV)和猪传染性胃肠炎病毒(TGEV)均由西北农林科技大学动物医学院兽医公共卫生学科研实验室提供。陕西省部分猪场血淸118份,可分为陕南地区58份、陕北地区30份、关中地区30份。-80 ℃保存。
1.3 方法
1.3.1 引物的设计与合成 从GenBank上下载CSFV、PRRSV、PCV2、PRV、PPV的不同来源分离株全基因序列,通过DNAStar软件对各种病毒的分离株序列进行比对分析,选择不同病毒保守的基因序列。以筛选的病毒保守序列为模板,用Primer5软件分别设计了这5种病毒的特异性引物。引物由华大基因科技服务有限公司合成。引物信息见表1。
1.3.2 病毒核酸提取和cDNA合成 按照TIANGEN公司DNA提取试剂盒说明书操作,分别提取PCV2、PRV和PPV等3种病毒细胞培养物的总DNA。用TRIZol法分别提取CSFV和PRRSV细胞培养物中的总RNA,用Thermo Fisher Scientific反转录试剂盒对所提取的RNA进行反转录,合成cDNA。

表1 所用引物序列
1.3.3 CSFV和PRRSV双重RT-PCR方法的建立
1.3.3.1 CSFV、PRRSV cDNA的PCR扩增 以合成的CSFV、PRRSV的cDNA为模板,分别建立扩增CSFV、PRRSV的PCR方法。PCR反应体系为20 μL:包括2×TaqMasterMix 10 μL,ddH2O 7 μL,上、下游引物各1 μL(终浓度均为0.25 pmol/μL),cDNA 1 μL。PCR扩增条件为:94 ℃ 3 min;94 ℃ 30 s;60 ℃ 45 s;72 ℃ 30 s,35个循环;72 ℃ 10 min。取10 μL PCR产物进行琼脂糖电泳后观察结果。将获得的符合预期大小的条带进行胶回收,与pMD19-T载体连接,阳性质粒送华大基因科技服务有限公司(北京)测序。
1.3.3.2 CSFV和PRRSV双重PCR反应条件的筛选 首先确定最适的双重PCR退火温度,PCR反应体系为20 μL:包括2×TaqMaster Mix 10 μL,ddH2O 5 μL,CSFV和PRRSV上、下游引物各1 μL(终浓度0.25 pmol/μL),cDNA 1 μL。PCR扩增条件:94 ℃ 3 min;94 ℃ 30 s;退火温度分别设定为54 ℃、56 ℃、58 ℃、60 ℃、62 ℃,45 s;72 ℃ 30 s,35个循环;72 ℃ 10 min。取10 μL PCR产物进行琼脂糖电泳,观察结果。
除了上机课在电脑前操作电脑进行学习,还有什么方式可以辅助教学呢?伴随信息化的深入发展,陆陆续续出现了多种移动环境下即时互动教学新模式。教师在移动平台上发送通知、分享资源、布置作业、批改作业、组织讨论答疑、开展教学互动。学生也可在手机上轻轻松松地完成作业,参与讨论,而且即刻反馈,即刻点评。平时主要用于了解学生“计算机应用基础”的理论知识的掌握程度。在平台上发布选择题作业,学生利用课余时间登录完成作业,系统即刻根据学生的完成情况给予评分,并对错误进行解析。同时,后台生成数据,教师也可轻松获得学生对知识点的掌握情况的数据分析。根据获得的数据,教师就能够在课堂上进行更有针对性的复习与指导工作。
在确定双重PCR最适退火温度的基础上,对引物最适终浓度进行筛选。反应体系及条件同前,将每条引物的终浓度分别调整为0.2 pmol/μL、0.3 pmol/μL、0.4 pmol/μL、0.5 pmol/μL,进行PCR扩增,筛选出最适引物使用量。
1.3.3.3 双重PCR的特异性和敏感性 分别以CSFV、PRRSV、PEDV、TGEV的cDNA,PRV、PCV2、PPV的DNA为模板,按照确定的CSFV和PRRSV双重PCR条件进行扩增,以检测方法的特异性。
调整两种病毒cDNA含量相同后取等体积混合,依次进行10倍倍比稀释,以建立的CSFV和PRRSV双重PCR条件进行扩增,评价方法的敏感性。
1.3.4 PCV2、PRV和PPV三重PCR方法的建立
1.3.4.1 PCV2、PRV和PPV单重PCR检测 PCR反应体系为20 μL:包括2×TaqMaster Mix 10 μL,RNase-free ddH2O 6 μL,上、下游引物各1.5 μL,DNA模板1 μL。PCR反应条件为:94 ℃ 3 min;94 ℃ 30 s;56 ℃ 45 s;72 ℃ 30 s,35个循环;72 ℃ 10 min。取10 μL PCR产物进行琼脂糖电泳,观察结果。
1.3.4.2 PCR扩增产物的鉴定 将获得的符合预期大小的条带进行胶回收,按1.2.3.1的方法进行回收产物的测序鉴定。
1.3.4.3 三重PCR扩增体系的建立 分别以每种病毒的DNA、三种病毒组合的DNA为模板,通过对反应条件的优化,将3对引物以0.25 pmol/μL的终浓度混合加入20 μL PCR反应体系中,分别以54 ℃、55 ℃、56 ℃、57 ℃的退火温度,保持其他条件不变进行PCR扩增,筛选出最佳退火温度。在另一PCR反应体系(20 μL)中,将3对引物终浓度分别设定为0.2 pmol/μL、0.25 pmol/μL、0.3 pmol/μL、0.4 pmol/μL、0.5 pmol/μL,并按照确定的最佳退火温度,保持其他试剂及反应条件不变进行PCR扩增,筛选出最佳引物浓度。
1.3.4.4 三重PCR反应的特异性和敏感性 分别以PCV2、PRV、PPV的DNA,PEDV、TGEV、CSFV、PRRSV的cDNA为模板,按照确定的最佳三重PCR反应条件进行PCR扩增,评价方法的特异性。
调整3种病毒cDNA含量相同后取等体积混合,依次进行10倍倍比稀释,以建立的PCV2、PRV和PPV三重PCR进行扩增,评价方法的敏感性。
1.3.5 临床样品的检测 用建立的双重PCR和三重PCR方法分别对采集的118份猪血清样品进行CSFV、PRRSV及PCV2、PRV和PPV的检测。
2 结果
2.1 不同病毒单重PCR检测方法的建立 分别用设计的CSFV、PRRSV、PCV2、PRV和PPV特异性引物、模板,建立了分别检测这5种病毒的RT-PCR和PCR方法。在CSFV中可以扩增出大小约438 bp的目的条带,在PRRSV中扩增出大小约535 bp的目的条带,见图1。在PCV2、PRV和PPV中分别扩增出大小约880 bp、213 bp和295 bp的目的条带,见图2。将扩增产物纯化后测序,结果显示,均为特异性的条带(测序结果未显示)。
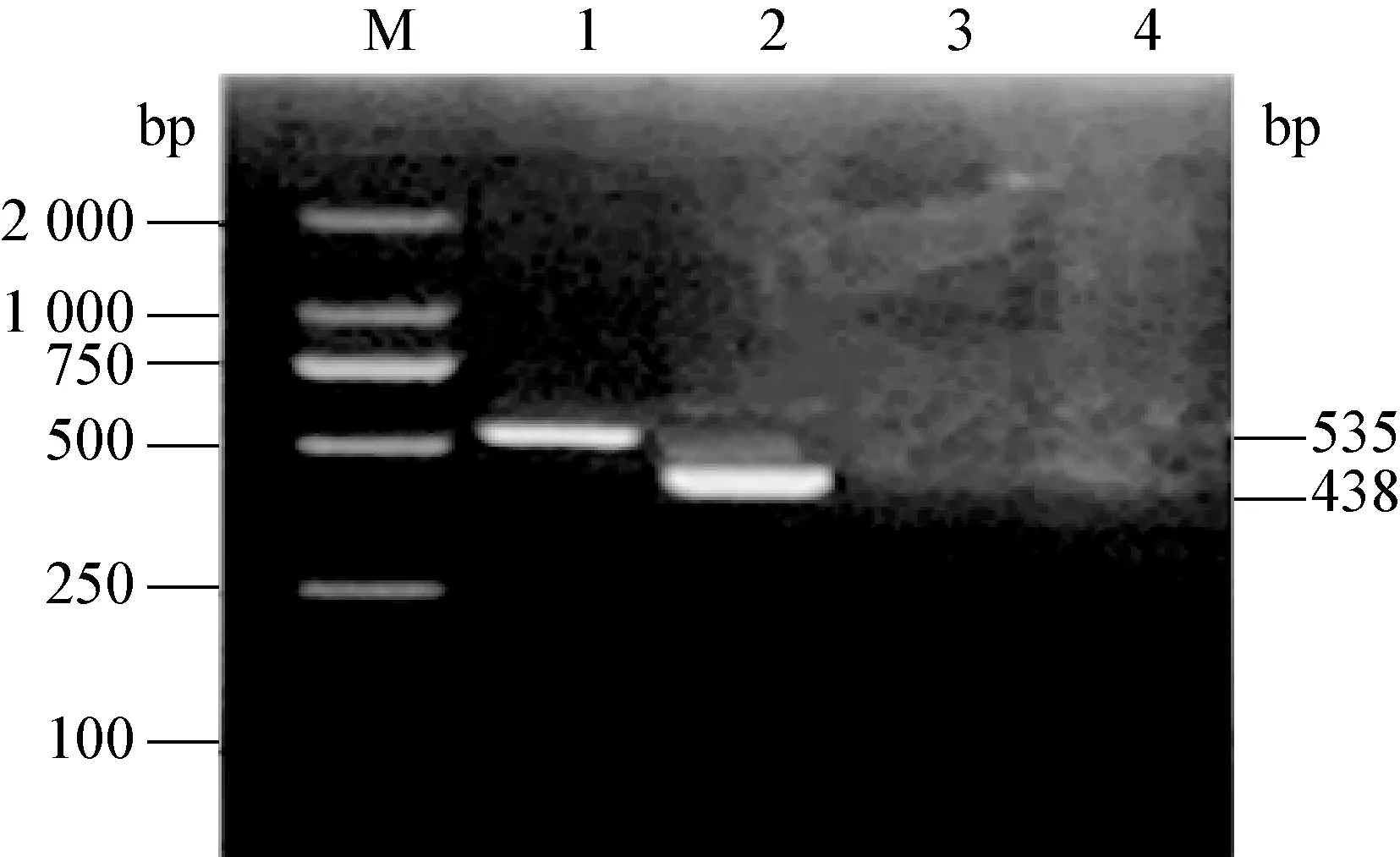
图1 CSFV和PRRSV的PCR产物电泳图
M:DNA标准DL-2 000;1:PRRSV;2:CSFV;3-4:阴性对照
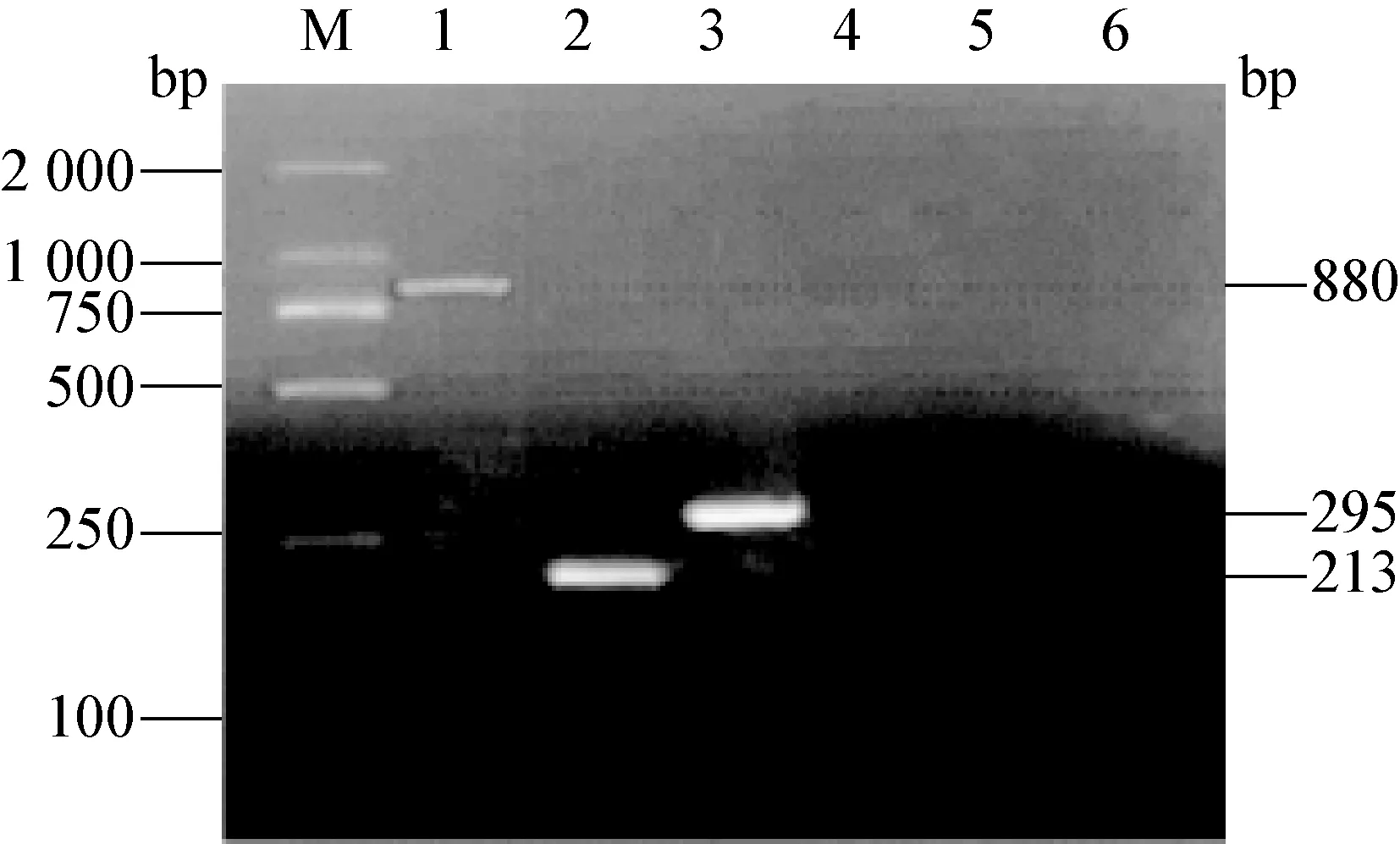
图2 PCV2、PRV和PPV的单重PCR产物电泳图
M:DNA标准DL-2 000;1:PCV2;2:PRV;3:PPV;4-6:阴性对照
2.2 CSFV和PRRSV双重PCR的最佳条件 通过对双重PCR不同退火温度下条带的观察,确定CSFV和PRRSV双重PCR最适退火温度为62 ℃(图3)。引物的终浓度为0.4~0.5 pmol/μL时,PCR产物量最大且基本一致,故选择引物的终浓度为0.4 pmol/μL(图4)。
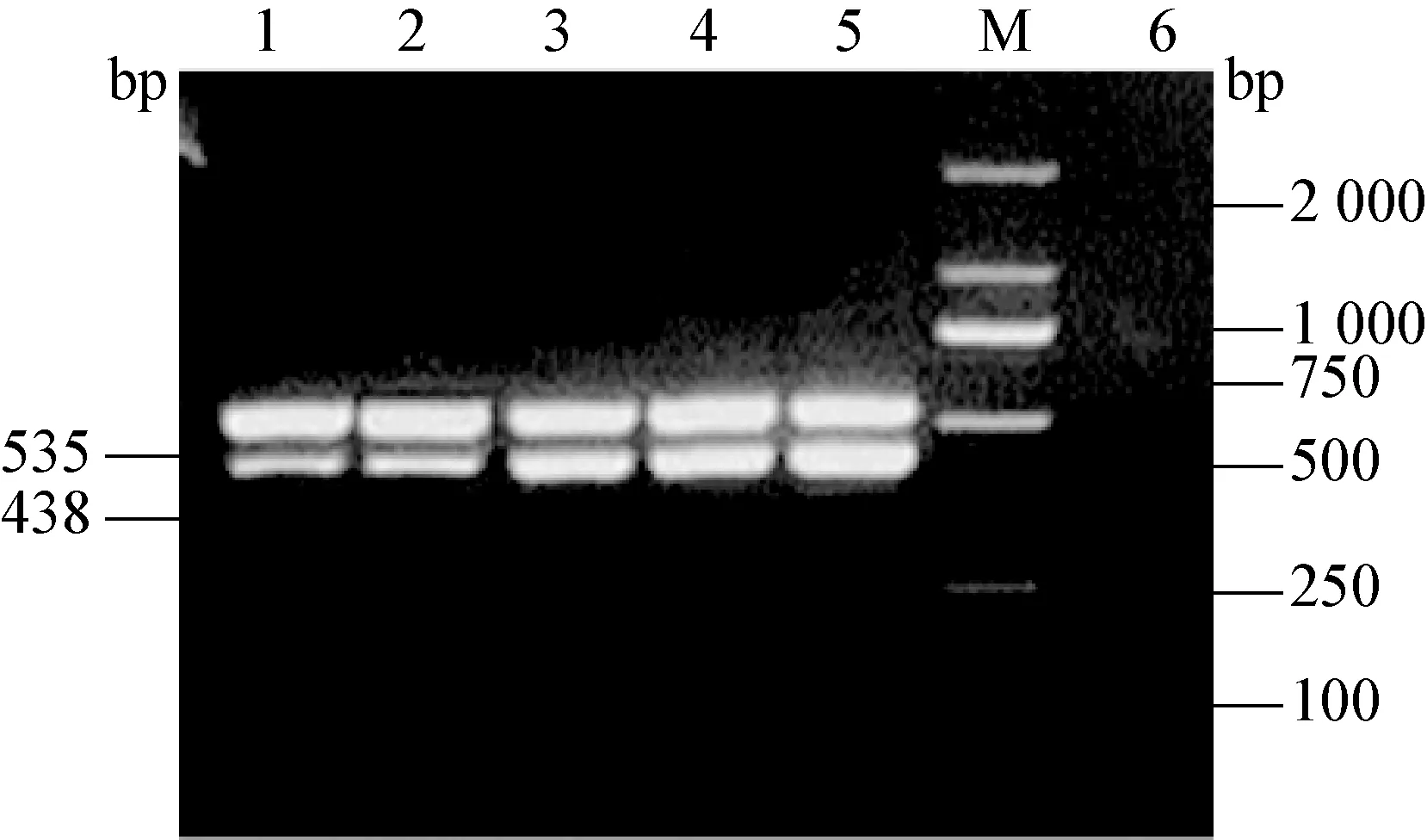
图3 退火温度优化的双重RT-PCR产物电泳图
M:DNA标准DL-2 000;1:54 ℃;2:56 ℃;3:58 ℃;4:60 ℃;5:62 ℃;6:阴性对照
2.3 CSFV和PRRSV双重PCR的特异性和敏感性 用建立的双重PCR方法分别检测CSFV、PRRSV、PEDV、TGEV、PRV、PCV2、PPV。结果显示,从CSFV和PRRSV中扩增出与预期大小一致的目的条带,其余病毒未扩增出产物(图5)。双重PCR的敏感性结果显示,CSFV的cDNA最低检测量为7.5 pg/μL,PRRSV为14.2 pg/μL(图6)。
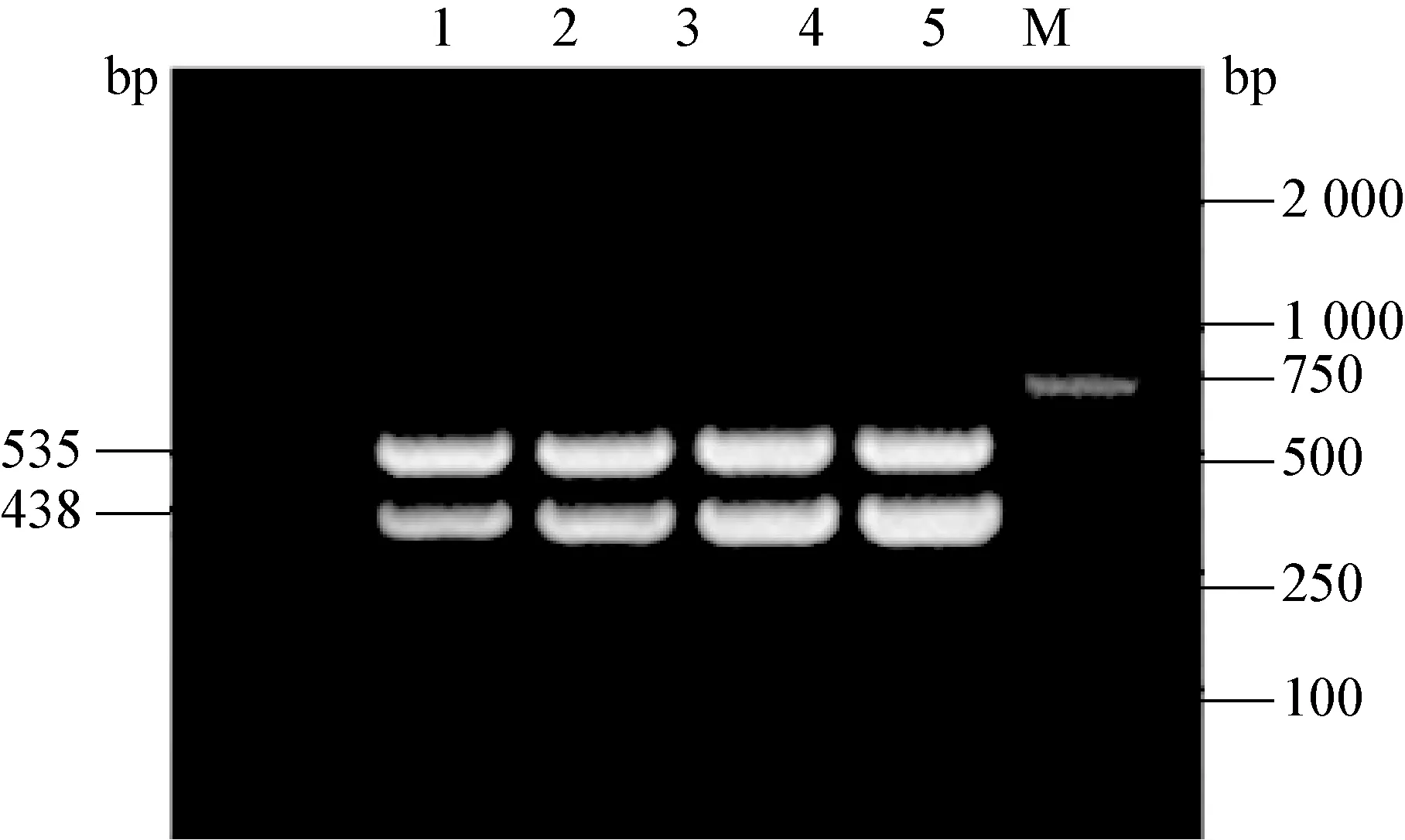
图4 引物浓度优化的双重RT-PCR产物电泳图
M:DNA标准DL-2 000;1:阴性对照;2:0.2 pmol/μL;3:0.3 pmol/μL;4:0.4 pmol/μL;5:0.5 pmol/μL
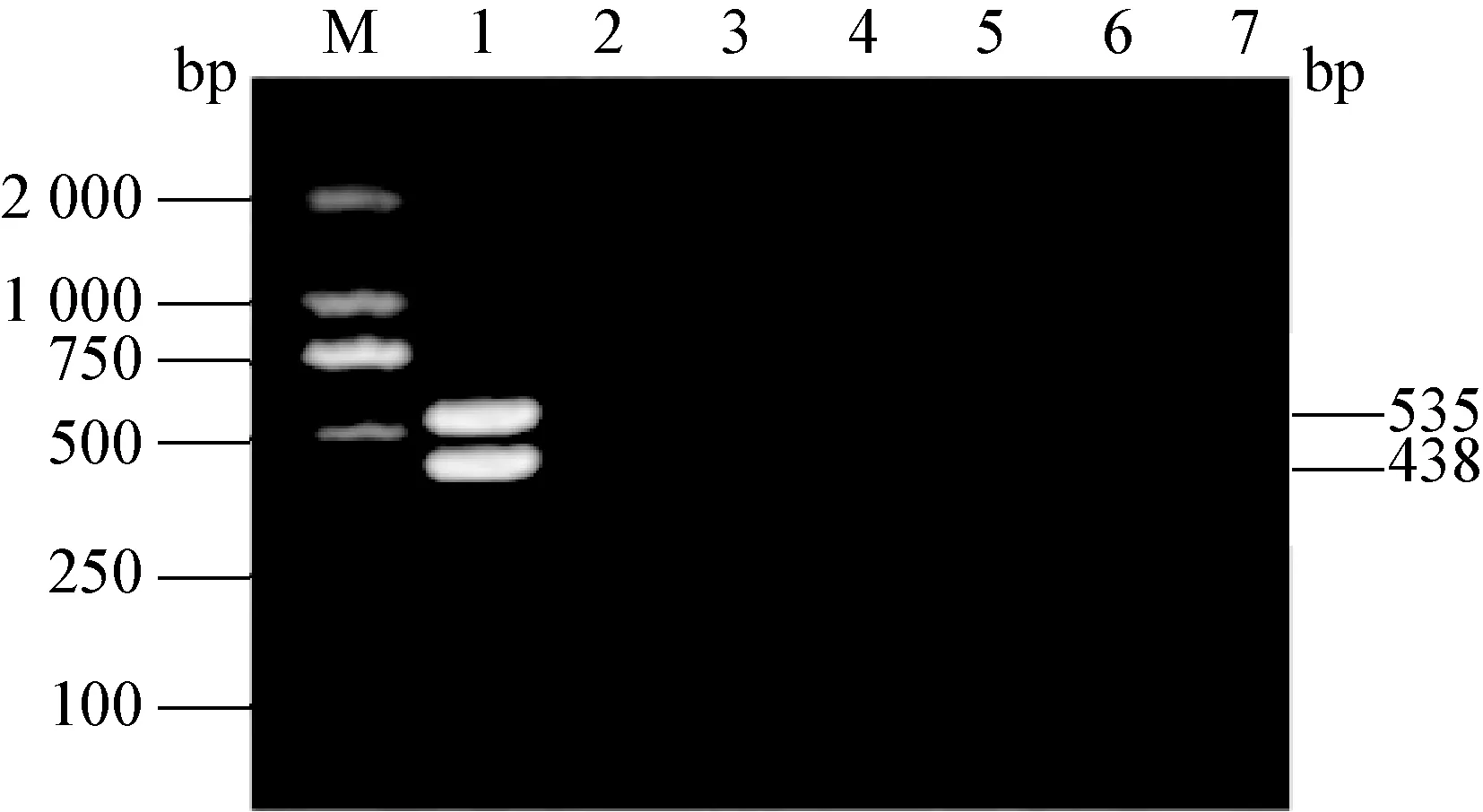
图5 特异性扩增的双重PCR产物电泳图
M:DNA标准DL-2 000;1:CSFV和PRRSV基因双重RT-PCR扩增;2:PRV;3:PCV2;4:PPV;5:PEDV;6:TGEV;7:阴性对照
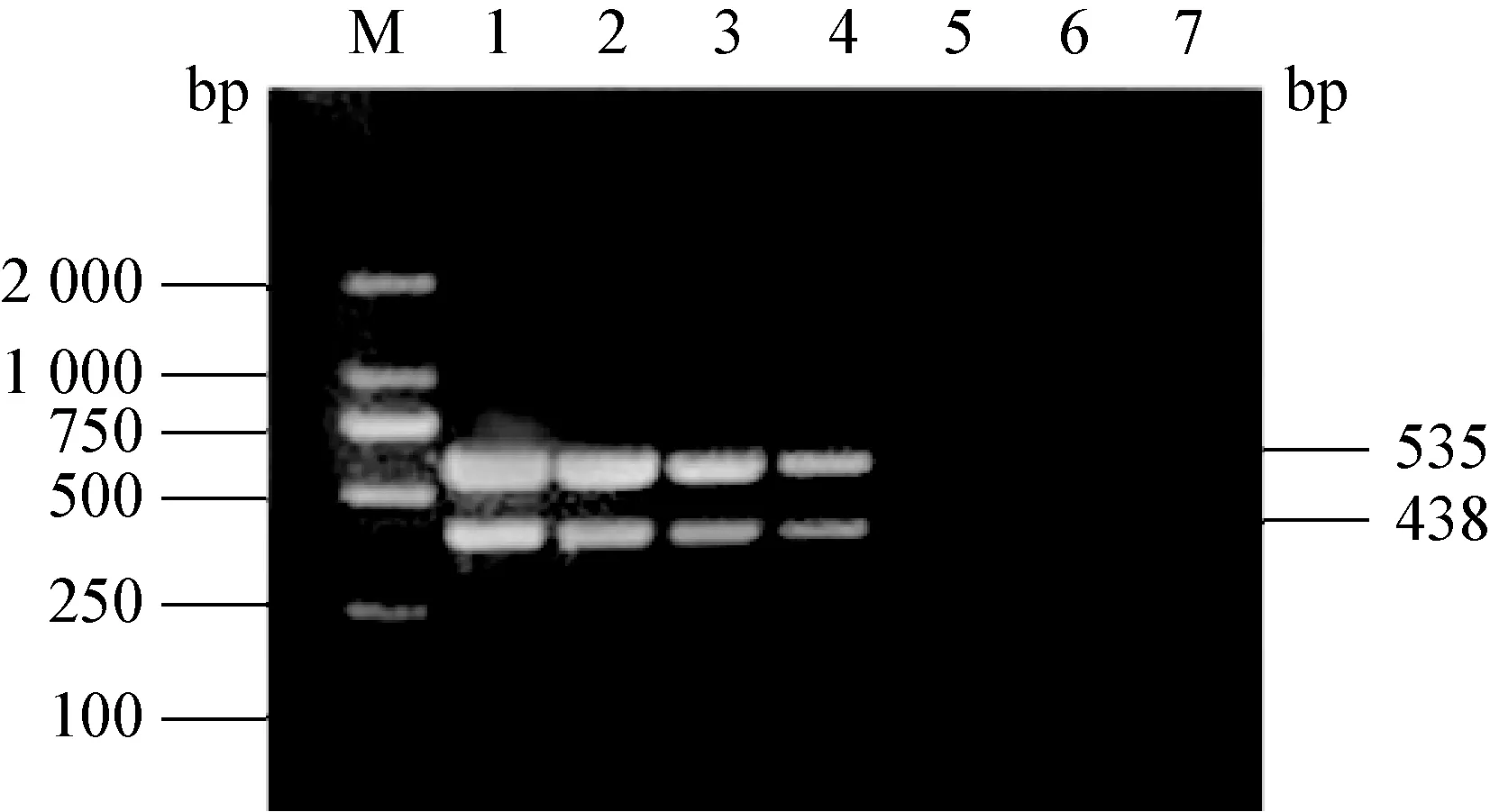
图6 敏感性扩增双重的PCR产物电泳图
M:DNA标准DL-2 000;1-6:模板稀释度分别为100、10-1、10-2、10-3、10-4、10-5;7:阴性对照
2.4 PCV2、PRV和PPV三重PCR的建立 在退火温度为56℃,PCV2和PRV的引物终浓度为0.2 pmol/μL,PPV的引物终浓度0. 3 pmol/μL时进行三重PCR扩增,可获得PCV2、PRV和PPV清晰的3条特异性条带,大小分别为880 bp、213 bp、295 bp,见图7。
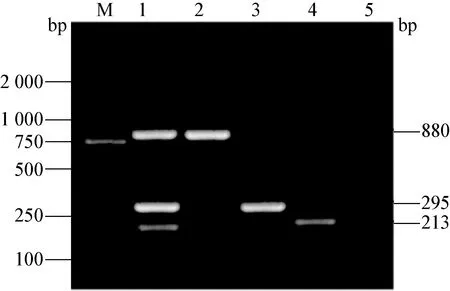
图7 PCV2、PRV和PPV的三重PCR产物电泳图
M:DNA标准DL-2 000;1:三重PCR扩增;2:PCV2的PCR扩增;3:PPV的PCR扩增;4:PRV的PCR扩增 ; 5:阴性对照
2.5 检测PCV2、PRV和PPV三重PCR的特异性和敏感性 用建立的三重PCR方法分别检测CSFV、PRRSV、PEDV、TGEV、PRV、PCV2、PPV。结果显示,仅从PCV2、PRV、PPV的模板中扩增出与预期目的条带大小一致的产物,从其他病毒中均未扩增出产物(图8)。
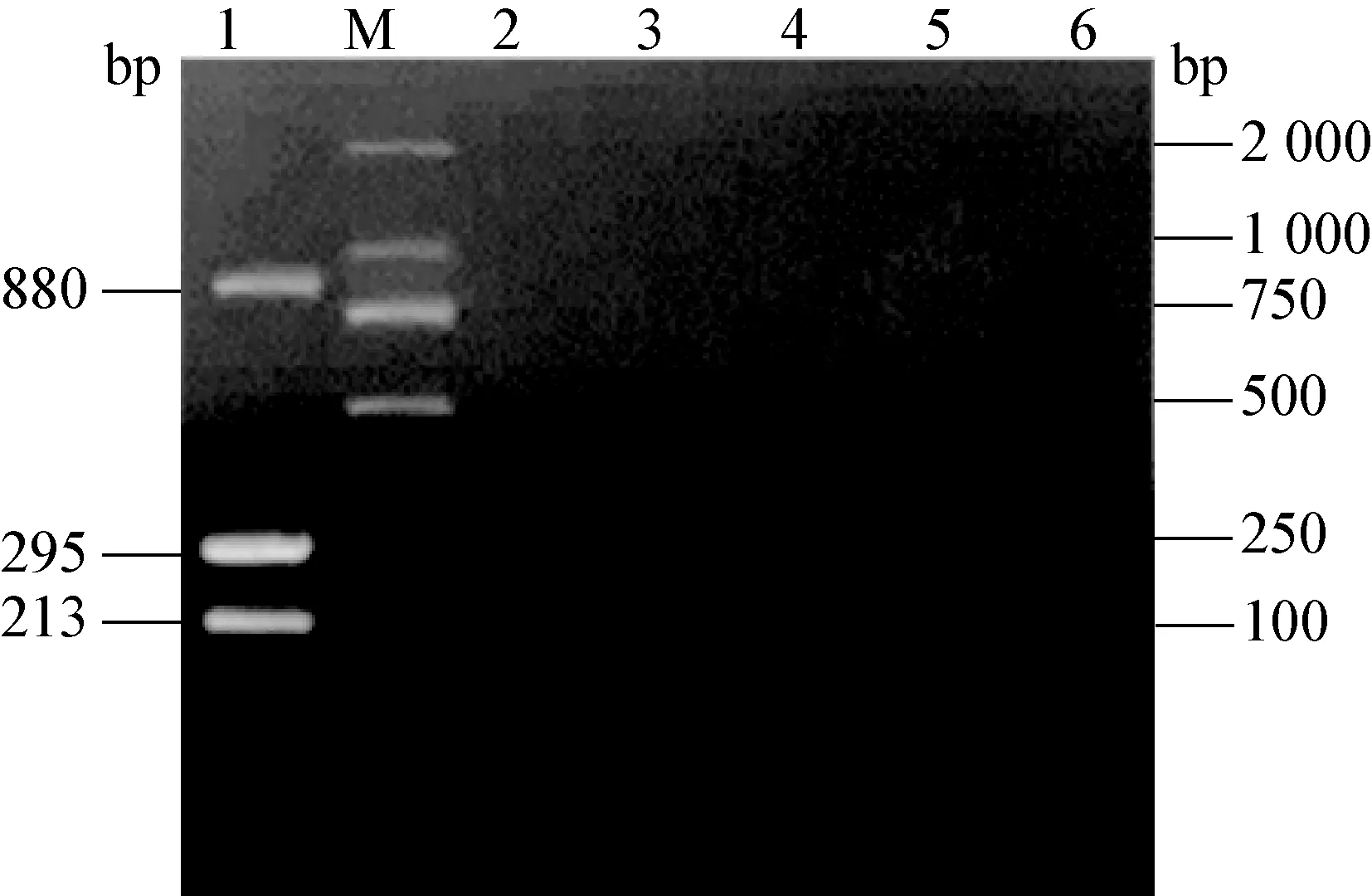
图8 特异性扩增的三重PCR电泳图
M:DNA标准DL-2 000;1:PCV2、PRV和PPV基因三重PCR扩增;2:CSFV;3:PRRSV;4:PEDV;5:TGEV;6:阴性对照
敏感性结果显示,建立的三重PCR方法对PCV2的DNA最低检测量为6.9 pg/μL,PRV的最低检测量为9.2 pg/μL,PPV的最低检测量为8.6 pg/μL(图9)。
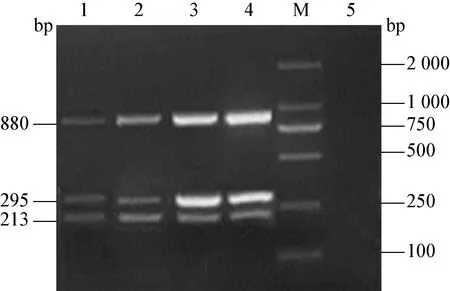
图9 敏感性扩增的三重PCR电泳图
M:DNA标准DL-2 000;1-4:模板稀释度分别为10-3、10-2、10-1、100;5:阴性对照
2.6 临床样品的检测 用建立的双重RT-PCR和三重PCR方法分别对猪血清样品进行病毒检测。其中从陕南猪场58份样品中5种病毒的检出率分别是,CSFV为5.17%(3/58),PRRSV为29.31%(17/58), PCV2 为10.34%(6/58), PRV为20.69%(12/58),PPV 为0%(0/58);从陕北猪场30份样品中5种病毒的检出率分别是CSFV 为3.33%(1/30),PRRSV 为3.33%(1/30),PCV2为 26.67%(8/30), PRV 为36.67%(11/30),PPV 为0%(0/30);从关中猪场30份样品中5种病毒的检出率分别是, CSFV为3.33%(1/30), PRRSV 为26.37%(8/30), PCV2 为13.33%(4/30), PRV为 13.33%(4/30),PPV为0%(0/30),部分样品检测电泳图见图10和图11。临床样品检测中PPV均为阴性,为了进一步验证三重PCR方法的敏感性,对样品再次进行了PPV的单重PCR。结果均未检测到PPV,部分样品PPV单重PCR见图12。
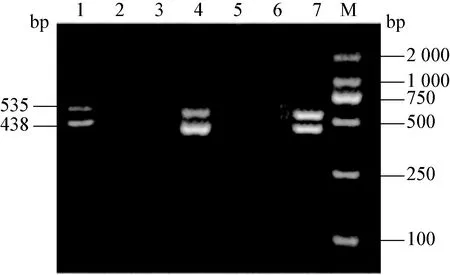
图10 部分临床样品CSFV和PRRSV双重RT-PCR产物电泳图
M:DNA标准DL-2 000;1-6:临床样品;7:阳性对照
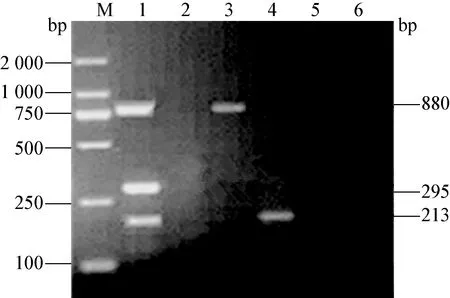
图11 部分临床样品PCV2、PRV和PPV三重PCR电泳图
M:DNA标准DL-2 000;1:阳性对照 ; 5-6:临床样品
3 讨论
随着我国养猪业的规模化程度的不断提高,养殖密度的加大,也为疾病的传播和发生创造了条件,给养猪业带来了巨大的疫病风险。目前,猪场出现的传染性疾病,由单一病原引起的较少,混合感染比较多见,使得临床上的表现复杂化,给疾病诊断带来了挑战和困难。病原的早发现是制定有效防控措施、防止疾病发生的基础,敏感、准确、快速、可操作性强的检测方法是及早确定病原,采取有效措施的有效工具。
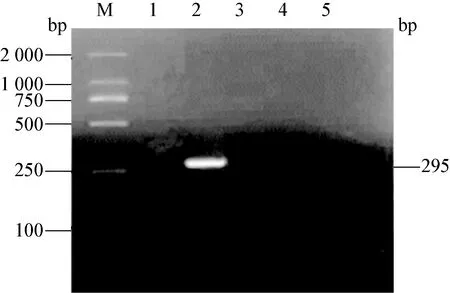
图12 部分临床样品PPV检测的单重PCR电泳图
M:DNA标准DL-2 000;1:阴性对照;2:阳性对照;3-5:临床样品
病毒的检测方法主要有病毒分离鉴定、免疫学技术、血清学技术、分子生物学技术等,这些技术检测方法在特异性、敏感性以及时效性等方面都有各自的优缺点[10-14]。分子生物学技术主要是基于核酸扩增的PCR技术,目前已成为动物疫病检测和诊断中最常用的方法,并由此衍生出多种基于PCR的技术,多重PCR技术可以同时检测多种病原,在生产上得以广泛应用[15]。本研究对当前养猪业危害较大的5种病毒为检测目标,通过对各种病毒参考毒株序列的同源性分析,选择其保守基因片断设计引物,分别建立了检测核酸类型为RNA病毒的多重RT-PCR检测方法,核酸类型为DNA病毒的多重PCR检测方法。经过对多重PCR体系、引物的使用浓度、反应条件、敏感性、特异性的不断优化,分别建立了检测CSFV和PRRSV的双重RT-PCR,检测PCV2、PRV和PPV的三重PCR方法。所建立的方法对CSFV、PRRSV、PCV2、PRV和PPV核酸的检出量分别为7.5 pg/μL、14.2 pg/μL、6.9 pg/μL、9.2 pg/μL和8.6 pg/μL。为了检验方法的可用性,用所建立的方法对猪场送检的118份猪血清进行了检测,为了确保检测的准确性,对获得的各种病毒特异性PCR产物进行纯化回收和序列测定,同时用待检病毒特异性RT-PCR或PCR方法进行复检,结果显示,所建立方法的特异性良好,可以用于临床检测。在样品检测中,分别检测到了CSFV、PRRSV、PCV2和PRV,但是未检测到PPV。可以看到CSFV、PRRSV、PCV2和PRV在猪场的感染率还较高,并且形成了病毒血症,需要引起高度关注,及时采取措施予以防控。在118份血清中未检出PPV,但并能完全确定猪群中不存在PPV的污染情况,只是未形成毒血症,所以对PPV的检测还要结合临床症状观察,选择组织样品作为检测材料进行病毒检测。
在随后的研究中我们还要对建立方法的临床上进行大范围应用,进一步优化,进行试剂盒的组装,为这些病毒的检测提供可应用的方法和产品。
