H5N1亚型禽流感病毒感染SPF雏鸡免疫器官变化
2019-11-11党盛源刘超男高雪丽赵良友吕晓萍郑世民
党盛源,刘超男,高雪丽,姜 南,赵良友,吕晓萍,郑世民
(1.东北农业大学动物医学学院黑龙江省实验动物与比较医学重点实验室,黑龙江哈尔滨150030;2.大连大学生命科学与技术学院,辽宁大连116622;3.黑龙江中医药大学药物安全性评价中心,黑龙江哈尔滨150040)
禽流感(AI)是由禽流感病毒(AIV)感染机体引起的病理综合征。其中H5N1亚型AIV属于高致病性。近些年,该病毒在国内多个地区引起鸭、鹅等水禽流感暴发。研究证实,H5N1亚型AIV可通过禽类传染人类。不仅给养禽业造成巨大经济损失,更为严重的是给人类健康和生命带来巨大威胁。雏鸡免疫器官细胞免疫在AIV感染中的作用迄今缺乏系统研究报道,故本研究对H5N1亚型AIV感染7日龄SPF雏鸡后,其胸腺、脾脏、法氏囊的细胞免疫相关指标的动态变化进行了系统检测,探讨H5N1亚型AIV的免疫致病机制,为AIV免疫防制提供科学可靠的试验依据。
1 材料与方法
1.1 实验动物 CSIRO-MVS品系SPF混合雏鸡70只,由中国农业科学院哈尔滨兽医研究所SPF实验动物中心提供。
1.2 禽流感病毒(AIV) 鹅源H5N1亚型AIV中强毒株,血凝价为26,中国农业科学院哈尔滨兽医研究所惠赠。
1.3 主要试剂 鼠抗鸡CD4(MAC-CD4)和CD8(MAC-CD8)单克隆抗体,Inc产品;RPMI1640培养基,Gibco产品; Con A,CNI公司;MTT,Sigma公司;α-甲基-D-甘露糖苷,Amresco公司;3,3—二氨基联苯二胺盐酸盐和醋酸-1-萘酯,上海试剂一厂;副品红,上海试剂三厂;胰蛋白酶,上海化学试剂站分装厂。上述化学试剂均为分析纯。
1.4 方法
1.4.1 动物分组及处理 70只SPF雏鸡随机分为病毒感染组(I组)和对照组(C组)。其中I组雏鸡于7日龄时经眼、鼻、口途径感染1∶100稀释的病毒稀释液,剂量为LD50/只;C组雏鸡通过上述相同途径给予相同剂量的高压灭菌PBS。2组雏鸡分别饲养于中国农业科学院哈尔滨兽医研究所SPF实验动物中心负压隔离器内,按SPF雏鸡要求饲养管理。动物试验部分在国家禽流感参考实验室完成。
1.4.2 被检材料采取及处理 分别于AIV感染后1、3、4、5、7、14 d和2 d,每组随机抽取5只雏鸡。称重,心脏采血处死,快速无菌采取部分胸腺、脾脏分别分离制备相应淋巴细胞悬液,用于T淋巴细胞增殖能力检测。另取一部分胸腺、脾脏及法氏囊固定于4 ℃的10%中性福尔马林中,经一系列处理后用于其余相关指标的检测。
1.4.3 被检指标及方法 (1)免疫器官T细胞采用组织石蜡切片及酶组织化学法[1]检测,CD4+、CD8+T细胞数量的检测使用组织石蜡切片及免疫组织化学法[2]检测;(2)胸腺和脾脏T淋巴细胞对Con A的增殖功能检测—组织细胞培养及MTT检测法[3];(3)AIV感染SPF雏鸡发病和死亡情况。

2 结果
2.1 AIV感染SPF雏鸡免疫器官T细胞数量的动态变化 AIV感染SPF雏鸡后,其胸腺、法氏囊和脾脏的T淋巴细胞数量分别于病毒感染后3~5 d、4~7 d和4~5 d较对照雏鸡明显减少(P<0.05或P<0.01),且法氏囊T淋巴细胞在第21天也显著低于对照雏鸡(P<0.05)。其他未见统计学差异(P>0.05)。见表1。
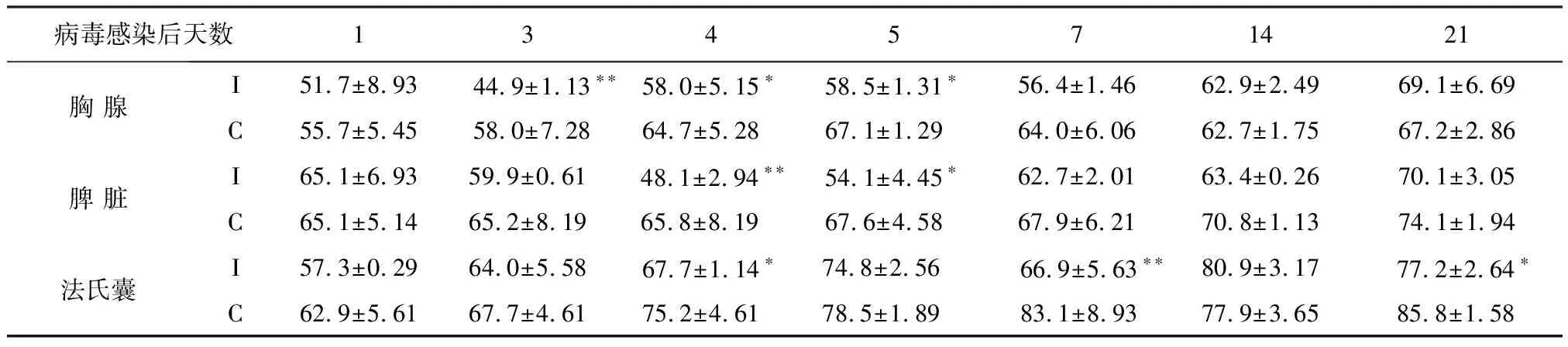
表1 AIV感染SPF雏鸡免疫器官T细胞数量变化 (×103个/mm2)
注:(1)C表示对照组;I表示AIV感染组。(2)**表示P<0.01,*表示P<0.05;无标记表示P>0.05;下表同
2.2 AIV感染7日龄SPF雏鸡胸腺和脾脏T细胞增殖功能变化 SPF雏鸡感染AIV后1~21 d,其胸腺T细胞增殖能力均不同程度的低于对照雏鸡,其中3~7 d差异明显(P<0.05或P<0.01);脾脏T细胞增殖能力于3~5 d明显低于对照雏鸡(P<0.05或P<0.01)。见表2。
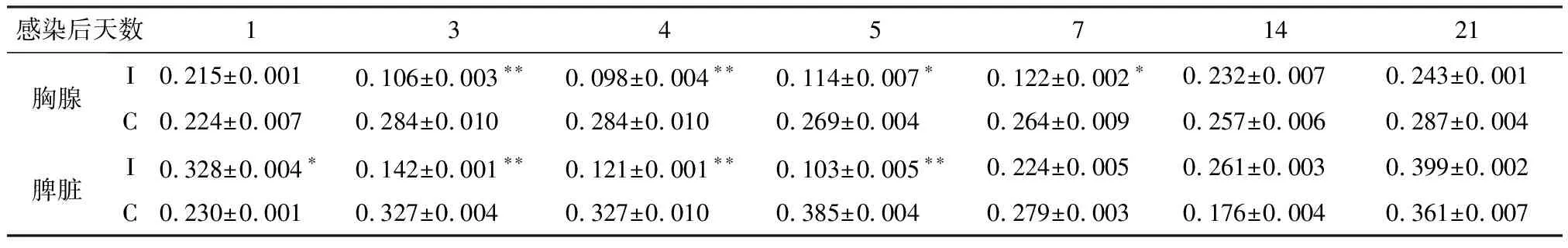
表2 AIV感染SPF雏鸡胸腺和脾脏T细胞增殖功能变化 (OD590nm值)
2.3 AIV感染7日龄SPF雏鸡胸腺CD4+、CD8+T细胞数量变化 AIV感染SPF雏鸡后3~4 d,其胸腺皮质CD4+、CD8+T细胞均明显低于对照雏鸡(P<0.05 或P<0.01);髓质CD4+、CD8+T细胞分别于病毒感染后4~7 d、3~4 d明显减少(P<0.05或P<0.01)。见表3。
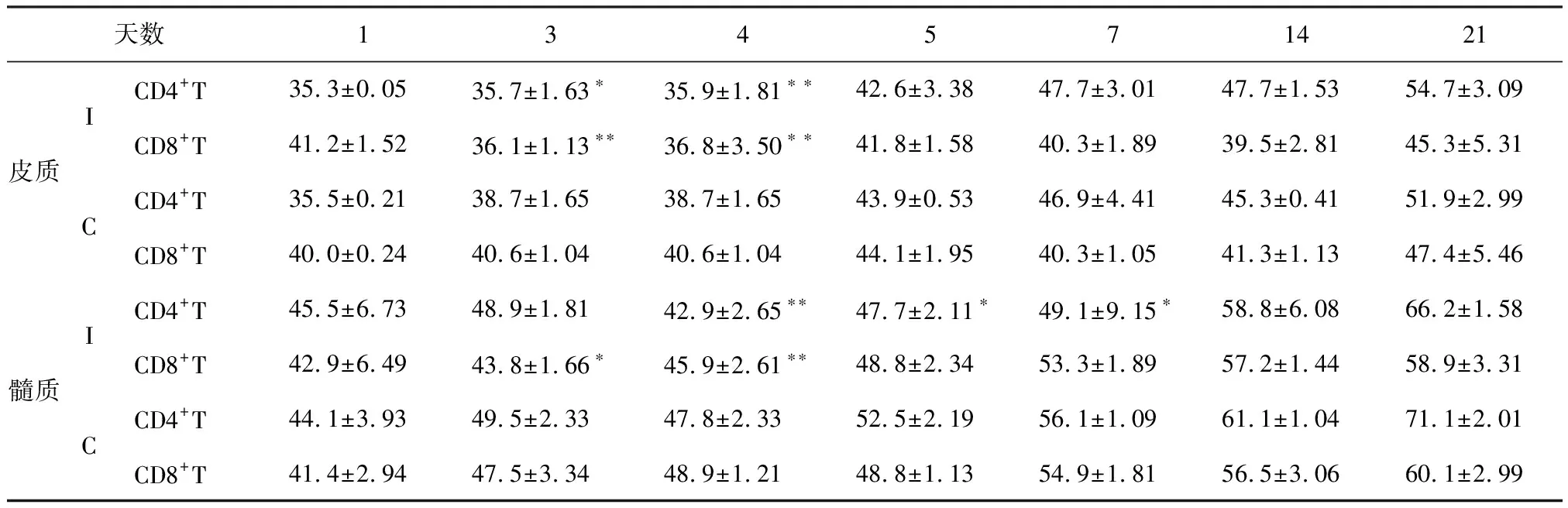
表3 AIV感染7日龄SPF雏鸡胸腺CD4+、CD8+T细胞数量变化 (×103/mm2)
2.4 AIV感染7日龄SPF雏鸡脾脏CD4+、CD8+T细胞数量变化 AIV感染SPF雏鸡后1~21 d,其脾脏红髓中CD4+、CD8+T细胞均不同程度地低于对照雏鸡。其中CD4+T细胞于4~5 d明显下降(P<0.05或P<0.01);CD8+T细胞于第4天极显著(P<0.01)减少。白髓中CD4+、CD8+T细胞分别于病毒感染后4~5 d、5~7 d较对照雏鸡显著(P<0.05)或极显著(P<0.01)降低。淋巴小结CD4+T细胞于病毒感染后4~5 d较对照雏鸡极显著(P<0.01)下降;CD8+T细胞于3~5 d减少尤为明显(P<0.05或P<0.01)。见表4。
2.5 AIV感染7日龄SPF雏鸡胸腺和脾脏CD4+与CD8+T细胞比值变化 AIV感染SPF雏鸡后3~5 d,其胸腺皮质CD4+与CD8+T细胞比值明显低于对照雏鸡(P<0.05或P<0.01);髓质CD4+与CD8+T细胞比值于病毒感染后第3天显著下降(P<0.05)。
脾脏红髓CD4+与CD8+T细胞比值均于病毒感染后3~5 d明显(P<0.05或P<0.01)低于对照雏鸡;白髓CD4+与CD8+T细胞比值于病毒感染后1~3 d较对照雏鸡显著(P<0.05或P<0.01)下降。见表5。
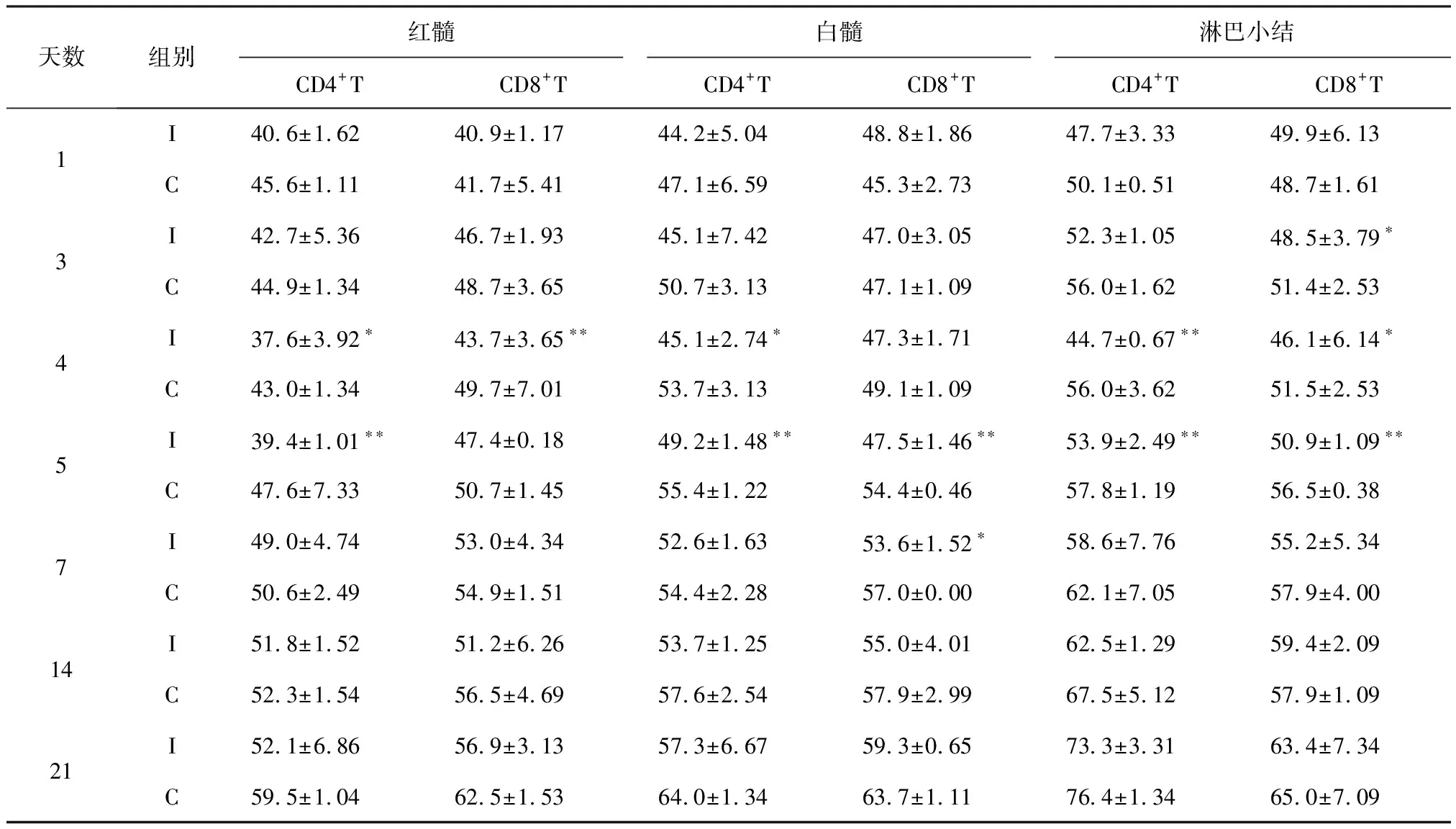
表4 AIV感染7日龄SPF雏鸡脾脏CD4+、CD8+T细胞数量变化 (×103/mm2)
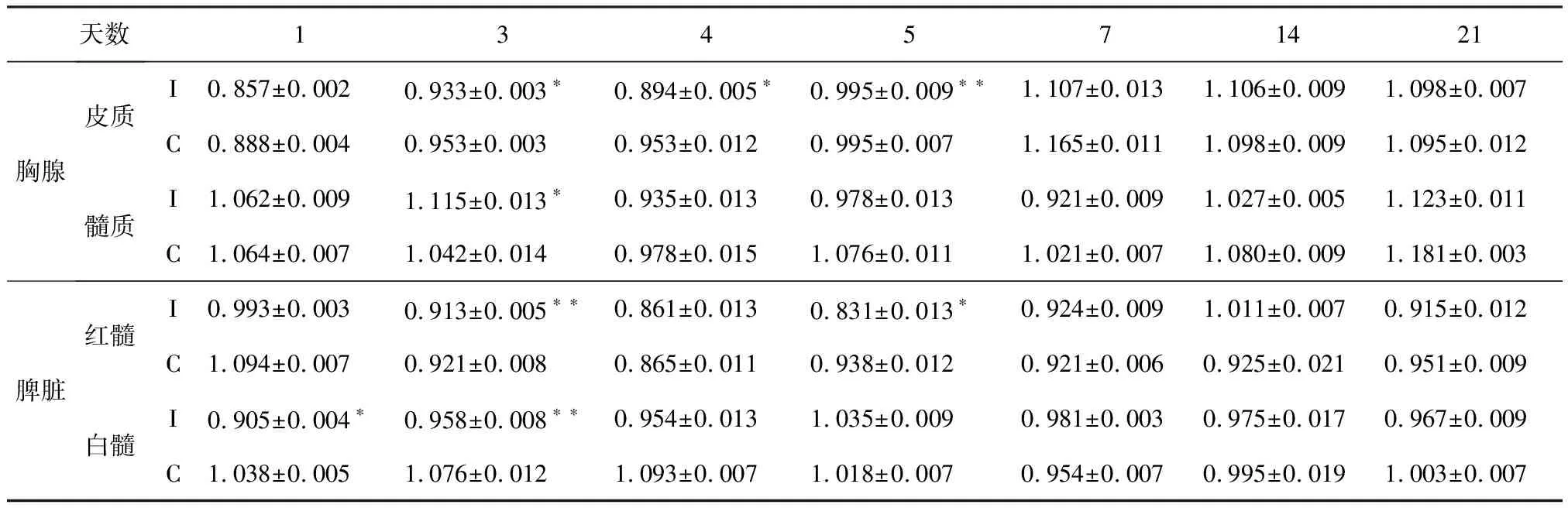
表5 AIV感染7日龄SPF雏鸡胸腺和脾脏CD4+与CD8+T细胞比值变化 (×103/mm2)
2.6 AIV感染7日龄SPF雏鸡发病和死亡情况 AIV感染SPF雏鸡全部发病,呈现典型的AI临床症状,发病率为100%,第3、4、7天各死亡3只,第5天死亡2只,其余天数各死亡1只,死亡率达40%,对照雏鸡未见异常。见表6。
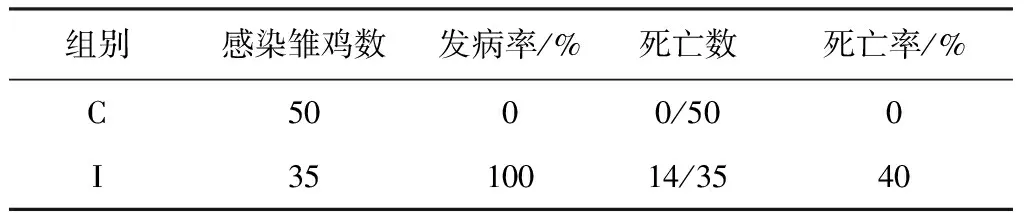
表6 AIV感染7日龄SPF雏鸡发病和死亡情况
3 讨论
本研究发现,H5N1亚型AIV感染7日龄SPF雏鸡后,无论是中枢还是外周免疫器官的T淋巴细胞不仅数量减少,而且其对Con A的增殖功能也程度不同地低于对照雏鸡。表明AIV感染对SPF雏鸡免疫器官的细胞免疫功能具有抑制作用。AIV侵入细胞后可诱导多种培养细胞或组织细胞凋亡[4-6]。孙正阳等[4]研究表明,鹅源H5N1亚型AIV感染雏鸭后,腔上囊出血、充血、炎性细胞浸润,胸腺和脾脏淋巴细胞数量明显减少。另有研究报道,AIV感染21日龄雏鸡,其血液中T细胞数量显著减少[7],外周血液细胞免疫和体液免疫功能下降是机体免疫器官免疫功能低下的外在表现,而免疫器官免疫功能减弱或丧失是外周血液免疫功能改变的基础或根源。本研究结果与葛南海等[8]、王颖彦等[9]和张瑞莉等[10]的研究报道基本一致。本研究还发现,病毒感染雏鸡后不仅胸腺及脾脏的CD4+和CD8+T细胞数量均不同程度地减少,且CD4+/CD8+值也显著下降,表明AIV感染SPF雏鸡免疫器官的细胞免疫水平降低或被抑制,该类被检测指标迄今尚未见报道。郑世民等[3]研究发现,AIV感染雏鸡后胸腺与脾脏的IL-2和IFN在一定时间内均低于对照雏鸡,表明AIV感染所致胸腺和脾脏T淋巴细胞数量减少与相应细胞因子含量降低、细胞免疫水平下降密切相关。Tumpey T M等[11]研究发现,由人体分离的H5N1亚型病毒感染小鼠后,T淋巴细胞数量减少。金梅花等[12]报道,病毒主要通过诱导MHC-I类分子递呈抗原激活CD8+,而CD4+细胞克隆增殖明显慢于MHC-I类分子递呈抗原激活的CD8+细胞。AIV具有高度保守的核衣壳蛋白(NP),是诱导CTL反应的主要抗原[13]。病毒入侵机体后,激活CD8+T细胞, CD4+与CD8+T细胞数量均处于显著减少状态,导致CD4+/CD8+值显著下降。H5N1亚型AIV极有可能是通过削弱CD4+T细胞的免疫功能影响细胞因子进而延长病毒感染时间和/或加重了病毒感染雏鸡的病情,其具体机制有待进一步深入探究。
4 结论
H5N1亚型AIV感染可引起SPF雏鸡免疫器官的细胞免疫功能下降,该变化不仅是导致感染雏鸡免疫机能低下的主要因素,也与病毒感染雏鸡死亡密切相关。
