高通量测序研究早期断奶仔猪粪便菌群的结构性差异
2019-11-11刘志鹏李留安金天明柳巨雄
崔 君,刘志鹏,殷 茵,李留安,金天明,柳巨雄
(1.吉林大学动物医学院,吉林长春130062;2.天津农学院动物科学与动物医学学院,天津市农业动物繁育与健康养殖重点实验室,天津西青300384;3.天津市滨海新区畜牧服务中心,天津滨海300452;4. 天津市动物疫病预防控制中心,天津北辰300402)
仔猪早期断奶和更换饲料是现代集约化养猪生产中提高母猪生产性能的重要手段之一,国内大多采用21~28日龄断奶。但早期断奶仔猪消化系统和免疫器官发育不完善,仔猪断奶后往往出现食欲差、消化不良、生长迟滞、饲料利用率低等所谓“仔猪早期断奶综合征”。本研究结合生产实践将21日龄断奶仔猪的作为主要研究对象,将断奶仔猪的粪便作为主要出发点进行高通量测序并进行差异性分析,意指出正常与异常的差异性,为生产实践提供依据。
1 材料与方法
1.1 主要试剂和仪器 OMEAGE D4015粪便DNA提取试剂盒,TIANGEN DP209普通琼脂糖凝胶DNA回收试剂盒(离心柱型),GENERAY 即用型Taq酶PCR试剂盒,GoldView Ⅰ型核酸染色剂,DNA Marker DL-2501,琼脂糖, TAE缓冲液,粪便 DNA 提取试剂盒,Stool DNA Kit(Omega Biotek公司)。
1.2 试验动物 从天津规模较大的养猪厂选取,均为自繁自养,品系为长大,母猪存栏量在200头以上,年出栏成品猪在2 000头以上,基础日粮配方及营养水平参考张建斌等[1]。采集6栏仔猪粪便,其中编号为A、B、C、D、E、F,分别按照用Z(正常)和Y(异常)表示[2]。
1.3 样品的采集
1.3.1 血液样品 用采血器采集仔猪前腔静脉血液5 mL,室温静置1 h,以5 000 r/min离心10 min,取上清分装备用。
1.3.2 粪便样品 采集21日龄断奶仔猪断奶第4天(即25日龄)[3-4]的新鲜且未被污染的粪便,每栏至少釆集3头,每个处理至少保存3份样品。粪便采集时间尽量选择在仔猪排泄高峰期,仔猪排泄时,用无菌采样器及时接住,用无菌牙签去掉前端约1~2 cm,采集5 g左右,用无菌取样袋封存,立刻置于冰盒中,迅速冻存。对于未及时处理而遗落在地上的粪便,判为已被污染,不予收集。粪便采集结束后,及时安置入-80 ℃超低温冰箱中保存并最好在1个月内提取DNA[5]。正常粪便编号为AZ、BZ、CZ、DZ、EZ、FZ,异常编号为AY、BY、EY、FY(由于C、D 两栏在取样过程中并未发现异常粪便因此没有采样),共计30个样本。
1.4 方法
1.4.1 生化指标测定 采用全自动生化分析仪(GLAMOUR3000,美国MD仪器公司)测定。
断奶仔猪粪便菌群基因组DNA提取与PCR扩增:使用DNA 试剂盒 (美国 OMEGA公司)提取仔猪粪便的基因组 DNA,步骤参照说明书。提取的DNA利用琼脂糖凝胶电泳检测基因组DNA的完整性。PCR产物用2%琼脂糖凝胶检测,DNA凝胶提取试剂盒提纯。
1.4.2 高通量测序 使用Qubit 2.0 Fluorometer(Invitrogen,Carlsbad,CA) 检测DNA样品的浓度,使用MetaVxTM文库构建试剂盒 (GENEWIZ, Inc.,South Plainfield,NJ,USA)构建测序文库。
1.4.3 数据分析 采用SPSS17.0统计软件,显著水平P采用0.05,试验数据用平均值±标准差来表示。
2 结果
2.1 正常组与异常组基本生理指标比较 研究发现断奶仔猪在经受断奶的应激的刺激后,其体温、心率和呼吸等基本生理指标有了明显的变化[6],体温的变化是免疫调节的外在表现,本研究中异常组的体温变化与正常组相比达到差异显著的程度(P<0.01)(表1),究其原因可能是免疫应激会诱发一系列机体代偿性的抗应激生理反应,使代谢耗能有所增加造成的。
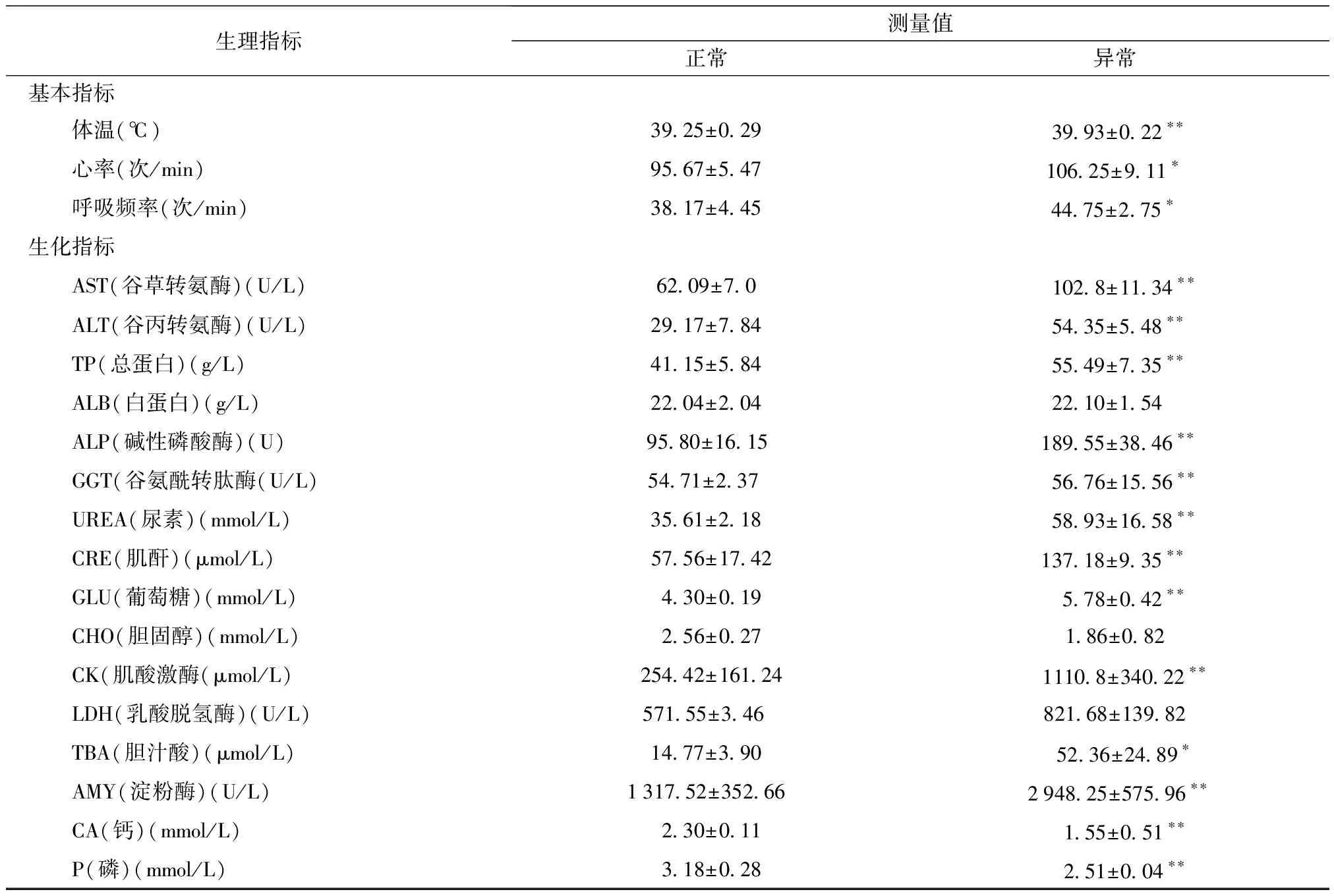
表1 断奶仔猪生理生化指标
*:P<0.05,差异显著; **:P<0.01,差异极显著
在常规的生化指标中,粪便异常的仔猪AST、ALT、TP、ALP、GGT、UREA、CRE、GLU、CK、AMY、CA的测量值与正常仔猪的测量值比较均差异极显著(P<0.01),TBA的测量值差异显著(P<0.05),ALB、CHO、LDH测量值差异不显著(P>0.05)。
2.2 正常组与异常组生物学分析比较
2.2.1 OUT聚类分析 要了解一个样本测序结果中的菌种、属等数目信息,就需要对序列进行归类操作。OTUs是按照一致性和相似性聚类的Tags集合体。通常在97%相似水平下对所有序列进行OTUs划分并进行生物信息统计分析。
2.2.2 物种注释及分类结果统计 根据RDP classifier (Ribosomal Database Program) 贝叶斯算法对OTUs的代表性序列进行物种分类学分析,并在不同物种分类水平下统计每个样本的群落组成。选定不同水平上样品物种表达丰度形成物种分布柱状图,以便可以直观的表示出各水平上的优势物种。
由中插彩版图1可以看出在门水平的所有组别中,细菌组成90%以上主要集中在Firmicutes(厚壁菌门)和Bacteroidetes(拟杆菌门),但比例有所不同,这与此前报道相一致。正常组中Firmicutes占57.25%,Bacteroidetes占34.01%;异常组中Firmicutes所占比例更高为63.23%,而Bacteroidetes比例稍有降低,达到25.92%。
进一步研究样品,从纲水平的物种的聚类分析分布热图(见中插彩版图2)来看,正常组中Clostridia(梭菌纲)的相对值最高,达到42%,Bacteroidia(拟杆菌纲)和Bacilli(芽孢杆菌纲)占比33%和11%,分列二、三;虽然在异常组中占据前列的同样是这3个物种,但所占比例发生了变化,Bacilli冲在前列为30%,Clostridia和Bacteroidia均占比26%紧随其后。
2.3 样本复杂度分析
2.3.1 样本多样性分析 为了表达样本所含物种的丰富程度和均匀度,我们可以用Rank-Abundance曲线来表示(见中插彩版图3),很显然Z样本的曲线更加平坦,表示物种组成更加丰富,而Y样本曲线快速陡然下降,表明样本中的优势菌群所占比例很高,多样性较低。
2.3.2 物种Alpha多样性分析 为了表达一个特定区域或者生态系统内的多样性,常用Alpha多样性来表示。通过ACE 、Chao1、Shannon以及Simpon等指数来描述样品的丰富度和均匀分布情况来表达Alpha多样性。
用SPSS17.0软件对ACE、Chao1、Shannon以及Simpon等指数加以分析,我们会发现在象征Alpha多样性的参数中(OUTs分类为97%相似度水平)(表2),ACE、Chao1、Simpson等用来评价物质多样性的指数差异显著(P<0.05)、Shannon指数差异极显著(P<0.01)。而Goods_coverage指各样本文库的覆盖率,正常和异常之间差异不显著(P>0.05),且所建立细菌文库的覆盖率均可达到99%以上,说明实验所建立的文库可比较真实有效地反映样本环境细菌多样性,具有研究意义和实用价值。
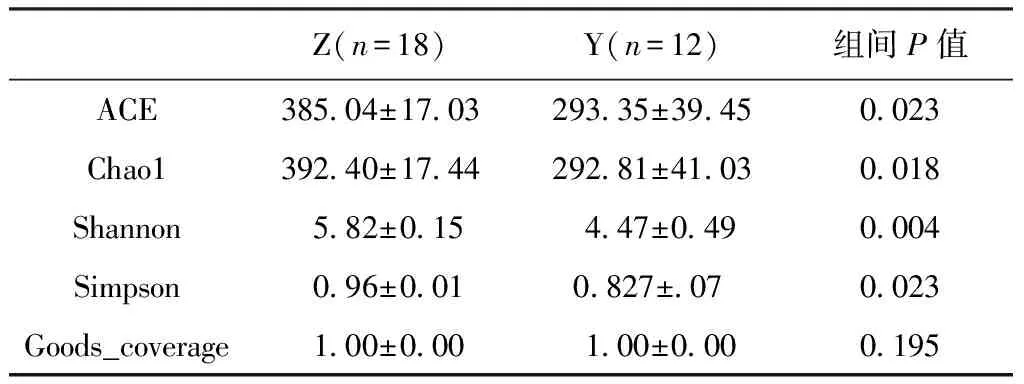
表2 Alpha多样性数据统计
2.3.3 物种Beta多样性分析 Beta多样性是生物多样性的重要组成部分, 多用于不同生态系统之间多样性的比较,即利用各样本序列间的进化关系及丰度信息来计算样本间距离,反映样本间是否具有显著的微生物群落差异的指标。
热图中颜色深浅代表了样本之间的相异程度,颜色越浅表示两个样本相异系数越小,物种多样性的差异越小。从中插彩版图4中可以看到Z组之间的颜色更浅,数值更接近于0,多样性的差异相对较小,换句话说Z组中菌群多样性差异不大,相似性更高。而Y组样品之间的菌群多样性差异较大。
3 讨论
本研究中断奶仔猪的大部分的生化指标均出现了差异显著的变化,也就是说在短短几天中断奶应激对仔猪造成的影响直接导致断奶仔猪最基础的生理指标发生明显变化,并在临床表征中明显体现。不过,我们会发现在试验中ALB、CHO、LDH在两组数据中的变化并不明显。主要是由白蛋白(ALB)和球蛋白(GLB)两种成分构成血清中的总蛋白(TP),并且由肝脏合成而来。占总蛋白一半以上的白蛋白既可以作为缓冲剂,维持血容量,也可以作为某些物质的运输载体,维护血液pH值稳定[7]。而球蛋白则主要与机体免疫有关,我们会发现在我们的试验中总蛋白的变化差异极显著,可白蛋白的变化不显著,这可能与应激仔猪主动发动免疫,抗体水平升高有关[8]。血清总胆固醇(CHO)是由肝脏合成并储藏其中,CHO的数值能反映肝脏和体内脂肪代谢情况[9],乳酸脱氢酶(LDH)是糖代谢过程中不可缺少的酶类[10],断奶仔猪无论正常组还是异常组总胆固醇均发生变化,但两组中的差异并不明显,说明断奶应激对仔猪造成的影响无论是否出现临床症状,均会对机体脂肪代谢和糖代谢造成损伤。
有研究表明,在动物不同年龄阶段,不同的食物摄入会对肠道微生物的构成有很大影响,特别是在断奶期间[11-12]。肠道内的核心菌群及其多样性会直接影响肠道的消化吸收功能,并对其免疫功能的激发产生影响[13]。肠道中大量复杂的微生物菌群对动物机体抵御外来微生物的入侵起着不可或缺的作用,并在长期相互作用下使肠道获得适应性的免疫,也通过寄主产生的炎性细胞因子刺激自身免疫系统发力,进而阻止肠炎的发生[14]。本研究中肠道的优势菌群为梭菌纲(Clostridia)、拟杆菌纲(Bacteroidia)和芽孢杆菌纲(Bacilli),而正常组中梭菌占优势很可能由于有报道称梭菌可以提高仔猪的免疫功能和抗氧化能力,增加肠绒毛高度、加深空肠和回肠的隐窝深度,从而改善断奶仔猪的生产性能[15],梭菌还在改善仔猪肠道环境,减少断奶仔猪腹泻方面有显著的作用[16]。
腹泻会造成肠道菌群失调,菌群数量和比例会发生复杂变化。与异常组相比,正常组的菌群多样性会更丰富,并且每个样品间的差异性并不大,这可能是仔猪肠道丰富的微生物菌群激发肠道的强大的免疫调节功能有关。对于仔猪来说丰富的肠道菌群更能缓冲有害菌群对机体造成影响,从而不易表现出临床症状,这与生化指标的变化相一致。出现腹泻后,肠道菌群的多样性和占比会发生变化,个体样本差异性大则与腹泻造成的肠道菌群严重失调有关[17],这与本研究相一致。
天津地区断奶仔猪粪便中,断奶应激会对断奶仔猪造成一系列影响,变化包括生化指标、粪便形态、肠道菌群多样性等方面。
在断奶持续过程中,出现临床症状的仔猪生化指标与未出现症状的仔猪相比,生化指标会有显著差异(P<0.05),说明断奶应激对仔猪正常的生理状态会产生明显的损伤,尤其是那些已经出现腹泻的仔猪。但从免疫功能建立、脂肪代谢和糖代谢的角度来看,无论断奶仔猪是否出现临床症状,仔猪体内的相应指标均会发生变化,且并没有明显差异(P>0.05)。
在我们所采集的正常组和异常组的样品中,可以看出两组中出现了物种的交集。样品从门水平上来说,优势菌群主要集中在Firmicutes(厚壁菌门)和Bacteroidetes(拟杆菌门),但比例有所不同。从纲水平来分析,正常组中Clostridia(梭菌纲)的相对值最高,达到42%,Bacteroidia(拟杆菌纲)和Bacilli(芽孢杆菌纲)占比33%和11%,分列二、三;虽然在异常组中占据前列的同样是这3个物种,但所占比例发生了变化,Bacilli冲在前列为30%,Clostridia和Bacteroidia均占比26%紧随其后。
正常粪便的细菌菌群多样性明显高于异常粪便,但每个样本之间的物种多样性差异较小。这可能与腹泻仔猪肠道内某些微生物菌群的减少导致机体免疫和肠道营养物质吸收能力减弱休戚相关。
