金属氢化物热能储存及其研究进展
2019-11-08周承商刘煌刘咏史全
周承商,刘煌,刘咏,史全
金属氢化物热能储存及其研究进展
周承商1,刘煌1,刘咏1,史全2, 3
(1. 中南大学 粉末冶金国家重点实验室,长沙 410083;2. 中国科学院大连化学物理研究所 热化学实验室,大连 116023;3. 辽宁省能源材料热化学重点实验室,大连 116023)
近年来,金属氢化物作为高密度储热材料得到了国内外研究者的广泛关注。本文介绍金属氢化物的热化学性质和储热系统工作原理。结合近年来的研究进展和动态,对金属氢化物作为高温、中温、低温储热材料的工作温度、压力、储热密度等进行分析和讨论,对金属氢化物热能存储的制冷、热泵等应用和发展趋势进行论述。
热能存储;金属氢化物;储热材料;氢化物床;热泵
受20世纪70年代世界范围内石油危机的影响以及氢能源技术的兴起,新型储氢材料引起广泛关注[1]。20世纪五六十年代相继发现的一系列储氢合金材料,如LaNi5,TiFe和Mg2Ni等合金[2−4],这些合金能够在适宜的温度下可逆地储存和释放氢气,是理想的储氢材料。一些金属氢化物不仅可作为储氢材料,也是理想的热化学储热材料[5]。金属氢化物的储热原理是利用其可逆吸放氢化学反应的反应焓(enthalpy)进行热能的储存或释放。相比于水、导热油、熔盐、混凝土等显热蓄热及潜热蓄热类型的储热材料,金属氢化物储热具有储热能量密度高、易于控制、反应速度快、热损失小等优点,是一种极具应用前景的新型储能技术,近年来受到国内外研究者的广泛关注,成为热能存储领域的一个新的研究热点。本文作者系统介绍金属氢化物的热化学性质和储热系统工作原理,以及近年来相关的研究进展。
1 金属氢化物及其氢反应
金属氢化物是由一种或多种金属元素与氢元素化合形成的化合物。按化合状态,金属氢化物可分为离子型氢化物和金属型氢化物2类。离子型氢化物,又称为盐型氢化物,一般由碱金属或碱土金属与氢元素化合形成,其中氢获得电子成为H−离子。典型的离子型氢化物包括LiH,MgH2,CaH2,LiAlH4和NaAlH4等。金属型氢化物一般由过渡金属元素与氢结合形成,具有部分金属的特征。具有代表性的金属型氢化物包括LaNi5H6,TiFeH2和TiMn1.5H2.5等。一般来说,储氢合金在一定的温度和氢气压力范围内形成氢化物,释放热量;而逆反应为氢化物分解,释放氢气,同时吸收热量。储氢合金的吸放氢反应式如下:
式中:Δ为反应焓,即单位物质在反应过程中释放或吸收的热量。利用Δ和式(2)即可计算材料的理论储热质量密度:
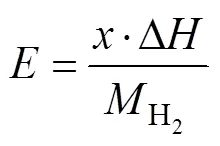
式中:Δ为氢化物的标准摩尔氢反应焓;为材料单位质量的储氢量;H2为氢气的相对分子质量 (2 g/mol)。
常用的相变储热、潜热蓄热材料如水、导热油、混凝土等,其质量储热密度分别为333,735和360 kJ/kg[6−9]。相比之下,基于吸放氢过程中的反应焓,金属氢化物通常具有较高的储热密度,如MgH2,TiH2和CaH2的质量储热密度分别为2 850,2 840和4 275 kJ/kg,体积储热密度分别为3 933,10 650和8 165 MJ/m3[10−12],因此,这3种氢化物均是理想的高温储热材料。MgH2和Mg2NiH4的反应温度在200~500 ℃,适用于中温储热[6, 13]。TiFe、LaNi5等储氢合金虽然质量比能量密度偏小,但体积比能量密度较高,适用于低温储热、制冷和热泵等应用[14]。
2 热力学和动力学性质
2.1 热力学性质
前文提到,金属氢化物的储热过程是通过吸氢–放氢的热化学反应实现的。因此,系统的设计,特别是氢化物储热材料的选择,需要以金属氢化物的热力学和动力学性质为基础。氢化物材料热力学涉及到氢反应的方向,而动力学性能主要涉及吸放氢反应速度。首先,对于金属氢化物的热力学性能,吸放氢反应的平衡态氢气压力()、材料氢含量()和温度()这3个关键参数相关。图1(a)所示为理想材料的--曲 线[15],即在不同温度下的-曲线。曲线描述的是在恒定温度条件下,氢气分压跟氢浓度(即吸氢量)之间的关系,即金属(α相)与氢化物(β相)在不同氢气分压下的α−β相变过程。从图1(a)可知,α相向β相转变的吸氢反应中,-曲线存在一段平台,对应的纵坐标为反应的氢气平衡压,而平台的长度对应该相变下的吸氢量。将温度和-曲线中的压力代入范特霍夫方程(Van’t Hoff equation),可得到反应焓、熵等热力学数据,如图1(b)所示。Van’t Hoff关系式为:
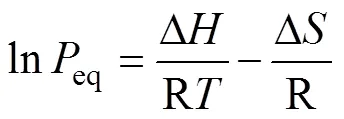
式中:eq为温度下的氢气平衡分压;R为理想气体常数;Δ和Δ分别为反应焓和熵。
需要指出的是,许多金属氢化物在实际条件下的等温--平台往往存在一定的斜率(slope),如图2所示。具体表现为在等温平台的吸氢过程中(由金属相α转变为氢化物相β间),随材料的吸氢量增加,需要逐渐提高氢气压力才能继续吸氢。逆反应则需要进一步降低氢气压力才能维持放氢反应。另外,吸放氢反应存在滞后效应(hysteresis),即吸氢平衡氢压总是高于放氢平衡氢压。事实上,较大的平台斜率和吸放氢滞后对储热应用是不利的。研究发现,不同种类的氢化物的--曲线差异明显,在实际应用时需要加以考虑[16]。
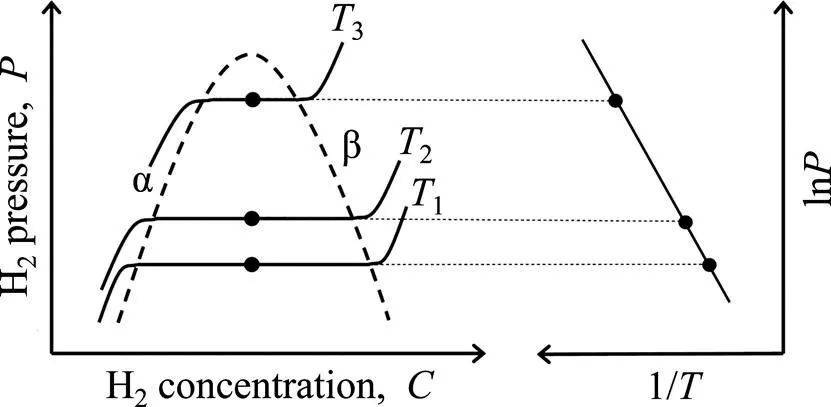
图1 理想金属氢化物的P-C-T (pressure-H2 content-temperature)曲线(a)和P-C-T曲线对应的Van’t Hoff关系图(b)
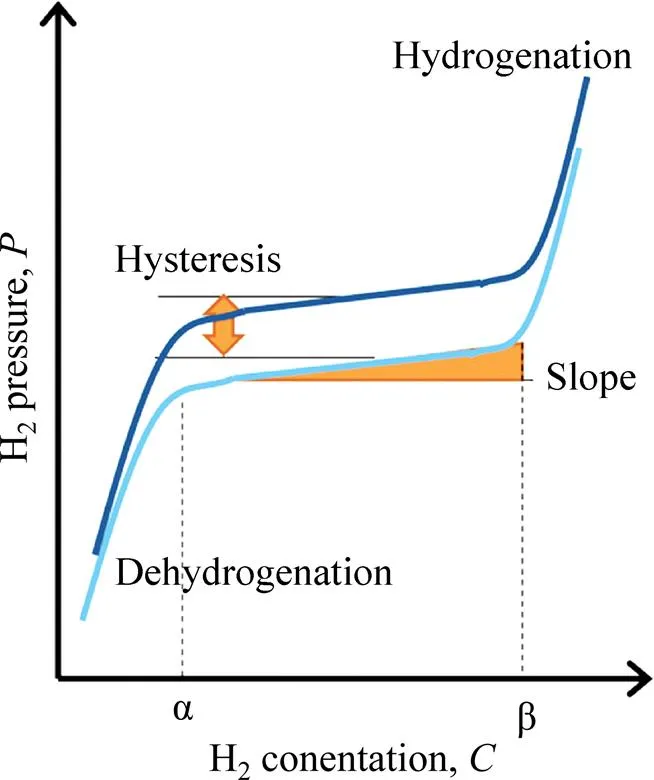
图2 实际情况下金属氢化物的等温吸氢与放氢的P-C-T曲线
2.2 动力学性质
氢化物的吸放氢反应动力学是储热性能的关键要素之一。反应动力学直接决定吸放氢反应的速率,进而决定储热材料的吸热–放热速率。对于氢化物吸放氢反应动力学的机制和理论研究,已有许多文献介 绍[17−20]。对储热系统而言,氢化物反应动力学性能的改善可提升能量转换效率。换而言之,更快的反应速率能提升热量吸收或释放的功率。一般认为,储氢合金的吸氢反应可解析为几个阶段[21]:1) 氢分子的表面吸附;2) 氢分子分解为氢原子;3) 氢原子向固相内部迁移(扩散);4) 氢化物相的形核;5) 氢化物相长大。而放氢反应则相反。对吸放氢反应动力学的理论描述,主流模型为扩散模型和形核模型。目前广泛采用的是晶体形核生长模型(Johnson-Mehl-Avrami, JMA)。JMA模型是建立在平衡态或近平衡态(即等温过程)过程的反应动力学模型[22−23],用下式表示:

两边取对数,得:

式中:为反应产物的体积分数;为反应时间;为Avrami指数(或称为反应级数);为反应速率常数,与吸放氢反应的温度和压力有关。图3(a)所示为金属氢化物的典型吸氢反应动力学曲线,图3(b)所示为采用JMA模型的线性拟合图,由图3(b)的拟合得到和ln的值。进一步地,得到在不同温度下的反应速率常数,利用式(6)所示的阿伦尼乌斯关系(Arrhenius relation)计算出氢化物材料的吸/放氢反应激活能a。
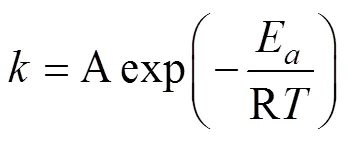
式中:为温度下的反应速率常数;A为指前因子;a为激活能;R为理想气体常数。
值得注意的是,合金/氢化物的热传导效应,往往是决定吸氢−放氢反应速率的关键因素。GOODELL[24]发现LaNi5在25 ℃、氢压为平衡压力2倍条件下,氢化反应速度非常快,在0.5 s就可完成75%的吸氢。如此快速的吸氢反应会伴随大量的反应热释放,导致材料显著的自加热效应。而且氢化物的热导率一般低于合金材料,因此吸氢过程的瞬时温升可达数十摄氏 度[25−26]。因此对于一些反应速率较快的储氢材料,热传导往往是其限制性因素。由此可见,氢化物反应床的宏观吸放氢速率,由氢化物反应动力学和反应器整体传热性能两者共同决定,所以材料传热的问题和优化方法在氢化物储热系统设计中也应重点考虑[10, 27]。
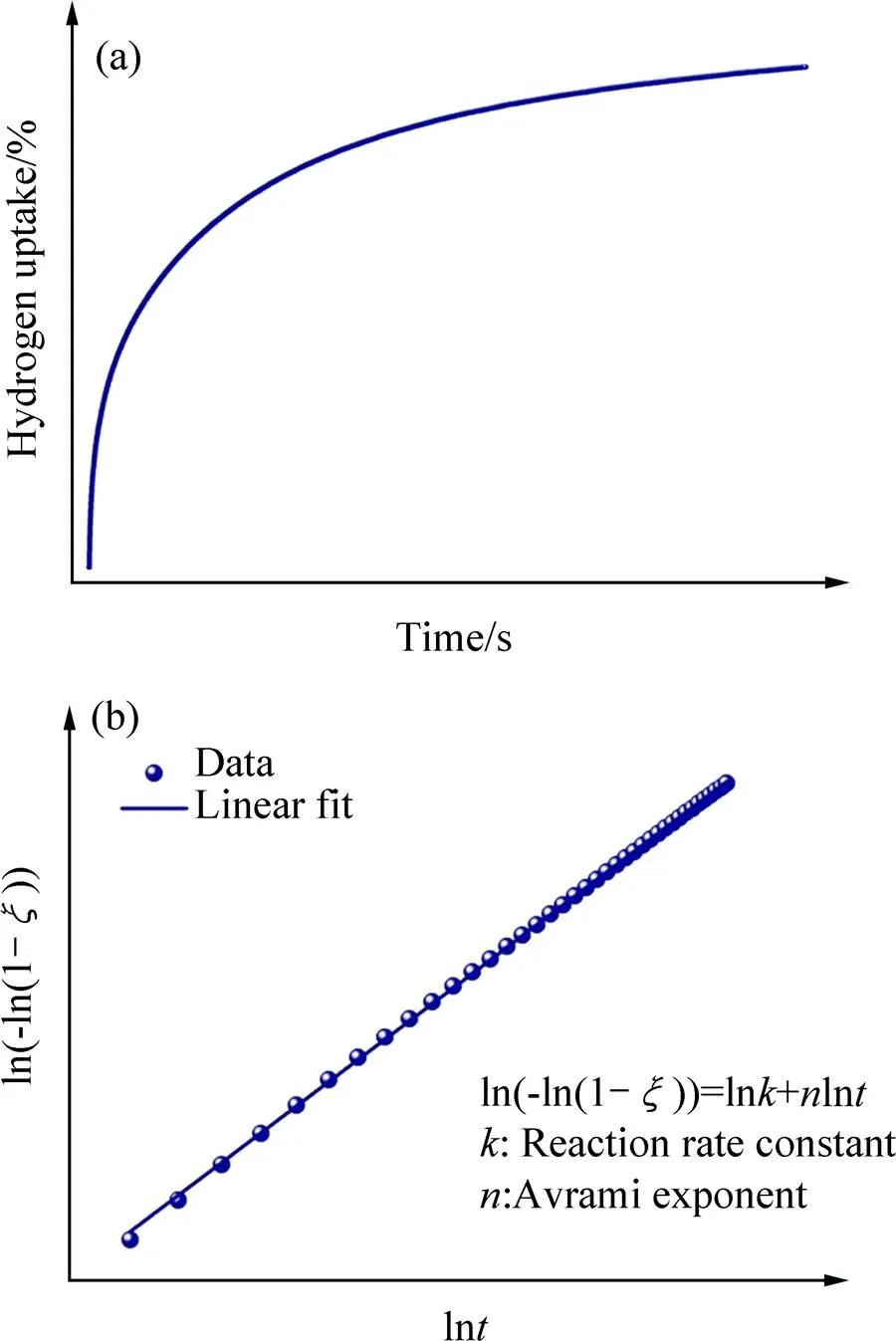
图3 典型金属氢化物的反应动力学曲线(a)和采用JMA模型的线性拟合图(b)
3 氢化物储热系统的工作原理
金属氢化物储热基于化学能与热能的转换,因而也被称为热电池(thermal battery)。氢化物储热系统的工作原理,是利用金属氢化物分解和吸氢放热(式(1)所示)来存储和释放热能的。图4(a)和5(a)所示分别为单氢化物床储热系统的工作示意图和热力循环过程示意图。在放能过程中(discharge),氢气被导回到氢化物床,金属或合金吸收氢气同时释放热量;在储能过程中(recharge),氢化物床中的金属氢化物吸收热量,分解释放出氢气,氢气储存在氢气罐内。由图5(a)可见,通过控制氢化物的可逆吸放氢反应,系统实现重复的热能充放循环。单氢化物床系统在A-B点间循环往复充放能量,氢化物吸收热量,在高温点A释放氢气,然后释放热量,冷却至低温点B点吸附氢气[28]。
单氢化物床的储存氢气的氢气罐体积大、安全性低,采用双氢化物床的设计是有利的选择。即以一个氢化物床释放氢气吸收热量的同时,另一个氢化物床存储氢气。这种双氢化物床储热系统的工作原理和热力循环分别如图4(b)和5(b)所示。双氢化物床使用2种氢化物材料:在高温氢化物床内装填具有较低氢平衡压的氢化物,也称为高温氢化物(high-temperature hydride),具有较大的反应焓,其功能为储存热能;而低温氢化物床内装填具有较低氢平衡压的氢化物,称为低温氢化物(low-temperature hydride),具有较低的反应焓,其功能为储存氢气。双氢化物床系统在放能过程中,高温氢化物吸氢放热,同时低温氢化物放氢吸热;在充能过程中,加热高温氢化物,使其分解放氢,氢气返回,被低温氢化物吸收,形成一个充放能循环。如图4(b)所示,系统中的氢按A-B-C-D顺序循环。双氢化物床的设计未使用体积庞大、安全系数低的氢气储罐,且在放能时低温氢化物可制冷,实现冷/热复合存储,系统具有更好的适用性和功能性。
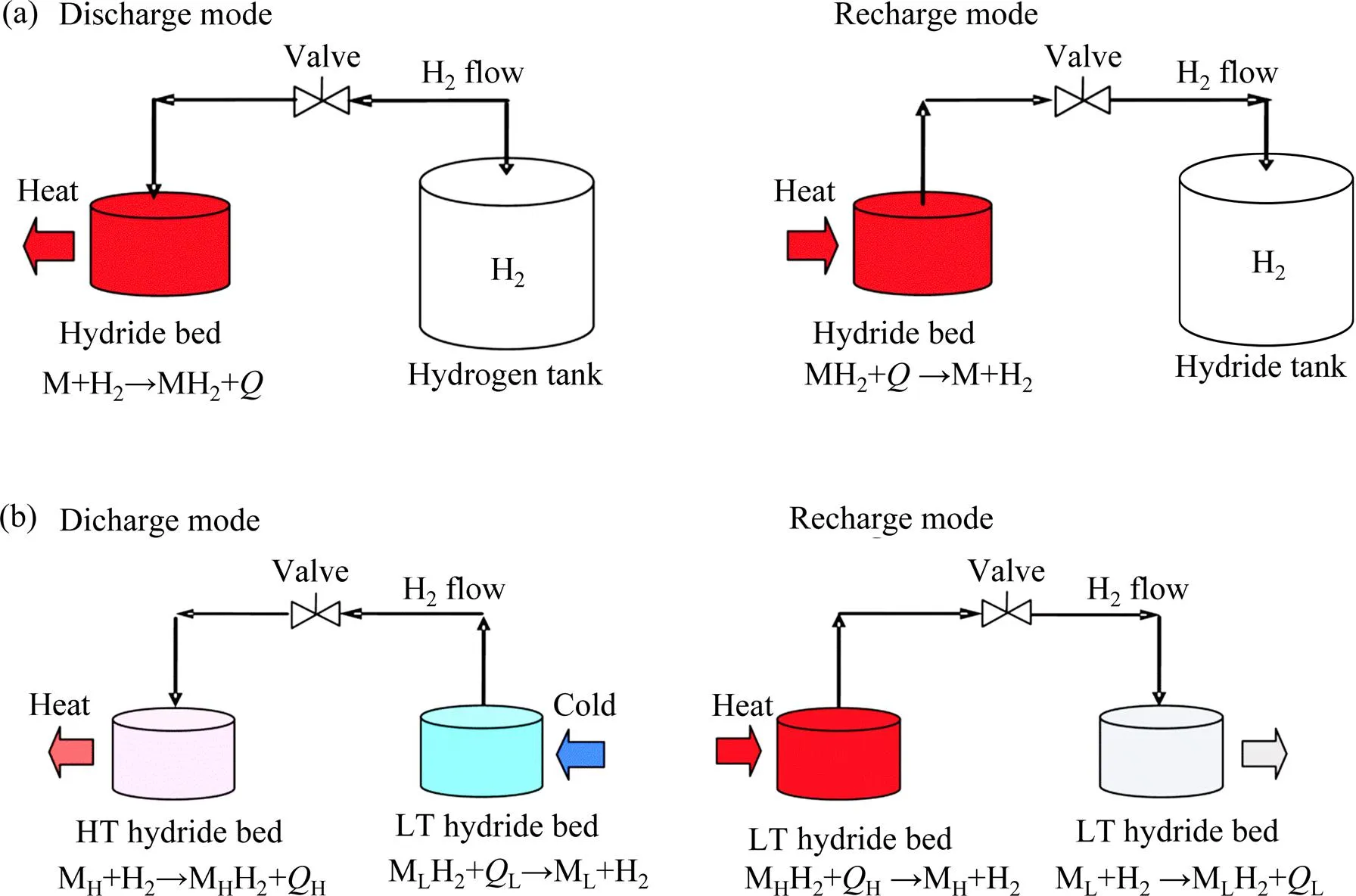
图4 单氢化物床储热系统(a)和双氢化物床储热系统(b)工作原理示意图
双氢化物床储热系统设计中,选择匹配的冷–热氢化物非常关键,直接关系到储热系统的能量密度、储热性能和成本等。选择氢化物材料时,需要考虑如下因素:
1) 根据储热系统的设计要求(如温度、压力),选择热力学性能匹配的氢化物体系。
2) 具有较好的吸放氢反应动力学性能,或能够经催化改性得以改善。
3) 良好的循环性能,在长期循环后储氢量不衰减或少衰减,动力学和热力学性能均稳定。
4)-曲线的平台斜率小,滞后小。
4 氢化物储热应用
4.1 中、高温储热
近年来,储热(蓄热)技术受到广泛关注。特别是在太阳能热电应用中,电站在白天收集的太阳能,一部分需要以热能的形态储存起来,在晚上释放热量驱动电机提供电力。可见,储热系统是太阳能热电的关键配套技术之一。由于金属氢化物储热系统具有高储热密度、热损耗小的优势,成为下一代太阳能集热存储的研究热点。表1所列为一些适于储热应用的金属氢化物的热力学性质和储热性能。
根据太阳能集热方式的不同,储热系统可分为高温和中温储热系统。高温储热系统可作为太阳能集热辅助储热。高温氢化物主要有LiH,TiH2和CaH2等,其中LiH是最早用于太阳能集热系统研究的高温储氢材料。早在19世纪60年代末,CALDWELL等[29]用LiH作为储热材料设计了最高温度达760 ℃的太阳能集热系统,设想为近地轨道卫星的能量转换系统提供连续的热量。对于大型太阳能热电站的储热系统,储热温度要求在700~1 100 ℃甚至更高。TiH2具有较好的成本优势,其氢平衡压在1个大气压下的温度为643 ℃,储热温度为600~800 ℃。FRIEDLMEIER 等[27, 30]实验证实了TiH2可用作高温储热材料,并进一步发现钛粉即使在室温下亦能较快的吸放氢。在美国能源部的资助下,RONNEBRO等[31]开发了基于TiH2的太阳能储热原型系统,能量密度达到200 (kW·h)/m3,试验系统可在635~645 ℃循环运行60次以上,满足太阳能高温储热系统的性能要求。氢化钙(CaH2)的工作温度范围为900~1 100 ℃,质量储热密度高达4 312 kJ/kg,每千克CaH2可储存1.25 kW·h的能量,是理想的高温氢化物储热材料。BUCKLEY 等[32]采用CaH2对太阳能储热系统开展研究,设计制造了50 kg氢化物的反应储罐。北京科技大学李平等[33]研究了LiBH4/CaH2复合材料的储热性能,其储热密度为3 500 kJ/kg,在450 ℃的平衡压为0.48 MPa,脱氢后产物为LiH和CaB6。高温储热氢化物还有NaH、KH等碱金属氢化物,但这类氢化物的主要缺点在于其高温腐蚀性较强,对反应器材料要求严苛。
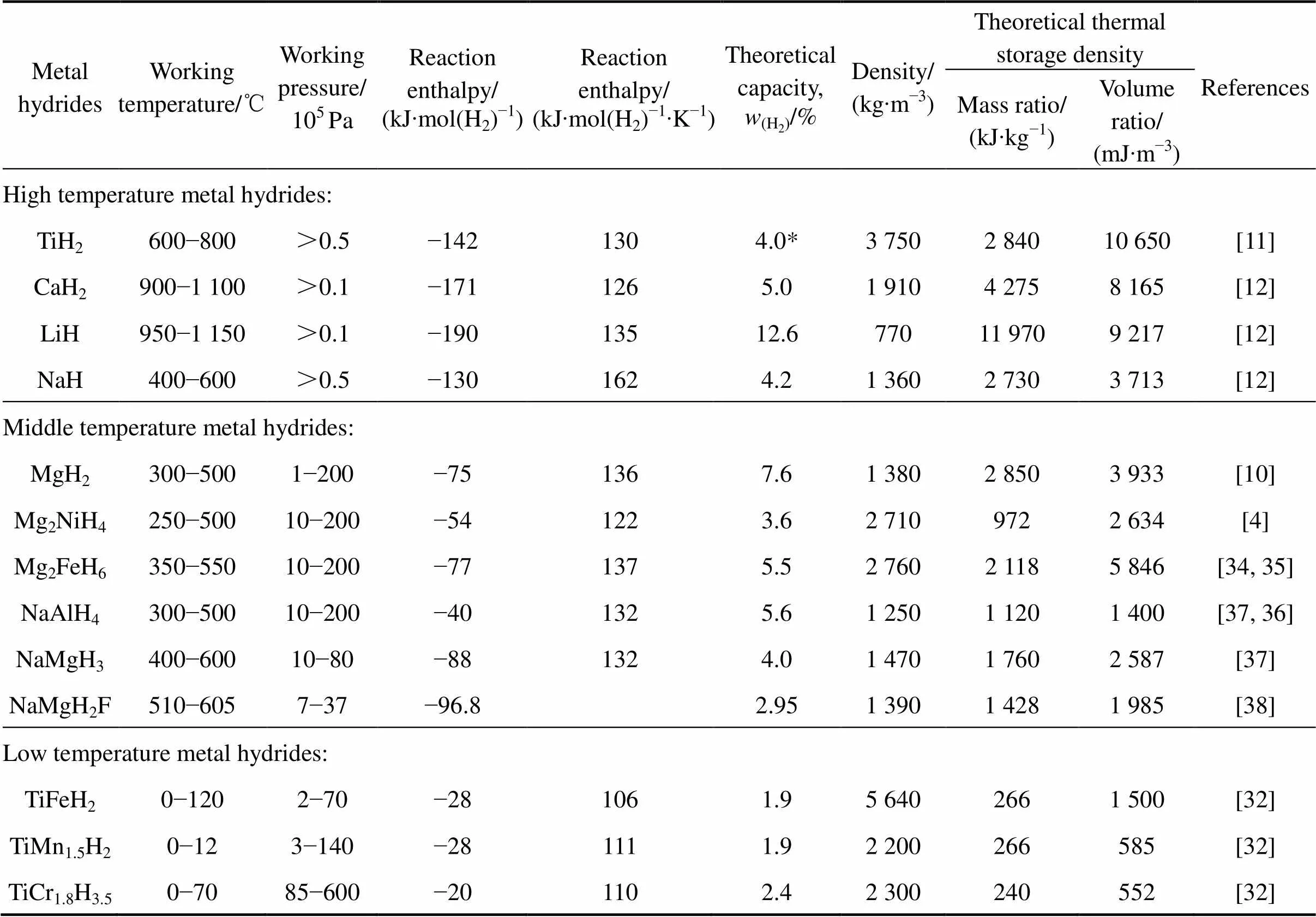
表1 部分金属氢化物的热化学储能性质
Note: *Ti has two phase transition processes of α-β,β-γ. For the β-γ hydrogenation process, at 600 ℃, the hydrogen storage (mass fraction) is about 1.5%, and the heat storage density is about 1 065 kJ/kg
镁基氢化物是较典型的中温储热材料,如MgH2,Mg2NiH4,Mg2FeH6和NaMgH3。由于其较高的储热容量,是一类重要的中温储热材料。德国马普所BOGDANOVIC等[6]在1990年提出利用Mg-H2系统的热化学反应进行热能存储,适用温度区间在300~ 500 ℃,可用储氢量(质量分数)为6%~6.5%,具有较低的反应滞后、良好的循环性能以及较高的热导率。德国马普所、斯图加特大学IKE研究所和HTC太阳能公司共同研制了首个基于MgH2材料的小型太阳能发电站,该发电站结合了MgH2太阳能集热系统以及Ti-Fe-Cr-V-Mn材料的低温储氢罐,工作温度为 300~ 480 ℃,总蓄热量达12 kW·h[32, 36]。美国犹他大学的 FANG 等[39]提出了一种基于具有高储能密度的MgH2材料的车载氢化物储热系统,可降低新能源车用空调对动力电池的能量消耗。该系统采用的储热氢化物为经催化的MgH2[40−41]和TiV0.62Mn1.5,设计储热量为2.5 kW·h,设计制造的小型原型机,测试获得了满意的结果。西安交大张早校等[42]设计了基于MgH2和LaNi5材料的热能存储系统,通过多层结构的设计,缩短了系统放氢所用的时间,并将系统的放热温度提高近5 ℃。需要指出,MgH2一般需要添加少量的过渡金属催化剂(如Ni、Ti、V等)以改善其反应动力学性能,而这方面的研究是MgH2作为储能材料近年受到广泛关注和研究的方向,催化改性的MgH2的反应性能已能较好地满足中高温储热系统的使用要求[43−45]。北京有色金属研究院WAN等[46]采用LaNi5掺杂MgH2制备的Mg-16%LaNi5储热材料, 利用材料吸放氢循环过程中生成的Mg2NiH4,Mg2NiH0.3和La4H12.19相作为催化剂,提升了材料的储热性能,其反应焓为74.62 kJ/mol(H2)。北京科技大学李平等[47]制备了Ca(BH4)2/MgH2复合储热材料,并通过NbF5掺杂改善材料的循环性能,在350 ℃的平衡压为0.5 MPa,反应焓达到48 kJ/mol(H2)。另外,改善MgH2材料的热导率是一个值得关注的方向。通过添加新型碳材料,如碳纳米管[48]、石墨烯[49],并结合纳米结构改性,能极大地提高材料的热导率,进而提升储热系统的工作效率。
近年针对其他镁基氢化物体系的储热研究也非常活跃。Mg2FeH6被认为是一种具有较好前景的储热氢化物。相比MgH2体系,Mg2FeH6的反应焓和使用温度略高,储氢容量略低。德国的URBANCZYK等[50]研制了基于Mg2FeH6的储热系统,系统采用液态熔盐在高于300 ℃温度下作为系统导热介质,实现了1.5 kW·h的热能存储,可用于工业废热的回收。此外, 澳大利亚的SHEPPARD等[51]提出用NaMgH3、NaMgH2F[38]等氢化物作为太阳能热电应用的储热介质。研究发现,NaMgH3的首步放氢反应储氢量(质量分数)和反应焓分别为4.0%和86.6 kJ/mol(H2),NaMg- H2F的理论储氢量和反应焓分别为2.95%和96.8 kJ/mol (H2),这两者与Mg2FeH6相比储热温度略高。李平等[52]采用快速凝固法制备的Ce12Mg17合金,在400 ℃的平衡压为0.91 MPa,反应焓为75.5 kJ/mol(H2)。
低温储氢氢化物,一般要求材料在室温附近储存和释放氢气。该类氢化物也可用作低温储热(储冷)。经过多年的研发,已有大量体系和合金材料可供挑选。选择低温氢化物时,成本和可靠性是较多关注的因素,可选择较成熟的储氢合金材料,如TiFe,LaNi5,TiMn2等。BUCKLEY[32]对此类氢化物的性能和成本进行了分析和讨论。
4.2 热泵应用
金属氢化物还可应用于热泵系统[53−54]。氢化物热泵的原理也是利用储氢合金的热化学反应进行制冷、制热、增热,与储热系统的区别在于内置的储氢合金用于热能转化而非用作储热材料,其系统的工作原理与上述氢化物储热的工作原理一致。金属氢化物的热泵系统既可利用电能驱动[55],也能够利用工业废热、太阳能等低品热能实现制冷和制热等功能[56]。这是氢化物热泵系统的一个显著优势。
北京有色金属研究总院和中科院低温技术实验中心合作研制的基于氢化物压缩机的氢液化装置,结合了微型制冷器和氢化物压缩机,可在25 K下获得0.4 W的制冷量[57]。浙江大学王新华[58]以汽车发动机尾气作为驱动热源,采用Ti0.65Zr0.35Mn1.4Cr0.2(V-Fe)0.4- (Mm0.8La0.2)(Ni4.35Fe0.65)作为储氢合金对,设计了汽车氢化物空调器,计算出3对合金组成的复合氢化物床空调系统的能效比(COP, coefficient of performance)为0.46。上海交通大学覃峰等[59]在可用于尾气驱动型车用金属氢化物制冷/空调系统的LaNi4.61Mn0.26Al0.13- La0.6Y0.4Ni4.8Mn0.2储氢合金的基础上,设计了工作温度为150 ℃/20~50 ℃/0 ℃的功能验证型金属氢化物间歇制冷系统,制冷功率为238 W。此外,北京航空航天大学林贵平等[60−61]研究了金属氢化物热泵应用于载人航天生命保障系统的可行性,结果表明金属氢化物热泵可与辐射器相结合,组成航天服热控系统的冷源,甚至还可用于航天设备的冷却和航天员备用食品的冷冻保鲜等。此外,北京航空航天大学[60]还建立开放式金属氢冷源系统的数学模型,研究了制冷和再生阶段的传热传质过程,指出金属氢化物热泵可短时间内使航天服获得低温冷却水,并通过反应床的压力来调节冷却水的温度,且在舱内实现金属氢化物的再生。
值得指出的是,氢化物热泵中的反应器(反应床)设计、热交换方式以及氢化物的选择对氢化物的储热应用具有重要意义。因为材料优化选择和传热传质均对最终系统的热效率起着关键性的作用。孙大文等[62]对金属氢化物热泵的特性参数进行了计算分析,指出热泵系统应选择具有低平台斜率和低滞后的金属氢化物,并尽可能减少反应器材料的比热容和质量,以提高热泵的能效比。鲍泽威[63]通过圆柱反应器的二维多物理场模型,研究了金属氢化物反应器吸氢过程的热质传递特性,指出要通过增加金属氢化物床的有效导热系数来强化换热,从而加快吸氢反应过程,提高热泵和蓄热反应器的平均功率。阳明等[64]设计的一种具有良好传热性能的金属氢化物反应床,提高了金属氢化物粉末的有效热导率,反应床中未活化的合金粉末有效热导率达7.5 W/(m·K)。SHEN等[65]通过建立Mg/ MgH2体系放热过程的二维数学模型,研究Mg/MgH2体系的瞬态传热传质过程,结果表明加入泡沫金属可提高反应床的导热系数,从而减少反应时间并提高输出功率。
5 展望
随着世界化石能源的日趋紧缺,以及人们对全球气候变化的关注,对新能源的开发利用已成为能源领域最重要的方向之一。多数能源的利用以及最终形式几乎都涉及到热能形态。能源的使用和转化过程中,大量的能量以热能的形态被消耗和损失。因此,将热能以合适的手段加以存储、转化和利用,能够带来巨大的经济效益。金属氢化物作为一种新型储热材料,具有储热能量密度高、反应速度快、循环性能好、热导率高等优点,然而,目前其实际商业化应用并不广泛。相比于传统技术而言,金属氢化物储热技术具有许多独特性和潜在优势,因而在新能源存储、电网调峰储能、废热回收、采暖等许多领域有广泛的应用 前景。
[1] 朱敏. 先进储氢材料导论[M]. 北京: 科学出版社, 2015: 1−24. ZHU Min. Introduction to Advanced Hydrogen Storage Materials[M]. Beijing: Science Press, 2015: 1−24.
[2] REILLY J J, WISWALL R H. Formation and properties of iron titanium hydride[J]. Inorganic Chemistry, 1974. 13(1): 218−222.
[3] VAN MAL H H, BUSCHOW K H J, MIEDEMA A R. Hydrogen absorption in LaNi5and related compounds: Experimental observations and their explanation[J]. Journal of the Less Common Metals, 1974. 35(1): 65−76.
[4] REILLY J J, WISWALL R H. Reaction of hydrogen with alloys of magnesium and nickel and the formation of Mg2NiH4[J]. Inorganic Chemistry, 1968, 7(11): 2254−2256.
[5] 朱兴华, 王荣明. 储氢材料的储热功能[J]. 机械工程材料, 1999(6): 48−50. ZHU Xinghua, WANG Rongming. Heat storage function of hydrogen storage materials[J]. Mechanical Engineering Materials, 1999(6): 48−50.
[6] BOGDANOVIC B, RITTER A, SPLIETHOFF B. Active MgH2-Mg systems for reversible chemical energy storage[J]. Angewandte Chemie International Edition in English, 1990. 29(3): 223−234.
[7] QU XuanHui, LI Yang, LI Ping, et al, The development of metal hydrides using as concentrating solar thermal storage materials[J]. Frontiers of Materials Science, 2015, 9(4): 317− 331.
[8] MICHAEL F, BORISLAV B. High temperature metal hydrides as heat storage materials for solar and related applications[J]. International Journal of Molecular Sciences, 2009, 10(1): 325− 344.
[9] SHARMA S D, KAZUNOBU Sagara. Latent heat storage materials and systems: A review[J]. International Journal of Green Energy, 2005, 2(1): 1−56.
[10] CHAISE A, RANGO P D, MARTY P, et al. Experimental and numerical study of a magnesium hydride tank[J]. International Journal of Hydrogen Energy, 2010, 35(12): 6311−6322.
[11] GOLBEN P M, DACOSTA D, SANDROCK G. Hydride-based cold-start heater for automotive catalyst[J]. Journal of Alloys and Compounds, 1997, 253–254: 686−688.
[12] CORGNALE C, HARDY B, MOTYKA T, et al. Screening analysis of metal hydride based thermal energy storage systems for concentrating solar power plants[J]. Renewable and Sustainable Energy Reviews, 2014, 38: 821−833.
[13] 万琦, 蒋利军, 李志念, 等. 太阳能集热发电用Mg基储热材料的研究现状[J]. 新材料产业, 2016(5): 58−62. WAN Qi, JIANG Lijun, LI Zhinian, et al. Research status of Mg-based heat storage materials for solar collector power generation[J]. New Material Industry, 2016(5): 58−62.
[14] 王新华, 陈长聘. 金属氢化物热泵的研究进展[J]. 材料导报, 1994(5): 16−19. WANG Xinhua, CHEN Changping. Research progress of metal hydride heat pump[J]. Material Report, 1994(5): 16−19.
[15] SCHLAPBACH L, ZUTTEL A. Hydrogen-storage materials for mobile applications[J]. Nature, 2001, 414(6861): 353−358.
[16] YARTYS V A , LOTOTSKYY M, LINKOV V, et al. Metal hydride hydrogen compression: recent advances and future prospects[J]. Applied Physics A, 2016, 122(4): 415.
[17] SUN Y, SHEN C, LAI Q, et al. Tailoring magnesium based materials for hydrogen storage through synthesis: Current state of the art[J]. Energy Storage Materials, 2018, 10: 168−198.
[18] PANG Y, LI Q. A review on kinetic models and corresponding analysis methods for hydrogen storage materials[J]. international journal of hydrogen energy, 2016, 41(40): 18072−18087.
[19] KITAGAWA Y, TANABE K. Development of a kinetic model of hydrogen absorption and desorption in magnesium and analysis of the rate-determining step[J]. Chemical Physics Letters, 2018, 699: 132−138.
[20] PAN Y B, WU Y F, LI Q. Modeling and analyzing the hydriding kinetics of Mg-LaNi5composites by Chou model[J]. International Journal of Hydrogen Energy, 2011, 36(20): 12892− 12901.
[21] LU J, CHOI Y J, FANG Z Z, et al. Hydrogenation of nanocrystalline Mg at room temperature in the presence of TiH2[J]. Journal of the American Chemical Society, 2010, 132(19): 6616−6617.
[22] AVRAMI M. Kinetics of phase change. I General theory[J]. The Journal of Chemical Physics, 1939, 7(12): 1103−1112.
[23] AVRAMI M. Kinetics of phase change. II transformation-time relations for random distribution of nuclei[J]. the Journal of Chemical Physics, 1940, 8(2): 212−224.
[24] GOODELL P D, RUDMAN P S. Hydriding and dehydriding rates of the LaNi5-H system[J]. Journal of The Less Common Metals, 1983, 89(1): 117−125.
[25] LI J, FAN P, FANG Z Z, et al. Kinetics of isothermal hydrogenation of magnesium with TiH2additive[J]. International Journal of Hydrogen Energy, 2014, 39(14): 7373−7381.
[26] GRAETZ J. New approaches to hydrogen storage[J]. Chemical Society Reviews, 2009, 38(1): 73−82.
[27] HARDY B J, ANTON D L. Hierarchical methodology for modeling hydrogen storage systems. Part II: Detailed models[J]. International Journal of Hydrogen Energy, 2009, 34(7): 2992− 3004.
[28] MUTHUKUMAR P, GROLL M. Metal hydride based heating and cooling systems: A review[J]. International Journal of Hydrogen Energy, 2010, 35(8): 3817−3831.
[29] CALDWELL R T, MCDONALD J W, PIETSCH A. Solar-energy receiver with lithium-hydride heat storage[J]. Solar Energy, 1965, 9(1): 48−60.
[30] FRIEDLMEIER G, WIERSE M, GROLL M. Titanium hydride for high-temperature thermal energy storage in solar-thermal power stations[J]. Zeitschrift Für Physikalische Chemie, 1994, 183(1/2): 175−183.
[31] RONNEBRO E, WHYATT G, POWELL M, et al. Metal hydrides for high-temperature power generation[J]. Energies, 2015, 8(8): 8406−8430.
[32] HARRIES D N, PASKEVICIUS M, SHEPPARD D A, et al. Concentrating solar thermal heat storage using metal hydrides[J]. Proceedings of the IEEE, 2011, 100(2): 539−549.
[33] LI Y, LI P, QU X. Investigation on LiBH4-CaH2composite and its potential for thermal energy storage[J]. Scientific reports, 2017, 7: 41754.
[34] REISER A, BOGDANOVIC B, SCHLICHTE K. The application of Mg-based metal-hydrides as heat energy storage systems[J]. International Journal of Hydrogen Energy, 2000, 25(5): 425−430.
[35] BOGDANOVIC B, REISER A, SCHLICHTE K, et al. Thermodynamics and dynamics of the Mg-Fe-H system and its potential for thermochemical thermal energy storage[J]. Journal of Alloys and Compounds, 2002, 345(1/2): 77−89.
[36] CORGNALE C, HARDY B, TAMBURELLO D A, et al. Acceptability envelope for metal hydride-based hydrogen storage systems[J]. International Journal of Hydrogen Energy, 2012, 37(3): 2812−2824.
[37] SHEPPARD D A, PASKEVICIUS M, BUCKLEY C E. Thermodynamics of hydrogen desorption from NaMgH3and its application as a solar heat storage medium[J]. Chemistry of Materials, 2011, 23(19): 4298−4300.
[38] SHEPPARD D A, CORGNALE C, HARDY B, et al. Hydriding characteristics of NaMgH2F with preliminary technical and cost evaluation of magnesium-based metal hydride materials for concentrating solar power thermal storage[J]. RSC Advances, 2014, 4(51): 26552−26562.
[39] FANG Z Z, ZHOU C, FAN P, et al. Metal hydrides based high energy density thermal battery[J]. Journal of Alloys and Compounds, 2015, 645: S184−S189.
[40] ZHOU C, FANG Z Z, LU J, et al. Thermodynamic and kinetic destabilization of magnesium hydride using Mg–In solid solution alloys[J]. Journal of the American Chemical Society, 2013, 135(30): 10982−10985.
[41] ZHOU C, FANG Z Z, REN C, et al. Effect of Ti intermetallic catalysts on hydrogen storage properties of magnesium hydride[J]. The Journal of Physical Chemistry C, 2013, 117(25): 12973−12980.
[42] FENG P, WU Z, ZHANG Y, et al. Multi-level configuration and optimization of a thermal energy storage system using a metal hydride pair[J]. Applied Energy, 2018, 217: 25−36.
[43] ZHANG J, YAN S, QU H. Recent progress in magnesium hydride modified through catalysis and nanoconfinement[J]. International Journal of Hydrogen Energy, 2018, 43(3): 1545− 1565.
[44] WAN Y, WANG Y. Recent advances in additive-enhanced magnesium hydride for hydrogen storage[J]. Progress in Natural Science: Materials International, 2017, 27(1): 41−49.
[45] ZHOU C, FANG Z Z, SUN P. An experimental survey of additives for improving dehydrogenation properties of magnesium hydride[J]. Journal of Power Sources, 2015, 278: 38−42.
[46] WAN Q, JIANG L J, LI Z N, et al. Thermal storage properties of Mg-LaNi using as a solar heat storage material[J]. Rare Metals, 2017: 1−8.
[47] LI Y, LI P, TAN Q, et al. Thermal properties and cycling performance of Ca(BH4)2/MgH2composite for energy storage[J]. Chemical Physics Letters, 2018, 700: 44−49.
[48] AMIRKHIZ B S, DANAIE M, Barnes M, et al. Hydrogen sorption cycling kinetic stability and microstructure of single-walled carbon nanotube (SWCNT) magnesium hydride (MgH2) nanocomposites[J]. The Journal of Physical Chemistry C, 2010, 114(7): 3265−3275.
[49] XIA G, TAN Y, CHEN X, et al. Monodisperse magnesium hydride nanoparticles uniformly self-assembled on graphene[J]. Advanced Materials, 2015, 27(39): 5981−5988.
[50] URBANCZYK R, PEINECKE K, PEIL S, et al. Development of a heat storage demonstration unit on the basis of Mg2FeH6as heat storage material and molten salt as heat transfer media[J]. International Journal of Hydrogen Energy, 2017, 42(19): 13818− 13826.
[51] SHEPPARD D A, PASKEVICIUS M, BUCKLEY C E. Thermodynamics of hydrogen desorption from NaMgH3and its application as a solar heat storage medium[J]. Chemistry of Materials, 2011, 23(19): 4298−4300.
[52] LI Y, LI P, WAN Q, et al. A study of metal hydride as novel thermal energy storage material by using rapid solidification[J]. Journal of Alloys and Compounds, 2016, 689: 641−647.
[53] LOTOTSKYY M V, YARTYS V A, POLLET B G, et al. Metal hydride hydrogen compressors: A review[J]. International Journal of Hydrogen Energy, 2014, 39(11): 5818−5851.
[54] BHUIYA M M H, KUMAR A, KIM K J. Metal hydrides in engineering systems, processes, and devices: A review of non-storage applications[J]. International Journal of Hydrogen Energy, 2015, 40(5): 2231−2247.
[55] MAGNETTO D, MOLA S, DACOSTA D H, et al. A metal hydride mobile air conditioning system[R]. SAE Technical Paper, 2006.
[56] MUTHUKUMAR P, GROLL M. Metal hydride based heating and cooling systems: A review[J]. International Journal of Hydrogen Energy, 2010, 35(8): 3817−3831.
[57] 詹锋, 鲍德佑, 秦光荣, 等. 应用金属氢化物的氢液化装置[J]. 低温与特气, 1993(1): 34−36. ZHAN Feng, BAO Deyou, QIN Guangrong, et al. Hydrogen liquefaction unit using metal hydride[J]. Low Temperature and Special Gas, 1993(1): 34−36
[58] 王新华, 李寿权, 陈立新, 等. 汽车氢化物空调器用Ti-Mn系多元贮氢合金及复合氢化物床空调器性能[J]. 稀有金属材料与工程, 2001, 30(5): 353−356. WANG Xinhua, LI Shouquan, CHEN Lixin, et al. Performance of Ti-Mn multicomponent hydrogen storage alloys and composite hydride bed air conditioners for automotive hydride air conditioners[J]. Rare Metal Materials and Engineering, 2001, 30 (5): 353-356.
[59] 覃峰, 陈江平, 倪久健, 等. 功能验证型尾气驱动金属氢化物车用制冷/空调系统的设计和性能[J]. 机械工程学报, 2006, 42(7):176-180. QIN Feng, CHEN Jiangping, NI Jiujiang, et al. Design and performance of automotive refrigeration/air conditioning system with metal hydride driven by exhaust gas[J]. Journal of Mechanical Engineering, 2006, 42(7): 176−180.
[60] 余敏贤, 林贵平. 金属氢化物冷源传热传质分析[J]. 宇航学报, 2002, 23(2): 11−14. YU Minxian, LIN Guiping. Heat and mass transfer analysis of metal hydride cold source[J]. Journal of Astronautics, 2002, 23(2): 11−14.
[61] 林贵平, 余敏贤. 金属氢化物热泵及其在载人航天生保系统中的应用[J]. 空间科学学报, 2002, 22(2): 177−183. LIN Guiping, YU Minxian. Metal hydride heat pump and its application in manned space life insurance system[J]. Journal of Space Science, 2002, 22(2): 177−183.
[62] 孙大文, 邓颂九, 李祖鑫. 金属氢化物热泵特性系数的计算模型[J]. 华南理工大学学报(自然科学版), 1988(1): 116−125. SUN Dawen, DENG Songjiu, LI Zuxin. Calculation model of characteristic coefficient of metal hydride heat pump[J]. Journal of South China University of Technology (Natural Science Edition), 1988(1): 116−125.
[63] 鲍泽威, 杨福胜, 吴震, 等. 金属氢化物反应器吸氢过程的热质传递特性分析[J]. 西安交通大学学报, 2012, 46(9): 49−54. BAO Zewei, YANG Fusheng, WU Zhen, et al. Analysis of heat and mass transfer characteristics of hydrogen absorption in metal hydride reactor[J]. Journal of Xi’an Jiaotong University, 2012, 46(9): 49−54.
[64] 阳明, 覃峰, 陈江平, 等. 新型金属氢化物板式反应床的传热特性[J]. 上海交通大学学报, 2009(9): 1456−1460. YANG Ming, QIN Feng, CHEN Jiangping, et al. Heat transfer characteristics of a new metal hydride plate reactor[J]. Journal of Shanghai Jiaotong University, 2009(9): 1456−1460.
[65] SHEN D, ZHAO C Y. Thermal analysis of exothermic process in a magnesium hydride reactor with porous metals[J]. Chemical Engineering Science, 2013, 98(29): 273−281.
Metal hydride thermal energy storage and its research progress
ZHOU Chengshang1, LIU Huang1, LIU Yong1, SHI Quan2, 3
(1. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China; 2. Thermochemistry Laboratory, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, China; 3. Liaoning Province Key Laboratory of Thermochemistry for Energy and Materials, Dalian 116023, China)
In the past decades, metal hydrides have attracted extensive attention as high-energy-density thermal storage materials. This paper introduces the thermochemical properties of metal hydrides and the working principle of the metal hydride-based thermal storage systems. Based on recent research progresses and developments, the working temperature, pressure and heat storage density of metal hydride as heat storage materials at high, medium and low temperature were analyzed and discussed. The application and development trend of refrigeration and heat pump for metal hydride thermal energy storage were also discussed.
thermal energy storage; metal hydrides; thermal storage materials; hydride bed; heat pump
TQ122.3
A
1673-0224(2019)05-391-09
国家自然科学基金资助项目(51704336);湖南省自然科学基金资助项目(2018JJ3653);中科院百人计划项目资助
2018−12−21;
2019−04−18
周承商,副教授,博士。电话:17788991683;E-mail: chengshang.zhou@csu.edu.cn
(编辑 汤金芝)
