胃癌骨转移患者临床病理与预后分析
2019-11-08严斐斐张纯慧张艳桥
徐 亭 严斐斐 张纯慧 张艳桥
骨是胃癌转移的少见部位,近年来临床研究报道的胃癌骨转移发生率为0.9~10%[1-3],尸检中的结果略高,但也仅为13.4%[4],其发生率远远低于腹膜、肝和肺转移,然而胃癌骨转移预后却极差。目前临床研究显示骨转移是胃癌的独立不良预后因素,骨转移后患者的中位生存时间仅4个月[5]。因此,明确胃癌骨转移的临床病理特征及预后因素对了解胃癌骨转移的高危人群、判断患者预后并及时选择合理的治疗方式有着重要的意义。本文将对157例胃癌骨转移患者的临床资料进行统计分析,以探讨胃癌骨转移患者的临床病理特征及预后因素,以期为胃癌骨转移的诊断、治疗及判断预后提供一定的参考。
1 资料和方法
1.1 一般资料
收集2007年4月—2013年12月哈尔滨医科大学附属肿瘤医院诊治的胃癌骨转移患者157例的临床资料,其中男性106例,女性51例,年龄21~82岁,中位年龄57岁。骨扫描联合CT或者MRI诊断骨转移78例,全身PET-CT 23例,CT 40例,MRI 16例。108例患者行姑息性化疗,其中35例同时联合骨转移放疗。11例行单纯骨放疗,38例行支持对症治疗。116例接受双膦酸盐类药物治疗,其中70例伊班膦酸钠,37例唑来膦酸,9例帕米膦酸二钠,41例未行双膦酸盐类药物治疗。根据国际抗癌联盟(UICC)第7版TNM分期法分期。
1.2 入组标准
(1)组织学证实为胃腺癌,排除重复癌及病理亚型如小细胞癌、神经内分泌癌、鳞状细胞癌及淋巴瘤患者;(2)最初诊断胃癌时(同时性骨转移)及治疗中新进展或随访期间(异时性骨转移)诊断的骨转移均需影像学检查(包括骨扫描、CT、MRI或者全身PET-CT)证实;(3)有完整的临床资料和随访结果。
1.3 随访
研究的主要终点是骨转移之后的总生存期(Overall survival after bone metastasis,OS-BM),定义为首次发现骨转移至任何原因死亡的时间或末次随访时间。同时,定义总生存期(Overall survival,OS)为诊断胃癌至任何原因死亡的时间或末次随访时间。随访至2015年12月,无失访患者。
1.4 统计分析
运用SPSS 18.0软件处理数据,用χ2检验及t检验比较胃癌骨转移患者各亚组之间的临床病理参数。生存资料用Kaplan-Meier法绘制生存曲线,用Log-rank检验行单因素分析,Cox比例风险模型行多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 胃癌骨转移的临床病理特征及骨转移特征
157例患者中,87例(49%)为胃癌术后骨转移,其中53例进行了根治切除。本组患者诊断骨转移的中位时间为280.5天,其中胃癌术后患者为389天,非胃癌术后者为106天。157例胃癌骨转移患者的临床病理特征及骨转移特征见表1和表2。
胃癌患者最常见的骨转移部位是脊柱、骨盆和肋骨。78.3%的胃癌骨转移患者伴有骨外脏器转移,最常见的部位依次是远处淋巴结、胸膜、肝脏和腹膜。
与此同时,根据骨转移特征,如骨转移诊断时间、骨转移数量及是否伴发骨外转移,将胃癌骨转移的患者进行分组,包括同时性骨转移组及异时性骨转移组、单发性骨转移组及多发性骨转移组、单纯骨转移组及伴骨外转移组,并分析比较各亚组之间诊断骨转移时的临床基线特征。经统计学分析发现,伴骨外转移组CEA显著高于单纯骨转移组(115vs. 30 ng/mL;t=-4.027,P<0.001)。与单发性骨转移的胃癌患者相比,低分化腺癌(χ2=9.905,P=0.002)、印戒细胞癌(χ2=10.865,P=0.001)及粘液腺癌(χ2=5.601,P=0.018)多见于多发性骨转移的胃癌患者。除此之外,各亚组之间其余临床基线特征并无统计学差异。
2.2 预后及影响因素分析
本研究中的患者中位OS为342天,中位OS-BM为109天,其中胃癌术后骨转移患者中位OS显著长于非胃癌术后患者(598vs. 166天;χ2=75.898,P<0.001),然而两组患者中位OS-BM无统计学差异(112vs. 108天;χ2=0.649,P=0.420)。单因素分析发现胃癌骨转移的OS-BM与CEA水平、LDH水平、血红蛋白浓度、白蛋白浓度、伴发骨外转移及治疗方式有关,而与性别、年龄、胃癌病理分化、浸润深度、淋巴结转移分期、骨转移的时间、数量及部位、CA199水平、ALP水平、Ca+浓度无关(表1)。多因素分析显示,CEA升高及伴有骨外转移是胃癌骨转移患者OS-BM的独立不良预后因素(P<0.05),而姑息性化疗与双膦酸盐治疗能有效降低患者死亡风险(P<0.05)(表3,图1~4)。
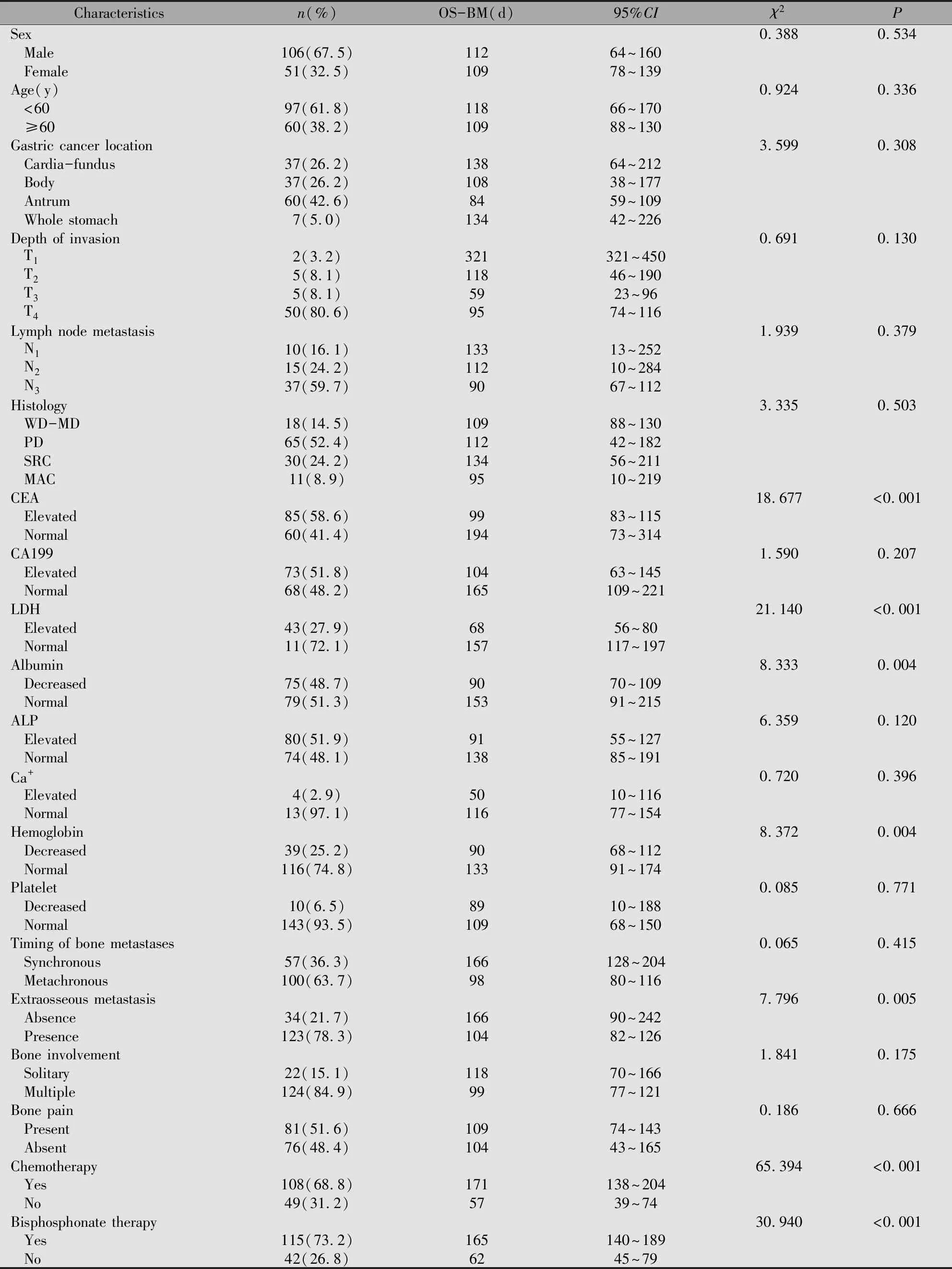
表1 157例胃癌骨转移患者临床病理特征
Note:WD-MD:well to moderately differentiated adenocarcinoma;PD:poorly differentiated adenocarcinoma;SRC:signet ring cell;MAC:mucinous adenocarcinoma.
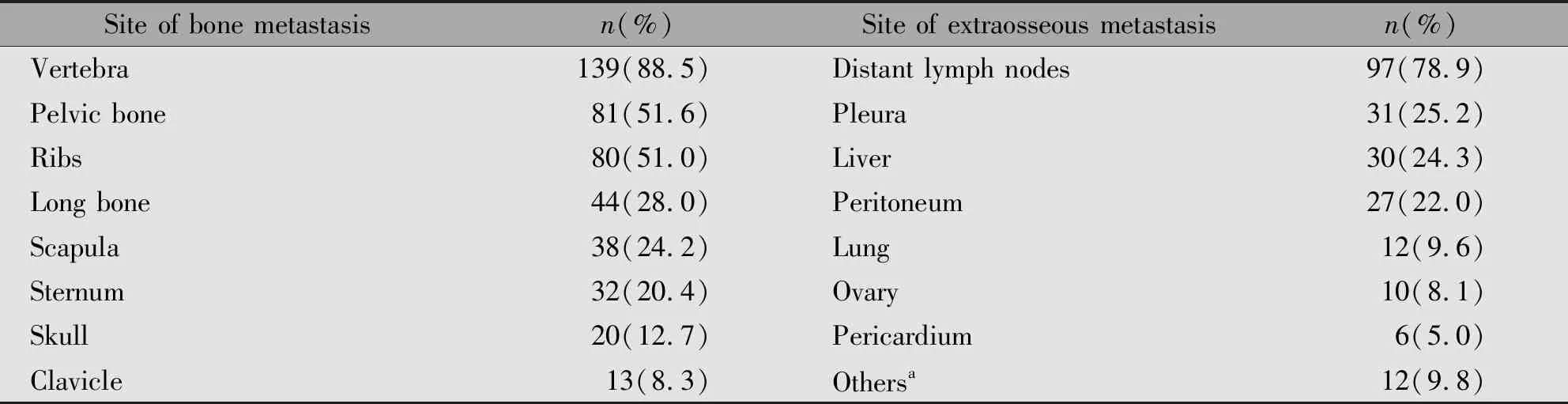
表2 胃癌骨转移部位及骨外转移脏器分布
Note:a include brain,skin,spleen and renicapsule.

表3 胃癌骨转移患者OS-BM预后因子的多因素Cox回归分析

图1 骨外转移对生存曲线影响Figure 1 The effect of extra-osseous metastasis on survival curves of patients
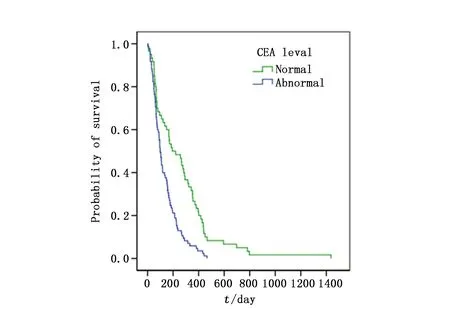
图2 CEA水平对生存曲线影响Figure 2 The effect of CEA on survival curves of patients
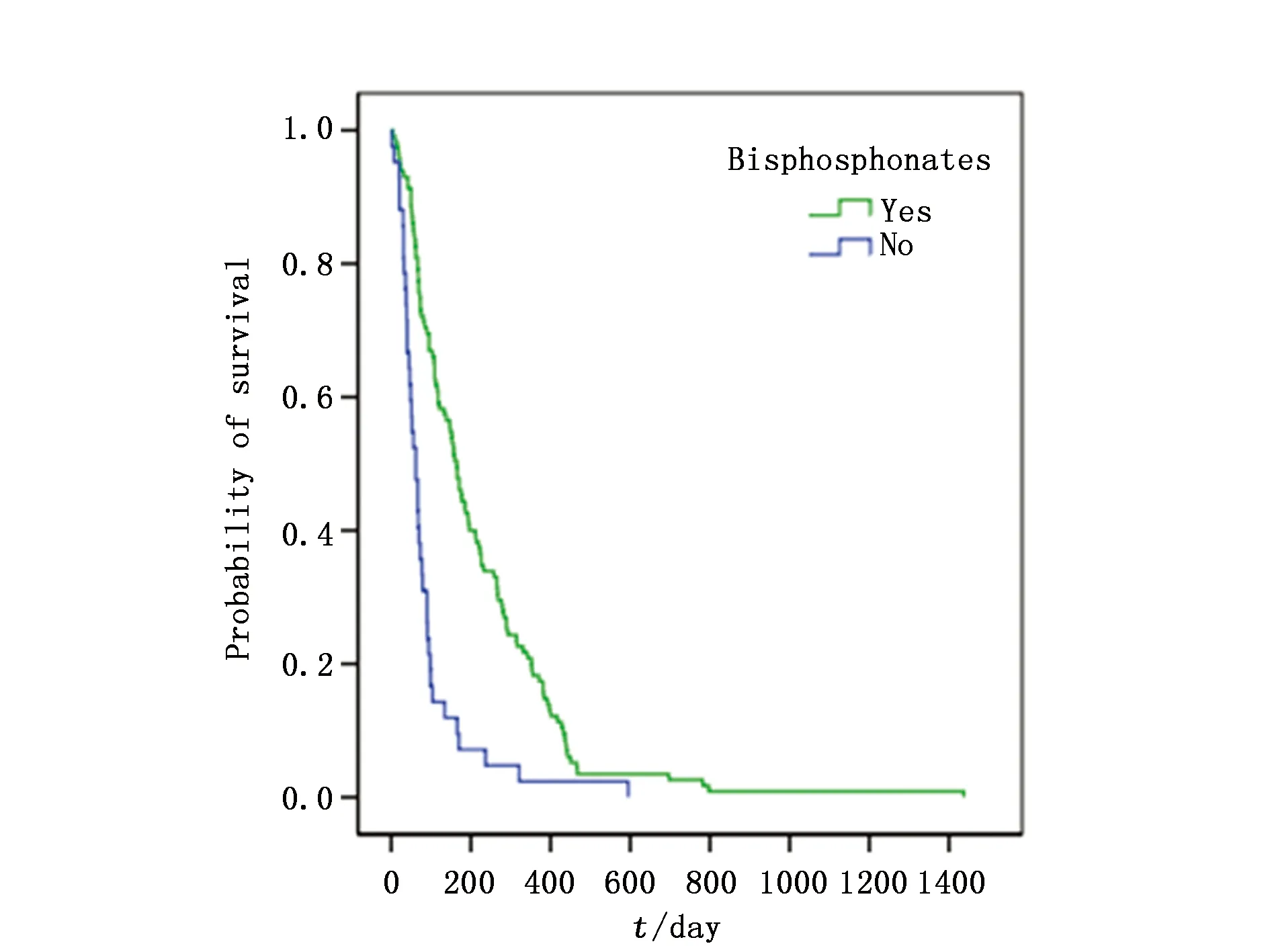
图3 双磷酸盐药物水平对生存曲线影响Figure 3 The effect of Bisphosphonates therapy on survival curves of patients
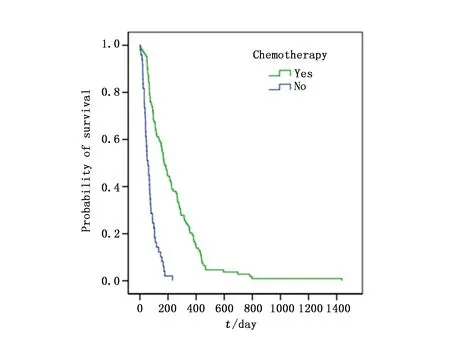
图4 化疗对生存曲线影响Figure 4 The effect of chemotherapy on survival curves of patients
3 讨论
胃癌骨转移的发病率低及预后差的特点提示我们胃癌骨转移可能有其特有的临床病理特征。本研究发现骨转移的胃癌患者病理多为低分化腺癌、印戒细胞癌及粘液腺癌,浸润深度多达T4,淋巴结转移分期多为N2及N3。既往研究发现病理分化越差,T分期及N分期越晚,发生骨转移的风险显著越高[2,6],因此,病理分化较差、局部浸润较深及转移淋巴结分期较晚的胃癌患者可能更易发生骨转移。确诊胃癌至发现骨转移的中位间隔时间为280.5天,与文献报道的8~16月相近[1-4,7-8]。多项临床研究报道骨转移多发生在胃癌术后1~2年内[2,9-10],与本研究统计的389天比较一致。因此,病理分化较差、局部浸润较深、转移淋巴结分期较晚的胃癌患者在随访中应警惕骨转移可能,尤其是胃癌术后1~2年内。
本研究发现最常见的骨外转移部位依次是远处淋巴结、胸膜、肝、腹膜,与既往临床研究相似[1-2],Ubukata等[11]认为淋巴系统可能是胃癌骨转移的主要途径,所以,本研究考虑胃癌骨转移常伴远处淋巴结转移可能与此有关。本研究认为伴有骨外转移是胃癌骨转移患者的独立不良预后因素,与Kim等[7]研究报道一致。因此,针对晚期胃癌伴远处转移尤其是远处淋巴结转移的患者应密切注意是否存在骨转移发生。
本研究多数患者为骨多发转移,最常见的骨转移部位为脊柱、骨盆和肋骨[1-2],与目前存在的临床研究结果相一致。然而,多发性骨转移是否与病理分化程度存在相关性尚无临床研究报道。本研究中多发性骨转移多见于低分化腺癌、印戒细胞癌及粘液腺癌的胃癌患者,而此类病理分化较差的胃癌患者更容易出现远处转移。由此我们推测病理分化较差的胃癌患者更容易发生多发骨转移。2013年韩国的一项临床研究发现86%胃癌早期骨转移患者为低分化腺癌,超过一半的患者有印戒细胞癌,提示病理分化较差的胃癌患者更容易发生早期骨转移[7]。Ekinci等[12]和Dittus等[13]认为病理分化较差的胃癌如印戒细胞癌、低分化腺癌及未分化癌更容易出现弥漫性骨髓转移,而Seto等[14]认为胃癌骨转移很可能起源于骨髓。这些研究从另一方面支持了我们的推测。
本研究中患者单发骨转移及多发骨转移OS-BM相似,同时性骨转移与异时性骨转移临床病理基线特征及OS-BM也无统计学差异。因此,无论诊断骨转移的间隔时间长短及发生骨转移数量多少,一旦发生骨转移,胃癌患者预后都极差。本研究中位OS-BM为109天,与其他研究报道的2~6个月相似[1-3,8,10]。我们发现CEA升高、LDH升高、贫血、低蛋白血症均是胃癌骨转移的不良预后因素,其中CEA升高是独立的不良预后因素,而CA199及ALP升高、高钙血症与正常值之内患者相比OS-BM均无统计学差异。尽管2014年意大利一项临床研究认为CEA升高、LDH升高是胃癌骨转移预后不良因素,但该研究同时认为CA199升高也是其不良预后因素[2]。同时Kim等[7]认为血小板减低、ALP升高、高钙血症与胃癌骨转移的不良预后相关。这种差异的存在可能与胃癌的异质性相关,需要进一步研究。
不少临床研究认为胃癌病理分化程度、浸润深度、淋巴结转移数目与胃癌骨转移的预后有关[2-3,7-8],但本研究中结果均无统计学意义,可能与本研究入组胃癌术后骨转移患者样本量较小有关,尚需进一步扩大样本量进行多中心临床研究以明确病理与胃癌骨转移预后之间的关系。
化、放疗是晚期胃癌治疗的重要手段之一,多项临床研究认为化疗能有效改善胃癌骨转移患者的预后[8,15],与本研究结果一致,同时我们发现化疗是胃癌骨转移的独立预后因素。Park等[1]根据胃癌骨转移的独立不良预后因素(ECOG评分3~4分,多发骨转移及升高的CEA)将患者进行风险分层,发现存在0~2个不良因素的患者可以从姑息化疗中获益,而具有3个或3个不良因素以上的胃癌骨转移患者接受化疗与单纯放疗或最佳支持治疗相比生存时间无统计学差异。因此尽管胃癌骨转移发生在病程较晚期,但对ECOG评分较好及预期生存时间较长的患者,仍建议给予积极的全身化疗。通过单纯放疗组与支持对症组OS-BM的对比,发现前者OS-BM略长于后者,但无统计学差异。尽管与先前研究报道一致[3],但这一结果可能由于患者样本量较少,存在一定偏倚。
双膦酸盐类药物能阻止破骨细胞介导的骨溶解,减少骨相关事件发生,已广泛用于实体瘤骨转移治疗[16]。Silvestris等[3]认为唑来膦酸不仅能延长胃癌患者的中位OS-BM,也能推迟首次骨相关事件发生。本研究也显示双膦酸盐类药物治疗是胃癌骨转移的独立预后因素,能显著延长OS-BM。
综上所述,胃癌骨转移作为晚期胃癌患者中的一部分特定人群,具有显著的临床病理特征,其总体预后不佳。伴发骨外转移及CEA升高作为其独立的不良预后因素,而化疗及双膦酸盐治疗可有效改善预后。正确评估患者的一般状态,选择适合患者的最佳治疗方案,对临床有重要的指导意义。
