放疗延迟对乳腺癌不同分子亚型患者预后的影响
2019-11-08师镘茹鄂明艳
师镘茹 鄂明艳
乳腺癌是女性最常见的癌症,全世界每年新发病例167万,其中52.9%发生在发展中国家[1],目前研究乳腺癌的发病机制已经深入到分子水平,以往的病理组织学分类已不能满足对疾病本质的认识。乳腺癌分子分型目前分别为腔上皮Luminal A型、Luminal B型、人表皮生长因子受体(HER-2)阳性型和基底样乳腺癌(Basal-like)型[2-3]。不同的分型预后各不相同,具有重要临床指导意义。Luminal A型最为常见[4],预后最佳。Luminal B型绝经后女性多见,预后稍差于Luminal A型。HER2+型更易出现腋窝淋巴结转移和远处转移,预后较差。Basal-like型侵袭性强,极易出现复发和转移[5],预后最差。分子分型决定了乳腺癌是高度异质性疾病。
放疗能够明显降低乳腺癌局部复发率及远处转移率,而放疗时机的选择是目前较为争议的问题,多数人主张改良根治术后的放射治疗应在半年内完成[15],延迟放疗是否对预后存在影响还需更多探索。本研究收集2007年—2012年在我院行乳腺癌改良根治术后行放化疗综合治疗患者的资料进行回顾性分析,探讨放疗延迟对乳腺癌不同分子亚型患者预后的影响。
1 材料与方法
1.1 临床资料
2007年1月—2012年12月在我院行乳腺癌改良根治术经术后病理证实及免疫组化资料完整的乳腺癌患者341例,均为女性患者;年龄23~69岁,中位年龄47岁;绝经前227例,绝经后114例;病理类型浸润性导管癌317例,浸润性小叶癌16例,其他8例;组织学分级Ⅰ级16例,Ⅱ级243例,Ⅲ级60例,不详22例。
1.2 入组标准
(1)所有患者均于我院外科行乳腺癌改良根治术,术后病理资料及雌激素受体、孕激素受体、Her2表达、Ki67表达等免疫组化结果完整;(2)凡具有锁骨上淋巴结、内乳淋巴结转移及远处转移患者均不可入组;(3)卡氏评分≥80分;(4)术前血常规、肝肾功能、心肺功能基本正常,无严重器质性病变,既往无其他肿瘤病史及可能影响治疗的疾病。
1.3 治疗方法
1.3.1 手术治疗 手术方案为乳腺癌改良根治术,即全乳切除加腋窝淋巴结清扫术。
1.3.2 化学治疗 所有患者均行化疗4~6个周期,其中紫杉醇或多西他赛联合环磷酰胺、多柔比星方案272例,多西他赛联合环磷酰胺37例,环磷酰胺联合表柔比星、氟尿嘧啶方案32例。
1.3.3 放射治疗 (1)CT模拟机定位:所有乳腺癌仿根治术后患者放疗均使用适形调强放射治疗,以6 MV-X直线加速器为放疗设备,患者仰卧于置有乳腺固定托架的专用CT模拟定位机上,照射靶区充分暴露,胸壁与床面平行,定位范围上界位于平甲状软骨下缘,下界位于乳腺皱褶下1.5~2.0 cm,CT扫描层厚5 mm;(2)靶区勾画及计划设计:照射范围包括胸壁、同侧锁骨上下区,加或不加腋窝淋巴结照射。同时勾画出肺、心脏、对侧乳腺、食管、脊髓等重要器官。照射剂量为DT46~50 Gy/4.5~5周/23~25次,1.9~2.0 Gy/次,5次/周。靶区内剂量分布要均匀,剂量变动应控制在±5%以内,尽可能减少对正常组织如心、肺和对侧乳腺的照射,避免在照射野邻接处发生重叠或遗漏,重复性好,通过剂量体积直方图(DVH)优化治疗计划。
1.3.4 内分泌治疗 对于雌激素受体(ER)或孕激素受体(PR)阳性的乳腺癌患者,不论其年龄、绝经状态、肿瘤大小或有无淋巴结转移,均应接受辅助性内分泌治疗。绝经前应用他莫西芬治疗的患者169例,绝经后接受芳香化酶抑制剂治疗的患者66例,应用他莫西芬治疗的患者19例。
1.3.5 靶向治疗 对于人表皮生长因子受体2(HER-2)阳性的患者,应使用曲妥珠单抗治疗,接受曲妥珠单抗治疗的患者为24例,具有靶向治疗指征未行靶向治疗患者为19例。
1.4 乳腺癌分子亚型判定标准
(1)Luminal A型:ER阳性和(或)PR阳性,HER-2阴性,Ki67低表达(<20%);(2)Luminal B型:分为两种,一种是Ki67为任何水平但HER-2阳性,另一种是Ki67指数高表达(≥20%)而HER-2阴性,两种类型ER和(或)PR为阳性;(3)HER-2阳性型:ER阴性、PR阴性、Her2阳性;(4)Basal-like型:即三阴型,ER阴性、PR阴性、HER2阴性;(5)ER+、PR+免疫组化判定标准:≥10%的细胞核染色阳性即激素受体阳性;(6)HER-2阳性免疫组化判定标准:IHC若为(+)或(-)定义为阴性;IHC若为(++),行FISH检测,若为(-)定义为阴性,若是(+)定义HER-2为阳性,IHC若为(+++)则定义为阳性。
1.5 分组标准
对照组:手术放疗时间间隔小于180天。放疗延迟组:手术放疗时间间隔大于180天[15]。
1.6 远期疗效评价标准
(1)局部复发:行手术、化疗、放疗等综合治疗结束后首次出现同侧胸壁、腋窝、锁骨上下区或内乳淋巴结复发;(2)远处转移:行手术、化疗、放疗等综合治疗结束后首次出现局部以外其他远处部位复发;(3)观察时间:从治疗开始直至肿瘤引起死亡或随访终止。
1.7 随访
术后3年内乳腺癌患者复发和转移的风险较高,因此每3~6个月随访一次,3~5年内每6~12个月随访一次,术后5年以上随访延长至一年一次,基本随访项目为询问病史、体格检查、B超(乳腺、腋窝、术侧胸壁、腹部脏器等);乳腺钼靶摄片一年一次,服用他莫西芬的患者行盆腔检查,芳香化酶抑制剂使用者行骨密度检测。骨扫描、CT及MRI应用于有症状的患者,不推荐常规应用。随访5~61个月,中位随访时间60个月。总生存期定义为从手术时间开始至任何原因引起死亡的时间(死亡之前失访者,死亡时间为最后一次随访时间)。
1.8 统计学方法
本研究所进行的统计分析均使用SPSS 21.0软件包。对于分类变量组间比较采用卡方检验和Fisher精确检验。应用Log-rank检验以及多因素Cox比例风险回归模型分析生存资料。本研究所有检验均为双侧检验,P<0.05为差异具有统计学意义。
2 结果
2.1 四种分子亚型乳腺癌患者对照组与放疗延迟组临床资料的比较
四种分子亚型乳腺癌患者对照组与放疗延迟组间年龄、月经状态、组织学分级、病理类型、肿瘤大小及淋巴结转移状况分布相似,无统计学差异(P>0.05)(表1)。
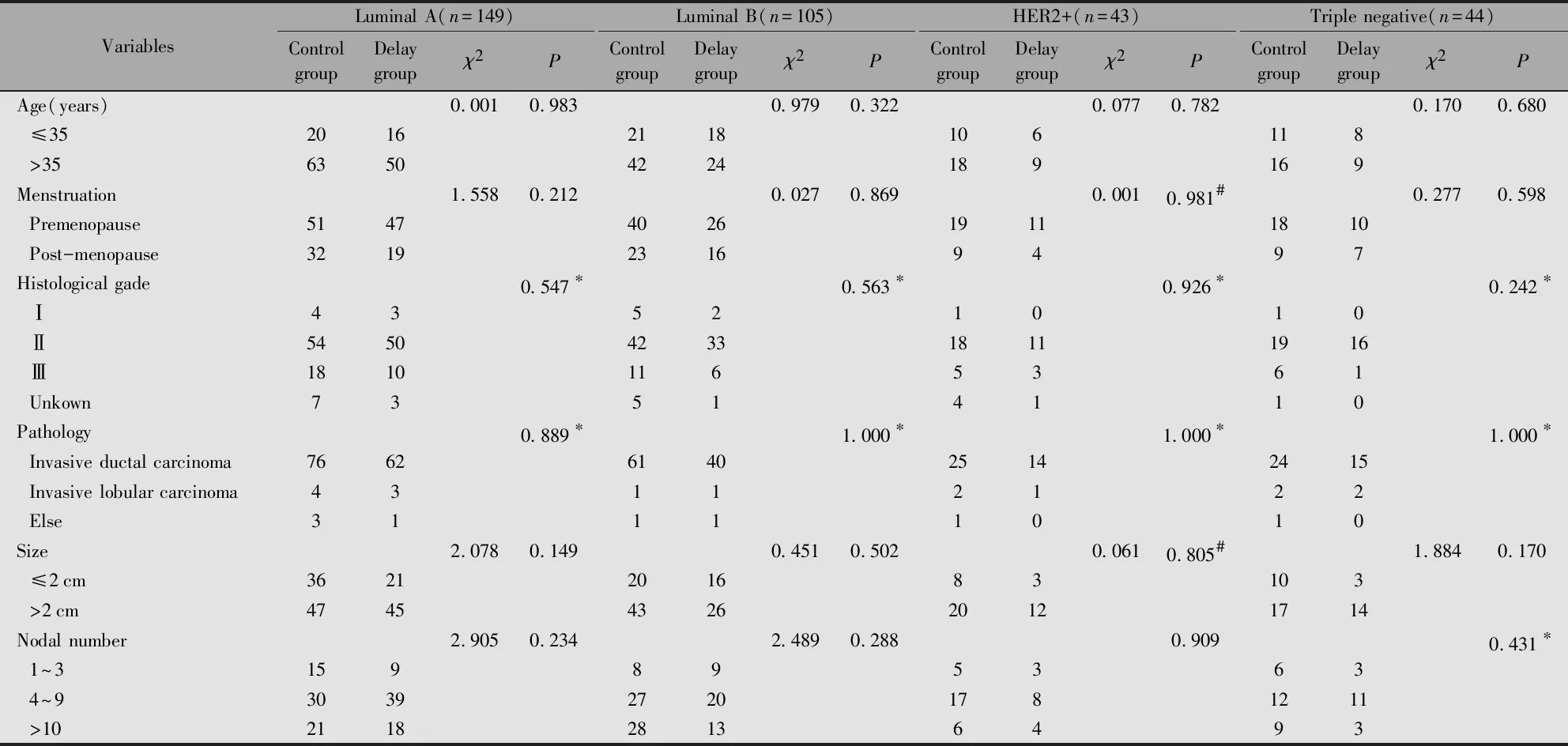
表1 乳腺癌患者的临床资料分布情况
Note:*Fisher exact test;#Continuity correction Chi-square test.
2.2 远期疗效
2.2.1 局部复发率及远处转移 Luminal B型及HER2+型患者的局部复发率均因放疗延迟而明显增高,差异具有统计学意义(P<0.05),Luminal A型及三阴型的局部复发率因放疗延迟而增高,虽不具有统计学意义,但风险明显增加。乳腺癌各分子亚型的远处转移率因放疗延迟而增高,但不具有统计学意义(P>0.05)(表2)。
2.2.2 无瘤生存率和总生存率(5年生存率)比较
Luminal B型及三阴型的无瘤生存率因放疗延迟而明显降低,具有统计学意义(P<0.05),Luminal A型及HER2+型的无瘤生存率因放疗延迟而降低,但不具有统计学意义,而乳腺癌各分子亚型的总生存率并未因放疗延迟而出现统计学差异(P>0.05)(表3)。
2.3 乳腺癌患者术后总生存期的影响因素分析
肿瘤大小、淋巴结转移、TNM和分子亚型是影响患者总生存期的独立危险因素(表4)。
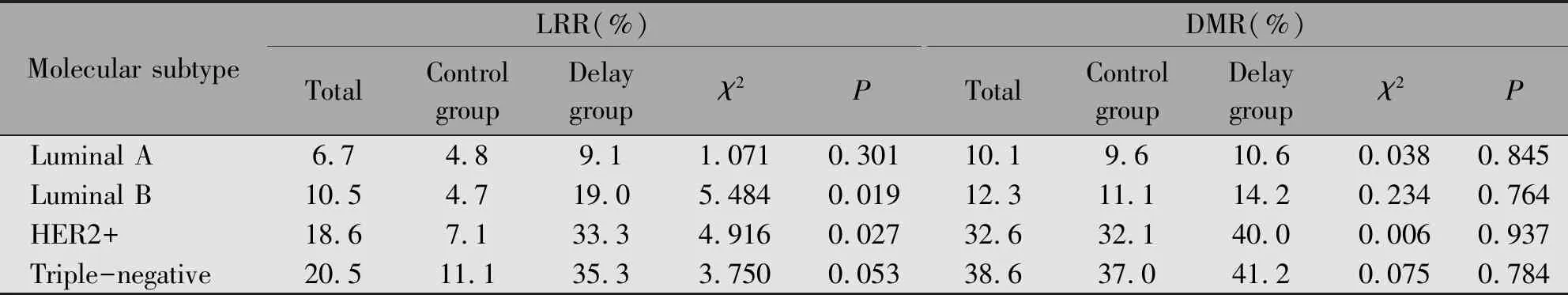
表2 乳腺癌局部复发率及远处转移率比较

表3 乳腺癌无瘤生存率及总生存率比较

表4 乳腺癌患者术后总生存期的影响因素分析
3 讨论
本研究结果显示4种乳腺癌分子亚型患者比例分别为43.7%、30.8%、12.6%、12.9%,Luminal型占主要比例,同国内外相关研究相似[8-9],HER2+型及三阴性型的局部复发率和远处转移率均高于Luminal型,无瘤生存率及总生存率也低于Luminal组,同既往研究相似[10-11],以上为本研究奠定了客观的基础。就放疗延迟角度来说,Luminal A型无论从局部复发率、远处转移率、无瘤生存率还是总生存率方面,均未因放疗延迟而出现明显不良的预后,可能因为其大多数为相对早期乳腺癌,肿瘤病灶较小,大多为T1、T2,而T4较少见,具有较低的复发风险,同时内分泌治疗相对敏感,疗效较好。而且2015年J Clin Oncol报道了加拿大Princess Margaret癌症中心Fyles等对Toronto-British Columbia(TBC)试验数据的亚组分析研究显示[12],在保乳治疗后随机分配到单纯他莫西芬组或他莫西芬联合放疗组,两组的10年总生存(OS)率均为84%,一些低风险Luminal A型乳腺癌患者从乳腺放疗中获益少于高危组,但本研究中,Luminal A型尽管在预后方面并未表现出统计学上的差异,但局部复发率、远处转移率均因放疗延迟而出现不同程度的升高,无瘤生存率和总生存率出现不同程度的降低,这也提示放疗的及时性在Luminal A型的乳腺癌患者中仍具有影响,尽早的完成放疗可能对部分患者更有利。Luminal B型和HER2+型乳腺癌患者的局部复发率因放疗延迟而明显增加,具有统计学意义,局部复发多以乳腺癌出现同侧锁骨上转移居多,其次为胸壁及腋窝淋巴结的复发,从肿瘤细胞增殖动力学考虑,肿瘤切除术后,残留的肿瘤细胞倍增时间缩短,增殖比例增大,对化疗药物和放射线的敏感性增加[9],不论是放疗或化疗在手术后都应尽早进行,超过一定的时间后,局部肿瘤细胞趋于稳定,耐受性增强,使得放疗未发挥最大作用,给局部留下了复发的隐患,同时Luminal B型及HER2+型均存在HER-2阳性的基因表型,HER-2作为EGFR家族成员之一,与配体结合后发生磷酸化,进而激活RAS通路,促进肿瘤细胞增殖,因此Luminal B型和HER2+型更需要治疗的积极性和及时性,本研究显示及时有效地放疗对其局部控制不容忽视,同时也是遏制治疗失败,提高治疗有效率的保证,此外也需考虑到HER2+型患者的高复发率可能与残留肿瘤细胞的增殖及浸润能力相关。而Luminal B型中存在一种高表达Ki-67的亚型,Ki-67是一种核蛋白质由MKI-67基因编码,又称之为MKI-67,在病理免疫组化中经常用到,提示细胞的增殖活跃程度,与肿瘤的分化程度、浸润、转移及预后密切相关,这也是导致其高复发风险的原因之一[13]。就远处转移率来说,乳腺癌各分子亚型患者的远处转移率因放疗延迟而增加,但并不具有统计学意义,因为化疗可以更好地控制远处的转移,Recht等[14]一项随机临床研究显示,先化疗组和先放疗组的局部复发率分别为14%和5%(P=0.07),远处转移率为20%和32%(P=0.05),由此可知放疗对局部的控制占优势,化疗对远处的转移更具作用,而且近年研究也证明了放疗的远隔效应,因此以上多方面的因素决定了放疗延迟对远处转移率的影响。而本研究中各乳腺癌亚型的总生存率均未受到放疗延迟的影响,乳腺癌患者的总生存及预后受到包括雌激素、孕激素、HER-2、组织分级、分期、治疗反应性、手术切缘等多方面的影响,并不能仅根据一种治疗手段来预测。因此本研究通过Cox回归分析得出,肿瘤大小、TNM、淋巴结转移和分子亚型是影响患者生存的独立危险因素。
放疗的最佳时间一直是一个有争议的问题。没有证据表明推迟放疗以行化疗会减少乳腺癌患者的生存率。本研究也未能得出对总生存率的影响,然而延迟放疗明显增加了Luminal B型及HER2+型的局部复发率,明显降低了Luminal B及三阴性型的无瘤生存率,从而降低了患者的生存质量。因此通过本研究我们知道,乳腺癌的放射治疗时机同样重要,我们主张术后半年内放疗[15],尤其针对LuminalB型、HER2+型及三阴性型,临床中应得到重视,本研究还存在一些不足,如手术放疗时间的分割点并没有进行详细的分层分析,只是根据现有文献的引导而将180天作为时间节点[15],因此在下一步将进行时间间隔的具体分层来寻求更加准确的时间以便指导预后。
