紫云英苷通过上调PHD2抑制缺氧诱导的卵巢癌细胞增殖和侵袭
2019-11-08宋玲付琼
宋 玲 付 琼
卵巢癌(Ovarian cancer,OC)是死亡率最高的妇科恶性肿瘤[1]。近年来,化疗耐药成为困扰妇科肿瘤医生的重要难题,因此,发掘新的抗肿瘤药物具有重要的临床意义。Warburg效应是导致肿瘤化疗耐药的重要因素之一,大多数肿瘤细胞即使在氧含量正常的条件下,也高表达缺氧诱导因子(Hypoxia inducible factor,HIF),促进糖酵解代谢以及一系列促增殖和侵袭的信号通路激活,其中HIF-1α是最重要的HIF活性亚基[2]。我们的前期研究发现了一种新型抗卵巢癌细胞单体药物紫云英苷(Astragaline,ATG),可通过下调HIF-1α蛋白表达抑制糖酵解途径进而发挥抑制卵巢癌细胞增殖和迁移的作用[3],但其作用机制尚未完全阐明。因此,本研究通过缺氧培养卵巢癌细胞,并采用ATG联合脯氨酸羟化酶-2(Prolyl-4-hydroxylase-2,PHD2)的抑制剂IOX2干预卵巢癌细胞,在体外细胞水平探讨ATG抑制HIF-1α蛋白表达的作用及其分子机制,初步探索ATG与卵巢癌化疗药物的联合作用,为抗卵巢癌新药发现提供新的思路。
1 材料与方法
1.1 细胞培养、处理及分组
人卵巢癌OVCAR-8和SK-OV-3细胞均培养于RPMI-1640完全培养基(含10% FBS、青霉素100 U/mL和链霉素100 μg/mL)中,置于培养条件为21%O2、5% CO2、37℃的恒温培养箱中培养,细胞缺氧处理置于1%O2、5% CO2、94%N2、37℃的三气恒温培养箱中培养。各组OVCAR-8和SK-OV-3细胞处理方式为:空白对照组细胞仅进行缺氧培养24 h,ATG组细胞加入紫云英苷(100 μM)后进行缺氧培养24 h,ATG+IOX2组细胞加入紫云英苷(100 μM)和IOX2(50 μM)后进行缺氧培养24 h。
1.2 细胞增殖活力检测
细胞增殖活力检测实验分为两部分。第一部分:OVCAR-8和SK-OV-3细胞分别分为三组,空白对照组、ATG组和ATG+IOX2组,检测各组细胞增殖活力;第二部分:分别以含梯度浓度的ATG联合梯度浓度的卡铂或顺铂的培养基于正常培养箱培养OVCAR-8和SK-OV-3细胞72 h后检测细胞增殖活力,并使用Combenefit v2.021软件进行联合效应分析(LOEWE分析)。细胞均接种于96孔板中培养,每组做5个复孔计算平均值,细胞增殖活力检测采用CCK-8试剂盒进行,具体步骤按照说明书所示,采用酶标仪在450 nm波长检测各孔的吸光度(A)值以空白对照组为100%计算:细胞活力(%)=(实验组平均A值-无细胞孔A值)/(空白对照组平均A值-无细胞孔A值)×100%。
1.3 细胞缺氧检测
根据试剂盒说明书,使用缺氧检测试剂盒(ENZ-51042-0125)测量缺氧细胞中的硝基还原酶活性。该试剂盒所使用的缺氧检测试剂(探针)是一种含有硝基部分的非荧光芳香化合物,可以通过缺氧细胞中存在的硝基还原酶转化为羟胺(NHOH)和氨基(NH2),随后释放可激发红色荧光的探针物质。分别检测空白对照组及ATG组OVCAR-8和SK-OV-3细胞缺氧状态,并以正常条件培养的未加药物处理的细胞为阴性对照组(Negative control group)。缺氧培养后用PBS洗涤细胞两次,并加入500 μL缺氧检测混合物(5 μL缺氧检测试剂溶于10 mL培养基中)孵育30 min。吸去缺氧检测混合物,用PBS洗涤细胞两次。使用标准激发/发射滤光器组(Ex/Em:596/630 nm)通过荧光显微镜(Olympus Corporation)拍片并使用Image Pro Plus软件进行相对荧光强度(RIF)分析。
1.4 Western blot
采用Western blot检测空白对照组、ATG组及ATG+IOX2组细胞HIF-1α、PHD2、PCNA、MMP-2和MMP-9蛋白表达情况。收集各组细胞,使用RIPA裂解液提取细胞总蛋白,并使用BCA法测定各组细胞蛋白样品浓度。以每孔30 μg总蛋白量通过10% SDS-PAGE凝胶电泳分离后电转印至PVDF膜;随后使用3%脱脂奶粉室温封闭1 h后一抗4℃孵育过夜;于3次TBST洗膜(5 min/次)后加入荧光二抗室温孵育1 h后洗膜,采用Odyssey双色红外激光成像仪收集荧光信号。以GAPDH为内参照,通过Quantity One-v4.6.2软件进行蛋白表达相对定量分析。
1.5 实时荧光定量PCR(qRT-PCR)
细胞处理与Western blot实验一致,收集空白对照组、ATG组及ATG+IOX2组细胞,采用RNAiso Plus提取细胞RNA,并使用微量分光光度计检测RNA浓度及纯度。根据逆转录试剂盒说明书,取1 μg总RNA去除使用gDNA Eraser去除基因组DNA后逆转录为cDNA。采用qRT-PCR试剂盒,以20 μL反应体系,采用两步法进行PCR反应(第一步:95℃ 30 s;第二步:95℃ 5 s+60℃ 34 s,40个循环;第三步:95℃ 15 s+60℃ 1 min+95℃ 15 s),以GAPDH作为内参。引物均由上海生工生物工程有限公司合成,检测指标及引物序列见表1。结果分析采用2-ΔΔCt法计算各基因mRNA相对表达量。

表1 引物序列表
1.6 细胞侵袭实验
OVCAR-8和SK-OV-3细胞分为空白对照组、ATG组及ATG+IOX2组三组。细胞接种于Transwell小室,上室中分别加入无血清培养基及其配置的含ATG(100 μM)、含ATG(100 μM)和IOX2(50 μM)的培养基,下室内加入用完全培养基及其配置的含ATG(100 μM)、含ATG(100 μM)和IOX2(50 μM)的培养基。缺氧条件培养24 h后,吸净下室液体,用甲醇原液固定20 min,结晶紫染色,光学显微镜(200×)拍照,并随机选取5个视野进行细胞计数,算出每个视野的平均值以对细胞侵袭能力进行相对定量分析。
1.7 统计学分析
应用SPSS 21.0进行统计学处理,计量资料以均数±标准差表示,两组间比较采用t检验,多组间比较采用方差分析,多重比较采用Tukey法,P<0.05为差异有统计学意义。
2 结果
2.1 紫云英苷对缺氧诱导的HIF-1α及其下游细胞增殖和侵袭相关因子表达的影响
采用Western blot和qRT-PCR检测缺氧条件下ATG对卵巢癌细胞HIF-1α及其下游细胞增殖和侵袭相关蛋白表达情况。结果显示,缺氧条件下,与空白对照组相比,ATG组OVCAR-8和SK-OV-3细胞HIF-1α蛋白表达明显降低(P<0.001)(图1A-B),且促增殖相关因子PCNA以及促侵袭相关因子MMP-2和MMP-9蛋白水平均明显降低(图1A,C-E),差异均有统计学意义(P<0.001);此外,缺氧条件下,与空白对照组相比,ATG组OVCAR-8和SK-OV-3细胞HIF-1α的mRNA水平均无明显变化(P>0.05),但促增殖相关因子PCNA以及促侵袭相关因子MMP-2和MMP-9的mRNA表达均明显降低(图1F-I),差异均有统计学意义(P<0.001)。以上结果表明,ATG可明显抑制缺氧诱导的卵巢癌细胞HIF-1α及其下游细胞增殖和侵袭相关蛋白表达,其作用可能与HIF-1α蛋白转录后调节相关,而与转录水平调节无关。
2.2 紫云英苷抑制缺氧诱导的HIF-1α蛋白表达的机制
为阐明ATG降低卵巢癌细胞HIF-1α蛋白水平的机制,本研究检测了ATG对卵巢癌细胞缺氧状态的影响,阴性对照组红色荧光较弱,而在缺氧培养条件下,空白对照组OVACR-8和SK-OV-3细胞红色荧光较强,明显呈现缺氧状态。与空白对照组相比,ATG组细胞仍处于缺氧状态,相对荧光强度均无明显变化(P>0.05)(图2A-B)。因此本研究进一步检测了ATG对PHD2蛋白及mRNA表达水平的影响,在缺氧培养状态下,与空白对照组相比,ATG组OVCAR-8和SK-OV-3细胞PHD2蛋白及mRNA表达均明显升高,差异均有统计学意义(P<0.001)(图2C-E)。表明ATG可能通过上调PHD2表达促进HIF-1α降解。

图1 紫云英苷对卵巢细胞HIF-1α及其下游细胞增殖和侵袭相关调节因子表达的影响Figure 1 Effects of astragaline on the expression of HIF-1α and its downstream factors related to proliferation and invasion in ovarian cancer cellsNotes:A-E.The expression of HIF-1α,PCNA,MMP-2 and MMP-9 protein in OVCAR-8 and SK-OV-3 cells;F-I.The expression of HIF-1α,PCNA,MMP-2 and MMP-9 mRNA in OVCAR-8 and SK-OV-3 cells.HPA:Hypoxia;ATG:Astragaline;No-treatment control(control group):HPA+ATG-;ATG group:HPA+ATG+.NS P>0.05,***P<0.001,when compared with the control group.
2.3 PHD2抑制剂明显减弱紫云英苷对卵巢癌细胞增殖及侵袭的抑制作用
为进一步证实ATG通过上调PHD2促进HIF-1α降解,本研究检测了PHD2特异性抑制剂IOX2预处理对ATG抗卵巢癌细胞增殖和侵袭作用的影响,缺氧培养条件下,与ATG组相比,ATG+IOX2组OVCAR-8和SK-OV-3细胞HIF-1α、促增殖因子PCNA及促侵袭因子MMP-2和MMP-9的蛋白表达均明显升高(P<0.001)(图3A-E);qRT-PCR结果显示,与ATG组相比,ATG+IOX2组OVCAR-8和SK-OV-3细胞HIF-1α的mRNA表达均无明显变化(P>0.05)(图3F),但PCNA、MMP-2和MMP-9的mRNA表达均明显升高(P<0.001)(图3G-I)。此外,在缺氧培养条件下,与空白对照组相比,ATG组OVCAR-8和SK-OV-3细胞增殖及侵袭均能力明显降低(P<0.001);而与ATG组相比ATG+IOX2组OVCAR-8和SK-OV-3细胞增殖及侵袭均能力均明显升高(P<0.001)(图4)。
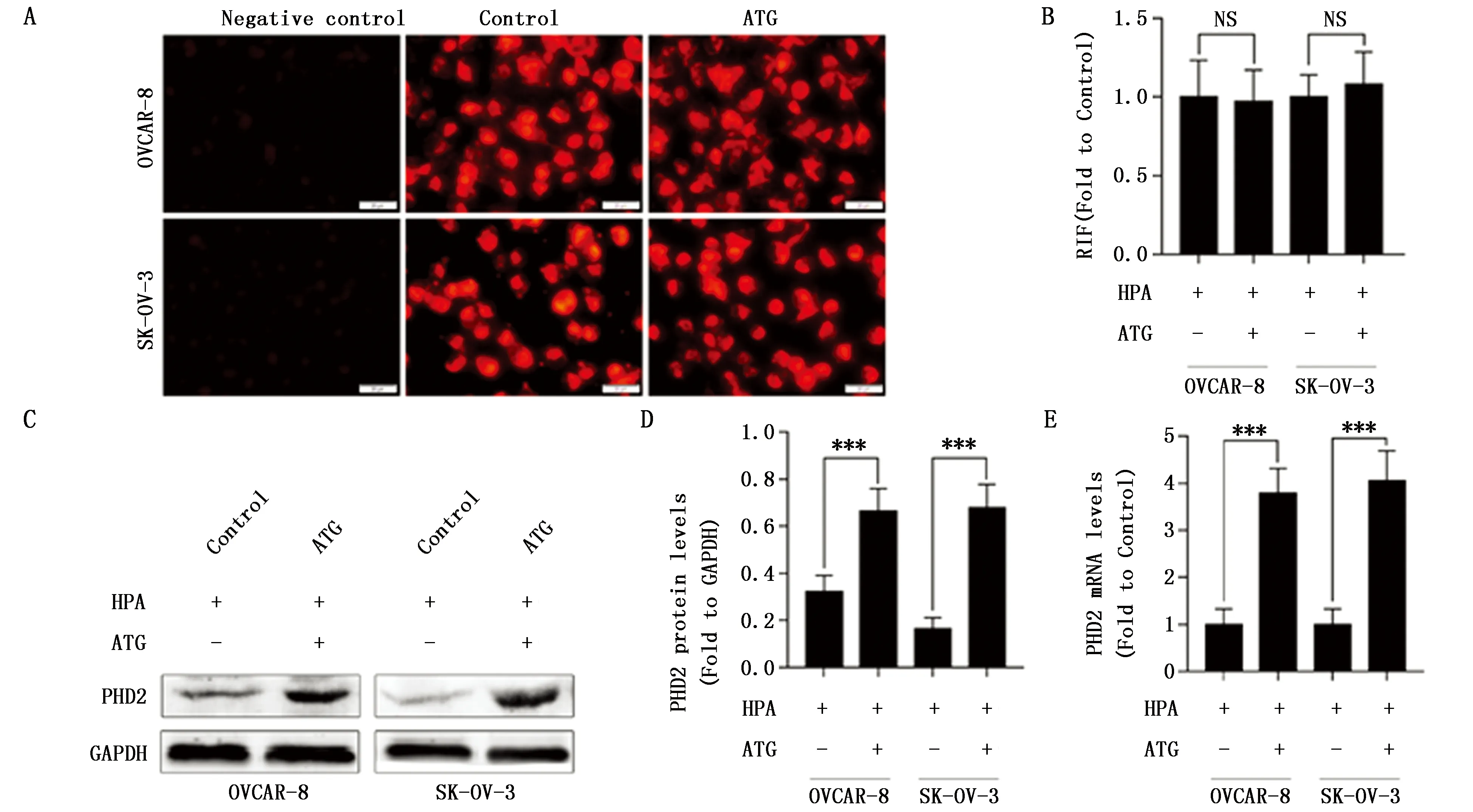
图2 紫云英苷对卵巢癌细胞缺氧状态及PHD2表达的影响Figure 2 Effects of Astragaline on hypoxic status and expression levels of PHD2 in ovarian cancer cellsNote:A-B.Effect of ATG on hypoxic status of OVCAR-8 and SK-OV-3 cells;C-E.Effect of ATG on the expression of PHD2 at levels of protein and mRNA in OVCAR-8 and SK-OV-3 cells.HPA:Hypoxia.ATG:Astragaline.Negative control group:cells cultured in normal oxygen conditions;No-treatment control(control group):HPA+ATG-;ATG group:HPA+ATG+.NS P>0.05,***P<0.001,when compared with the control group.

图4 PHD2抑制剂明显减弱紫云英苷对缺氧诱导的卵巢癌细胞增殖和侵袭的抑制作用Figure 4 Effect of PHD2 inhibitor on the suppressive role of Astragaline in proliferation and invasion of ovarian cancer cellsNote:A-B.Effect of IOX2 on proliferation of OVACR-8 and SK-OV-3 cells treated with ATG;C-D.Effect of IOX2 on invasion of OVACR-8 and SK-OV-3 cells treated with ATG.IOX2:PHD2 inhibitor.HPA:Hypoxia.ATG:Astragaline.No-treatment control(control group):HPA+ATG-IOX2-;ATG group:HPA+ATG+IOX2-;ATG+IOX2 group:HPA+ATG+IOX2+.***P<0.001,when compared with the ATG group.
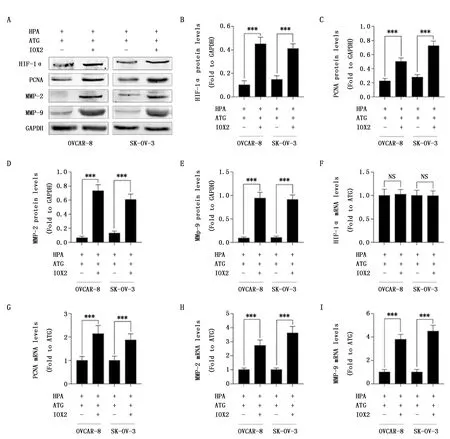
图3 PHD2抑制剂明显减弱紫云英苷对缺氧诱导的卵巢癌细胞HIF-1α及其下游细胞增殖和侵袭相关因子表达的抑制作用Figure 3 PHD2 inhibitor reduced the inhibitory effect of Astragaline on the expression suppression levels of HIF-1α and downstream proliferation-and invasion-related factors in ovarian cancer cellsNote:A-E.IOX2 reduced the inhibitory effect of astragaline on the expression of HIF-1α and its downstream factors related to proliferation and invasion in OVACR-8 and SK-OV-3 cells.F-I.IOX2 reduced the inhibitory effect of astragaline on the mRNA expression suppression levels of HIF-1α and downstream factors related to proliferation and invasion in OVACR-8 and SK-OV-3 cells.IOX2:PHD2 inhibitor.HPA:Hypoxia.ATG:Astragaline.ATG group:HPA+ATG+IOX2-;ATG+IOX2 group:HPA+ATG+IOX2+.NS P>0.05,***P<0.001,when compared with the ATG group.
2.4 紫云英苷增加卵巢癌细胞对卡铂和顺铂的敏感性
HIF-1α及下游促增殖和侵袭相关信号通路上调是化疗耐药的重要机制之一,为进一步证实ATG的抗卵巢癌作用,本研究检测了ATG与卡铂和顺铂抗卵巢癌的联合效应,LOEWE分析结果显示为蓝色表示两种药物具有较好的联合作用,显示为红色则表示两种药物具有拮抗作用。本研究结果表明,在一定浓度范围内,ATG与卡铂以及ATG与顺铂均在OVCAR-8和SK-OV-3细胞中显示出较好的联合作用。表明ATG增加卵巢癌细胞对卡铂和顺铂的敏感性(图5)。
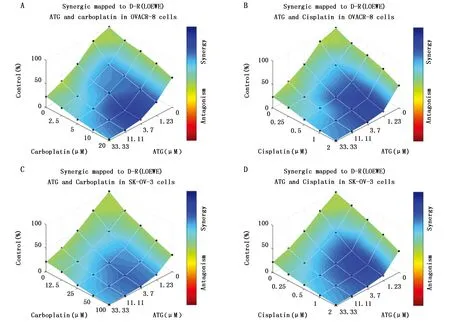
图5 紫云英苷促进卵巢癌细胞对化疗药物的敏感性Figure 5 Astragaline sensitized ovarian cancer cells to chemotherapeutic agentsNote:A.Synergic analysis of ATG and carboplatin in OVACR-8 cells;B.Synergic analysis of ATG and cisplatin in OVACR-8 cells;C.Synergic analysis of ATG and carboplatin in SK-OV-3 cells;D.Synergic analysis of ATG and cisplatin in SK-OV-3 cells.Cells were treated with increasing concentration of ATG and carboplatin or cisplatin in normoxic condition for 72 h,then cell proliferative capacity was measured by CCK-8 kit.Synergic analysis was performed with Combenefit v2.021 software using LOEWE analysis.
3 讨论
前期研究证实[3],ATG可通过抑制HIF-1α及其诱导的糖酵解途径抑制卵巢癌细胞的增殖和迁移,并促进其凋亡,表明ATG是一种潜在的针对Warburg效应的有效抗卵巢癌药物。为进一步阐明ATG抗卵巢癌作用的机制,本研究在缺氧培养条件下给予OVCAR-8和SK-OV-3细胞ATG处理,并结合PHD2抑制剂干预,证实ATG可能通过上调PHD2表达,促进缺氧诱导的HIF-1α降解,进而抑制卵巢癌细胞增殖和侵袭。
缺氧诱导的HIF-1α信号通路上调是肿瘤耐药的重要因素,HIF-1α上调可通过促进一系列促肿瘤细胞生存、增殖、侵袭、免疫逃逸等恶性行为的信号通路,进而增强肿瘤细胞对放、化疗治疗的耐受性[4]。因此,以HIF-1α为靶点的小分子化合物是具有较好前景的新型抗肿瘤药物,近年来针对缺氧和HIF-1α的特异性药物也成为肿瘤新药发掘的热点[5]。目前尚没有针对HIF-1α有效的临床抗肿瘤药物,大多都尚处于临床前的细胞或动物研究阶段。我们的前期研究表明[3],一种广泛存在于食品成分中的天然黄酮类物质—紫云英苷,在2D和3D细胞培养水平均显示出较好的抗卵巢癌作用,且均呈现较好的时间和剂量依赖效应关系。此外,紫云英苷可明显抑制OVCAR-8细胞迁移能力,激活线粒体凋亡途径、增加细胞凋亡水平,且在2D及3D培养条件下均可抑制Glut1、Glut3、HK2、PDK1和PDK3等糖酵解途径效果蛋白表达。表明紫云英苷在正常氧含量及缺氧环境下对卵巢癌OVCAR-8细胞增殖具有抑制作用,且其机制可能是通过抑制HIF-1α诱导的糖酵解通路以及激活线粒体凋亡通路。为进一步阐明紫云英苷抑制HIF-1α的作用机制,本研究通过缺氧培养激活卵巢癌细胞HIF-1α及下游促增殖和侵袭相关信号通路,并给予紫云英苷处理,结果显示,紫云英苷可明显抑制缺氧诱导的HIF-1α蛋白表达,进而抑制促增殖相关因子PCNA及促侵袭相关因子MMP-2和MMP-9表达,但HIF-1α的mRNA表达无明显变化。由此可知,紫云英苷对HIF-1α的抑制作用并非抑制其转录水平,而是转录后的抑制。
HIF-1α与HIF-1β共同组合形成具有调节活性的HIF-1异源二聚体转位进入细胞核,与含有缺氧应答原件(Hypoxia responsive elements,HREs)的启动子结合,促进相应基因的转录,进而激活一系列信号通路[4]。其中,HIF-1β亚基又称芳香烃受体核转运子,在细胞内稳定表达,起结构性作用;而HIF-1α受缺氧信号的调控,是HIF-1的活性亚基[6]。正常氧含量条件下,合成的HIF-1α蛋白很快即被细胞内的泛素蛋白酶—脯氨酸羟化酶(prolyl-4-hydroxylases,PHDs)所降解,其中,PHD2是主要的亚型之一。为进一步揭示紫云英苷对HIF-1α转录后抑制的分子机制,本研究检测了紫云英苷处理后PHD2的表达变化,结果显示,缺氧培养条件下,无处理对照组细胞PHD2的表达水平较低,而给予紫云英苷处理后,PHD2的蛋白及mRNA表达水平均明显升高,提示紫云英苷可能通过上调PHD2表达进而实现对HIF-1α的转录后抑制。为进一步证实这一猜想,本研究在给予卵巢癌细胞紫云英苷处理的同时增加PHD2特异性抑制剂IOX2干预,结果显示,IOX2处理可明显减弱紫云英苷对卵巢癌细胞增殖及侵袭的抑制作用,并使紫云英苷处理后促增殖相关因子PCNA及促侵袭相关因子MMP-2和MMP-9表达升高。同时,HIF-1α蛋白水平也较单纯紫云英苷处理组细胞明显升高,而mRNA水平则无明显差异,表明紫云英苷是通过上调PHD2表达,促进HIF-1α的降解,进而抑制卵巢癌细胞的增殖和侵袭。在肺癌的研究中,表明紫云英苷可抑制肺癌和肝癌细胞ERK、Akt及NF-κB等信号通路及糖酵解相关因子[7-8],这些作用可能均通过上调PHD2表达促进HIF-1α的降解进而抑制Warburg效应实现。此外,HIF-1α通路被证实是肿瘤化疗耐药的重要因素,以HIF-1α为靶点的药物均可增加卵巢癌细胞对化疗药物的敏感性[9-11],因此本研究还进一步检测了紫云英苷与卵巢癌常用化疗药物的联合效应,结果显示,紫云英苷可明显增加卵巢癌细胞对卡铂和顺铂的敏感性,显示出较好的联合效应。
综上所述,本研究结果证实紫云英苷可通过上调PHD2表达促进HIF-1α的降解,抑制Warburg效应,实现对卵巢癌细胞糖酵解途径、增殖及侵袭的抑制作用,是一种潜在的抗卵巢癌化疗耐药的新型小分子天然化合物,为卵巢癌药物治疗提供了新的思路和参考。
