外周血USP1基因甲基化与大肠癌预后风险的关系
2019-11-08张谊微刘宇鹏曹丽明胡付兰赵亚双
张谊微 石 晶 刘宇鹏 曹丽明 胡付兰 赵亚双
大肠癌(Colorectal cancer,CRC)是最常见的消化道恶性肿瘤之一。2018年全球癌症统计数据显示,大肠癌新发病例超过180万,因大肠癌死亡的病例约88万。全球范围内大肠癌发病率居第三位,死亡率居第二位[1]。中国大肠癌发病率和死亡率均呈上升趋势[2],严重威胁居民健康。大肠癌可由于基因突变、表观遗传修饰的改变和环境暴露的积累而发生。在大肠癌发生发展过程中,通常可以检测到基因启动子区高甲基化,并诱导基因沉默。DNA甲基化可以作为大肠癌诊断、治疗和预后的标志物。
去泛素化特异性调节酶1(Ubiquitin specific peptidase 1,USP1)是具有重要DNA修复功能的基因,在人类恶性肿瘤的发生发展中起到重要作用[3]。多数肿瘤中均可以检测到USP1水平升高,如宫颈癌、乳腺癌、胃癌、黑色素瘤和肉瘤等[4]。同时发现USP1还可以促进乳腺癌转移[5]。然而,关于USP1在肿瘤中异常表达的潜在分子学机制尚不清楚,USP1甲基化与肿瘤预后之间的关系也仍然未知。DNA甲基化改变不仅可以在肿瘤组织中检测到,也可以在外周血中检测到[6]。对外周血中DNA甲基化改变的研究有助于了解肿瘤发生发展过程,为肿瘤靶向治疗提供理论依据。因此,我们进行了队列研究,以研究外周血USP1甲基化及临床病理特征与大肠癌预后之间的关联。
1 材料和方法
1.1 研究对象
该研究采用队列研究。将哈尔滨医科大学第三附属医院确诊的大肠癌患者(2004年11月—2007年12月)纳入为研究对象,纳入病例均为术后临床病理诊断的原发性新发大肠癌患者。
1.2 资料收集
1.2.1 样本采集 获取患者的知情同意后,对每位研究对象抽取约5 mL外周静脉血,EDTA抗凝,离心处理后,分装至200 μL/500 μL离心管中,于-80℃冻存。
1.2.2 数据采集 (1)收集内容:人口统计学特征,包括年龄、性别、籍贯、婚姻状况、职业、文化程度等;患者术后病理资料,包括肿瘤大小、转移情况、肿瘤UICC分期、分化程度、组织学分型、术前CEA和CA19-9水平等以及术后放化疗的情况;(2)病例随访:以诊断日期为随访开始时间,每年进行一次电话随访,并排除术前放化疗、术后30天内死亡病例,随访终点为2014年3月15日。随访内容主要包括大肠癌患者生存情况(是否存活、死亡时间及原因等),术后转移及复发情况和术后放化疗情况等。
1.3 DNA提取和重亚硫酸氢盐修饰
使用QIAamp DNA Blood Mini Kit(Qiagen,德国)从血液样品中提取外周血DNA。使用Qiagen EpiTect Bisulfite Kit(Qiagen,德国)用于DNA的亚硫酸氢盐转化。使用Nanodrop 2000微量核酸测定仪(Thermo,美国)检测DNA质量和浓度。所有步骤均根据产品说明书进行操作。
1.4 USP1甲基化分析
使用LightCycler®480 High Resolution Melting Master mix试剂盒(Roche,瑞士),通过甲基化敏感高分辨率熔解曲线分析法(MS-HRM)检测和分析USP1的甲基化水平。
引物设计使用Primer Premier 5.0:正向引物,5′-GCGAGACGGTTTTTTTTTTT-3′;反向引物,5′-GTCGCACACACAACCCAAATA-3′。PCR扩增片段位于1号染色体(62901593-62901710,118 bp)。PCR扩增反应体系(5 μL):Mix试剂2.5 μL,MgCl2溶液(25 mM)0.6 μL,去离子水1.2 μL,正向和反向引物(10 μM)各0.1 μL,重亚硫酸氢盐转化的DNA 0.5 μL。HRM检测条件:PCR反应进行60个循环,梯度退火55~53℃12秒,熔解温度65~95℃。
使用重亚硫酸氢盐转化后的完全未甲基化(无甲基化)和完全甲基化(100%甲基化)DNA构建一系列甲基化标准品系列,包括0、0.5%、1%、2%和100%。使用无模板双蒸水作为空白对照。
1.5 统计学分析
所有统计分析均使用SPSS 19.0统计学软件,应用Cox比例风险模型分析基因甲基化与大肠癌预后的关系,缺失超过10%且低于20%的变量采用多重插补法填补,P<0.05为差异具有统计学意义。
2 结果
2.1 一般情况
共随访286名大肠癌患者。随访结束时40.6%(116/286)的患者死亡,47.6%的患者(136/286)存活和11.8%(34/286)的患者失访。随访患者的平均年龄为59.1±11.6岁,小于60岁年龄组人数占51.1%(146/286),超过60岁年龄组人数占48.9%(140/286),男女比例约为1.5∶1(173/113)(表1)。
2.2 临床病理特征与大肠癌预后的关系
临床特征与大肠癌预后风险的单因素Cox分析结果显示,UICC肿瘤4期(HR=2.429,95%CI:1.237~4.773,P=0.010)、肿瘤大小超过50 mm(HR=1.550,95%CI:1.039~2.311,P=0.032)和组织学非腺型(HR=3.522,95%CI:1.113~11.147,P=0.032)与大肠癌预后有关(表1)。
将单因素分析中有统计学意义,以及曾有研究显示对大肠癌预后有影响的变量纳入多因素Cox回归分析中。纳入变量包括UICC分期、病理分型、分化程度、肿瘤大小、组织学分型、术前CEA水平、术前CA19-9水平和术后放疗情况。结果如表2所示,与单因素分析结果相一致,UICC肿瘤分期、肿瘤大小超过50 mm和组织学非腺型与大肠癌患者的预后不良风险增加之间有关,而其它病理特征与大肠癌预后不良风险之间无关。
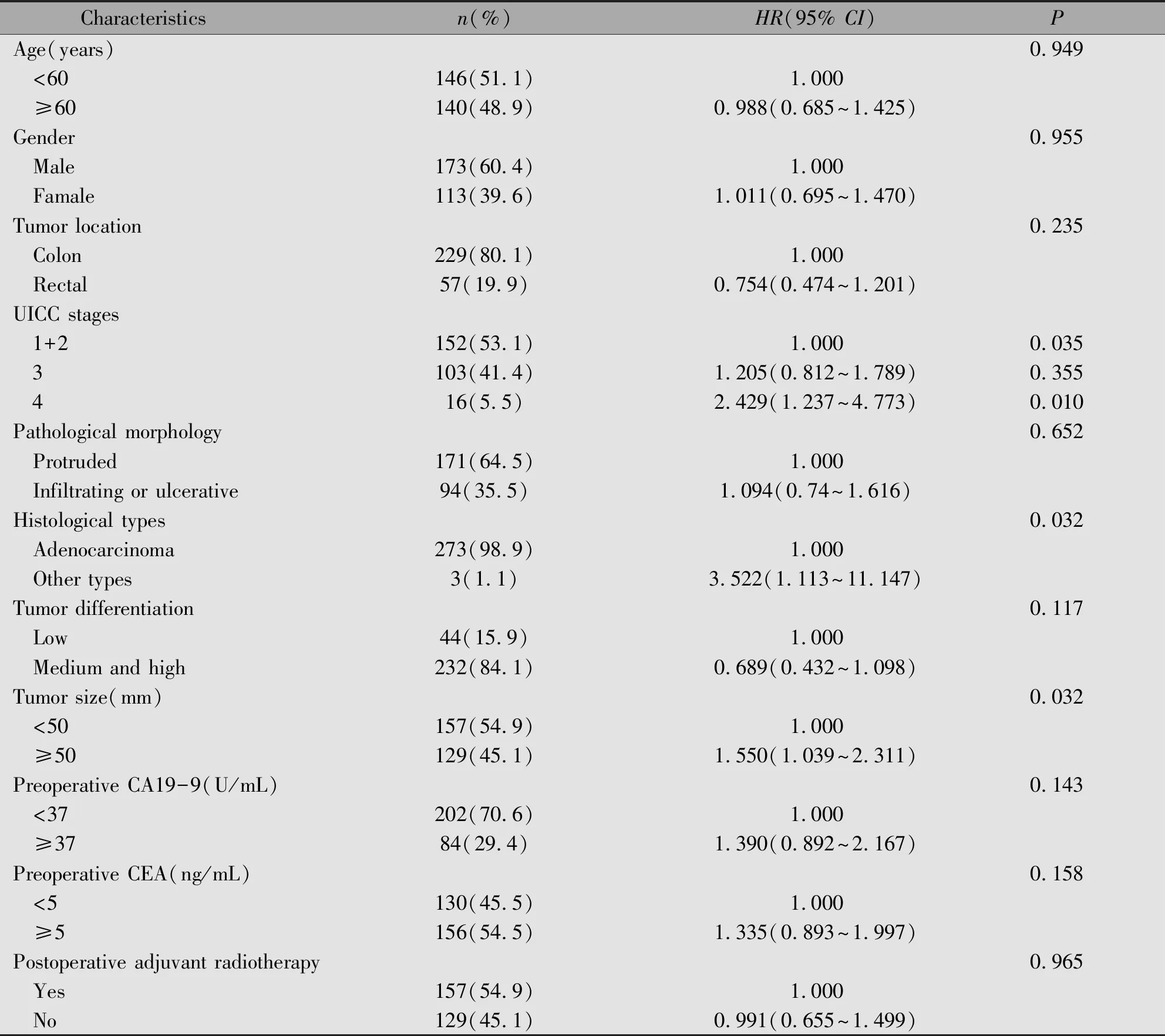
表1 大肠癌患者临床病理特征与生存预后的单因素分析

表2 大肠癌患者临床特征和生存预后的多因素分析结果
2.3 USP1甲基化和大肠癌预后风险的关系
检测发现USP1甲基化的病例为92例,甲基化水平均低于0.5%。调整年龄、性别、UICC分期、组织学分型和肿瘤大小后,USP1基因甲基化和大肠癌患者的预后无统计学意义(HRa=1.229,95%CI:0.792~1.906,P=0.358)(表3)。
2.4 USP1甲基化和大肠癌预后风险的亚组分析
根据年龄是否超过60岁、性别和肿瘤部位进行亚组分析UPS1基因甲基化与大肠癌预后的关系。结果显示,USP1基因甲基化与男性大肠癌预后的关联有统计学意义(HRc=2.027,95%CI:1.226~3.351,P=0.006),调整年龄、UICC分期、组织学分型和肿瘤大小后仍有统计学意义(HRa=2.091,95%CI:1.195~3.661,P=0.010)。在不同年龄组和肿瘤部位的亚组分析中,调整前后,USP1甲基化与结肠癌预后风险的关系均无统计学意义(表4)。

表3 USP1甲基化与大肠癌预后风险的关系
Note:HRcwas crudeHR;HRawas adjusted for age,gender,UICC stages,histological types and tumor size.

表4 USP1基因甲基化与大肠癌预后的亚组分析结果
Note:HRcwas crudeHR;HRawas adjusted for age,gender,UICC stages,histological types and tumor size.
3 讨论
大肠癌的预后与临床病理特征、术后放化疗等因素有关,本研究结果显示UICC肿瘤分期4期、肿瘤大小超过50 mm和组织学分型为非腺型会增加大肠癌预后不良的风险。在男性病例中,调整年龄、UICC分期、组织学分型和肿瘤大小后,USP1基因甲基化的大肠癌预后不良的风险是USP1基因未甲基化的2.027倍。多项研究发现,肿瘤中某些分子学变化也与其预后有关,DNA甲基化可以作为大肠癌治疗和预后的标志物。研究显示,大肠癌中存在多基因启动子区异常甲基化的现象,而发生异常甲基化的基因多具有细胞周期调节、DNA修复、细胞凋亡、血管生成、侵袭和粘附功能[7]。USP1是范可尼贫血(Fanconi anemia,FA)通路相关基因,具有重要DNA修复功能,是FA通路修复DNA损伤过程的关键调节因子。目前,许多化学治疗药物通过使癌细胞产生广泛DNA损伤来靶向针对癌细胞DNA复制。癌细胞为消除基因毒性效应并使其继续不受控制增殖,经常重新激活自身DNA修复机制。因此,本研究结果也为肿瘤靶向治疗提供了新方向和理论依据。
USP1作为DNA修复关键调节因子,主要在FA通路调节FANCD2泛素化和转移损伤DNA合成(TLS)过程中调节PCNA泛素化[8]。USP1过表达可能导致蛋白质泛素化和去泛素化失衡,促进细胞凋亡、增殖、迁移和侵袭,并降低细胞化学敏感性[9]。此外,USP1基因过表达还会导致DNA结合蛋白抑制剂(IDs)累积,直接或间接参与了中心体复制的调控,诱导中心体异常和染色体不稳定等[10],影响肿瘤发生发展。在多种肿瘤中,包括大肠癌,均发现了异常的USP1过表达现象[5],然而其表达上调与肿瘤病人预后的关系仍不清楚。
本研究结果显示,在男性大肠癌患者中,发现USP1甲基化与大肠癌预后关联有统计学意义。虽然基因启动子区甲基化通常会导致基因沉默[11],但仍然有研究表明,一些基因高甲基化与其过表达有关。例如,在急性髓性白血病(AML)中,AWT1基因过表达-高甲基化可作为一种特征性标志物。MMP9基因高甲基化也与其过度表达有关,并在肿瘤发生和进展中起作用[12]。基因体甲基化(如外显子、内含子和增强子)可能影响转录延伸、基因激活和某些可变剪接,基因启动子区的表观遗传改变可能影响转录调控,而转录水平又可能受到其他顺式增强子元件的调控,增强基因表达[13]。基于上述假设,虽然本研究未探讨USP1甲基化与表达之间的直接关联,但USP1甲基化可能是表达上调的一种分子机制。此外,饮食和生活方式在肿瘤生物学中发挥重要作用,三分之一的癌症患者死亡可能由不适当的饮食和生活方式导致[14],而不同性别的人群,其饮食和生活方式均有所不同,同时,本研究结果还可能受到纳入研究队列的样本量的限制。因此,关于USP1基因甲基化能否确认为大肠癌预后标志物的问题还需要进一步研究。
本研究首次探讨了USP1基因甲基化与大肠癌预后之间的关系,存在一定局限性,约10%的患者存在失访,且病例随访结束时间为2014年,未继续随访。
