蛋白酶水解底物特异性机制研究进展
2019-11-06熊科邓蕾柳佳芸裴鹏钢
熊科,邓蕾,柳佳芸,裴鹏钢
1(北京工商大学 北京食品营养与人类健康高精尖创新中心,北京,100048)2(北京工商大学 北京市食品添加剂工程技术研究中心,北京,100048)3(北京工商大学 北京市风味化学重点实验室,北京,100048)4(北京工商大学 北京市质量与安全重点实验室,北京,100048)
蛋白酶在食品、医药、资源环境等领域的应用十分广泛[1-2]。不同蛋白酶由于酶切作用方式及酶切位点不同,对底物的水解效率存在差异。酶切位点的专一性对酶解产物的成分与组成和比例均有较大影响,可直接影响最终产物的应用价值[3]。比如,蛋白酶特异性水解所得到的一些小分子肽类(如谷胱甘肽[4]、活性蛋白[5-7]等),对某些疾病(如心血管疾病[8-11]、乳糜泻[12]、肿瘤[13]、癌症[14]等)具有特殊治疗功效。此外,在小麦麦芽糖化过程中添加蛋白酶特异性水解免疫原性谷蛋白肽可以降低谷蛋白含量,具有生产无麸质啤酒的潜力[15]。而目前采用的酶法分解蛋白质的过程中酶解特异性通常较差,功能性的特异成分产率低,提纯成本高,这限制了蛋白酶解方式的大规模工业化应用。因此,在已有的蛋白酶酶解机制的基础上,进一步研究蛋白酶如何特异性酶解底物,有利于蛋白酶深度应用于改善食品加工工艺[16-17]、高效生产特殊功效因子和减轻环境污染[18-19]等领域中。而目前蛋白酶特异性水解底物的分子机制研究,多集中于对蛋白酶底物与蛋白酶结合催化规律的研究。随着分子生物学和蛋白质工程技术的发展,对蛋白酶水解特异性研究也不断深入,蛋白酶的空间结构、具有催化功能和结合功能的一些氨基酸残基在蛋白酶的底物选择性和水解特异性方面起重要的决定作用。本文围绕蛋白酶的水解特异性,综述了与酶特异性相关的底物基团性质、酶与底物结合部位氨基酸侧链以及酶分子表面电荷等方面的研究进展,以期为今后蛋白酶的特异性酶解体系研究与应用提供参考。
1 蛋白酶催化底物的基本机制
蛋白酶按照蛋白酶水解多肽的方式不同,可以分为内肽酶和外肽酶两类。内肽酶是从蛋白质内部将肽链切断,形成相对分子质量较小的肽段、朊和胨,工业上应用的蛋白酶主要是内肽酶;外肽酶是从蛋白质分子的游离氨基或羧基末端逐一切断肽键,形成游离氨基酸[20]。虽然蛋白酶的基本催化机制可描述为蛋白酶催化蛋白质分子中肽链(即酰胺键)断裂,生成肽链长度较短的肽分子或游离氨基酸,但是普通的蛋白酶催化反应并不能准确反映蛋白酶催化蛋白质水解的实际过程。
蛋白酶催化底物的基本机制可以总结为以下主要学说。诱导契合学说认为,酶与底物可通过电性吸引、疏水相互作用而相互靠近并进行定向。酸碱催化理论认为,酶催化底物时是通过酶瞬时地向反应物提供质子或从反应物接受质子以稳定过渡态,加速反应的进行。共价催化又称为亲和催化或者电子催化,在催化的时候,亲核催化剂或者亲电子催化剂分别放出电子或者汲取电子并作用于底物的缺电子中心或负电子,迅速形成不稳定的共价中间复合物,降低反应的活化能,加速反应[21]。
在催化反应中一般是几种基元催化反应共同作用。在胰凝乳蛋白酶催化三联体结构中,酶活性中心的Ser195、His57、Asp102构成一个氢键体系,使得His57的咪唑基成为Asp102羧基及Ser195羟基间的桥梁,Ser195受His57及Asp102的影响成为较强的亲核基团,提供电子;在这一反应过程中His57的咪唑基起着广义酸碱化作用,它先促进Ser195的羟基亲核地附着在底物敏感肽键的羟基碳原子上,形成共价的酰化中间物,再促进酰化的酶-底物中间物上的酰基转移到水或其他的酰基受体(如氨基酸)上。这样,胰凝乳蛋白酶通过Asp102、His57、Ser195组成的“电荷中继网”催化底物蛋白肽键水解,包括亲核催化和碱催化等催化反应如图1所示。
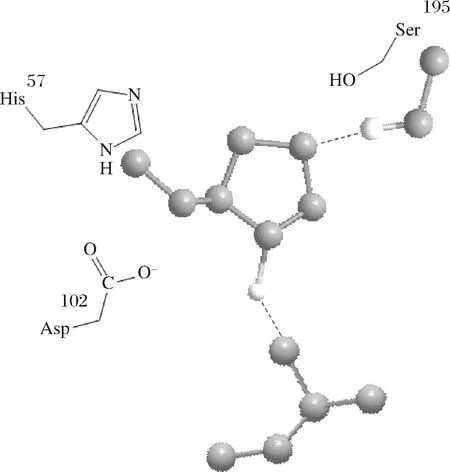
图1 胰凝乳蛋白酶的催化三联体Fig.1 Catalytic triad of chymotrypsin
与胰凝乳蛋白酶相似的是,丝氨酸碱性蛋白酶的活性位点也有一个亲核的丝氨酸残基,需要天冬氨酸和组氨酸残基与活性位点的丝氨酸相连组成催化三联体,由催化底物水解。该过程涉及静电效应、共价催化和酸碱催化等共同作用。但是,与胰凝乳蛋白酶的特异性作用于芳香族氨基酸不同,它具有广泛的底物专一性,可以作用于大多的疏水性氨基酸。因此,仅考虑催化基本机制,无法解释蛋白酶底物特异性之间的差异。
2 蛋白酶水解底物的特异性作用机制
酶的催化能力局限于酶分子的一定区域,只有少数特异性的氨基酸残基参与底物的结合与催化,而这种区域中与酶活直接相关的部位称为酶的活性中心。活性中心可分为催化部位和结合部位,前者负责催化底物键的断裂,形成新键,决定着酶的催化能力;后者负责与底物结合,决定酶的特异性,即决定蛋白酶的底物特异性之间的差异。
如图2所示的胰蛋白酶的关键结构中,Ser195、His57、Asp102为胰蛋白酶的催化残基,Gly26、Asp189、Ser190为关键氨基酸,与远端结构元件(由残基169-175、184-195和213-228组成)决定了该酶的底物特异性。蛋白酶酶切作用方式和对酶切位点的专一性影响底物的水解效率以及酶解产物组成,而具有不同特异性和作用机制的蛋白酶的组合使用还可以改善蛋白质水解产物的功能和生物学特性[22]。因此,蛋白酶特异性的选择对酶解效率和酶解产物具有重要意义。目前蛋白酶的水解底物特异性研究主要集中在以下几方面。
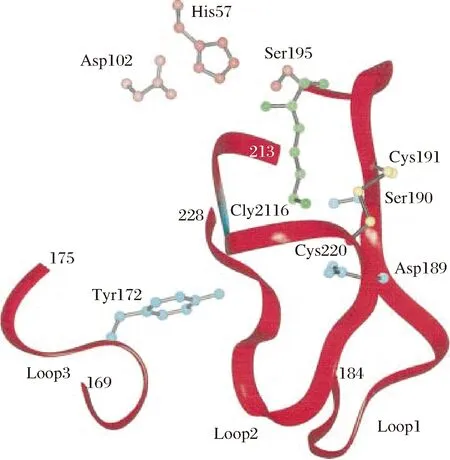
图2 胰蛋白酶的关键结构Fig.2 The key structure of trypsin
2.1 底物蛋白氨基酸肽键的侧链基团性质
从蛋白质的水解产物中分离出来的常见氨基酸只有20种,除了脯氨酸及其衍生物以外,这些氨基酸结构上的共同点是与相邻的α-碳原子上都有1个氨基、1个氢原子和1个可变的侧链(称为R基),不同氨基酸的区别就在于R基的不同。蛋白酶水解蛋白质肽键的反应如图3所示。
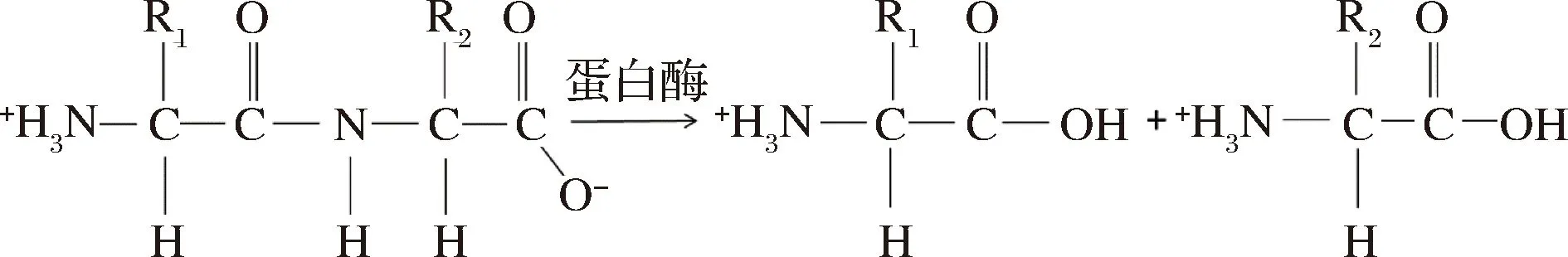
图3 蛋白酶催化肽键水解Fig.3 Protease catalyzes the hydrolysis of peptide bonds
研究表明,内肽酶从蛋白质内部将肽链切断,其对R1和/或R2基团具有特异性要求(表1),且其水解侧链的氨基酸必须是L-型[23]。
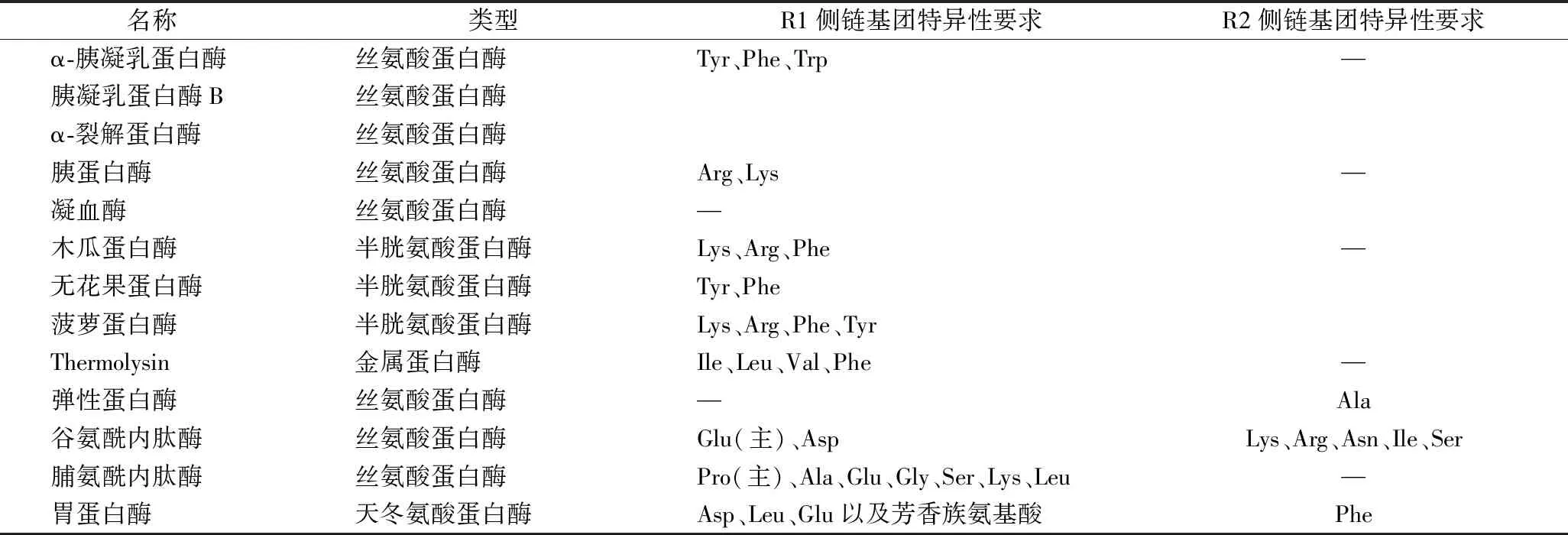
表1 常见蛋白酶的种类和底物特异性Table 1 Types of common proteases and substrate specificity
就常用的蛋白酶而言,如α-胰凝乳蛋白酶、胰凝乳蛋白酶B和α-裂解蛋白酶水解,胰蛋白酶、凝血酶,弹性蛋白酶,木瓜蛋白酶,无花果蛋白酶,菠萝蛋白酶等水解特异性研究已较为成熟,其对R1基团具有较高的特异性要求。据报道,谷氨酰内肽酶(GE)对牛β-酪蛋白的水解具有高度特异性,其主要水解β-酪蛋白中R1侧链为谷氨酸(Glu)残基的肽键,同时还水解R1侧链为天冬氨酸(Asp)残基的肽键,但后者的水解程度较小;在研究曲霉脯氨酰内肽酶(An-PEP)对β-酪蛋白水解特异性时也发现,An-PEP主要水解β-酪蛋白中R1侧链为脯氨酸(Pro)残基的肽键,也有一定水解R1侧链为丙氨酸(Ala)、谷氨酸(Glu)、甘氨酸(Gly)、丝氨酸(Ser)、赖氨酸(Lys)和亮氨酸(Leu)等残基的肽键的能力;天冬氨酸蛋白酶类型的胃蛋白酶则主要水解R1侧链为天冬氨酸(Asp)、亮氨酸(Leu)、谷氨酸(Glu)以及芳香族氨基酸残基的肽键;在对稻田鳗鱼中胃蛋白酶特异性研究中发现,尽管该酶会优先切割某些大体积的疏水性氨基酸残基,但对其他残基的切割较为随机,对R1侧链为亮氨酸(Leu)和苯丙氨酸(Phe)残基的肽键具有高水解率[24-26]。因此,可以推测出绝大部分丝氨酸蛋白酶(弹性蛋白酶除外)、半胱氨酸蛋白酶和天冬氨酸蛋白酶对R1基团都具有较为明显的特异性要求。
而有些蛋白酶,如嗜热菌蛋白酶对R2基团具有较高的特异性要求。在GE对牛α-酪蛋白进行水解研究中,蛋白底物氨基酸序列为Glu-Glu-X(X=Arg、Asn、Ile和Ser)和Glu-Glu-Glu-Lys时该酶优先水解Glu-X和Glu-Lys,因此推测谷氨酰内肽酶(GE)可能对R2侧链为赖氨酸(Lys)、精氨酸(Arg)、谷氨酰胺(Asn)、异亮氨酸(Ile)和丝氨酸(Ser)等残基的肽键具有较强的水解特性。另外,胃蛋白酶对R2基团也有特异性要求,如果R2侧链为苯丙氨酸(Phe)残基,那么这种酶能以最高的速率水解肽键。由此可以推测,绝大部分丝氨酸蛋白酶对R2基团几乎没有特异性要求(谷氨酰内肽酶除外),半胱氨酸蛋白酶对R2基团没有特异性要求,而天冬氨酸蛋白酶对R2基团有较强的特异性要求。
在底物蛋白氨基酸的侧链基团的研究过程中,大多采用LC-MS、RP-HPLC和QTOF-MS/MS、HPLC-ESI MS和MS/MS等液相色谱和质谱手段来进行蛋白质水解产物的分析,通过水解产物的种类和数量来确定特异性的切割位点,从而深入认识其水解底物的特异性。尽管如此,目前对蛋白酶的水解底物氨基酸肽键的侧链基团性质,并未形成一个较为统一、全面的机制性认识。就丝氨酸蛋白酶而言,它包括胰蛋白酶、胰凝乳蛋白酶、弹性蛋白酶等,其活性部位中除了含有丝氨酸残基外,一般还有咪唑基。尽管丝氨酸蛋白酶的作用模式基本相同,但是其与底物相结合的特异性基团不尽相同。由此可见,关于底物氨基酸肽键的侧链基团性质的研究还有待细化和深入,需形成一个较为全面和统一的特异性规律,为进一步提高蛋白酶针对性地水解蛋白提供理论支撑。
2.2 酶与底物的结合部位
蛋白酶的位点专一性,即能识别底物蛋白质中专一的氨基酸顺序,其识别机制与核酸限制性内切酶类似,由酶与底物的特异性结合决定。多肽底物的结合部位,横交于酶表面,即酶的底物结合亚部位,用Sn表示;底物上的氨基酸残基,即与酶结合的部位,用Pn(对肽类来说)表示;基本模式如图4所示。

图4 蛋白酶与底物结合部位Fig.4 The site where the protease binds to the substrate
结合部位的特异性结构决定了底物多肽的氨基酸顺序的特异性识别[28]。
杨凌燕等[29]在利用噬菌体肽库进行底物筛选时发现(如图5-a所示):当P1处为色氨酸(W)时P2处为侧链较小的氨基酸(丙氨酸(A))或碱性氨基酸(组氨酸(H)、精氨酸(R)),P3处也多为侧链较小的氨基酸(丙氨酸(A)、丝氨酸(S))或碱性氨基酸(甲硫氨酸(M));而当P1处为酪氨酸(Y)时,P2、P3处多为侧链较大的氨基酸(苯丙氨酸(F)、甲硫氨酸(M)、亮氨酸(L))。
通过最适宜切割位点的确定,得到的W-R间形成的肽键能很好地与胰凝乳蛋白酶的底物结合部位结合。由此可见,芳香族氨基酸与碱性氨基酸的组合易被胰凝乳蛋白酶作用,而精氨酸(R)无论处在任何位置对水解往往都有促进作用。LOPES等[30]研究昆虫胰蛋白酶的底物特异性(图5-b)时发现,在P1处会优先水解精氨酸(R)以及赖氨酸(K);而昆虫胰蛋白酶亚位点的结合偏好是:P3和P1′处多为丙氨酸(A)、甲硫氨酸(M)等疏水残基,P2和P2’处多为苯丙氨酸(F)、亮氨酸(L)等疏水残基。SCHULZ等[31]在治疗麦胶性肠病和减少蛋白质水解液苦味的研究中,在担子菌金针菇的培养上清液中鉴定出脯氨酰内肽酶FvpP,并在米曲霉中功能性地表达基因验证,通过比较分析得出FvpP具有与来自黑曲霉(An-Pep)的脯氨酰内肽酶几乎相同的P1-P1’底物特异性,如图5-c所示,能水解大多数-Pro-X-键(X=苯丙氨酸(F)、亮氨酸(L)、丝氨酸(S)、丙氨酸(A)、缬氨酸(V)、谷氨酰胺(Q)、酪氨酸(Y)),说明两者都能够降解富含脯氨酸的大蛋白质。
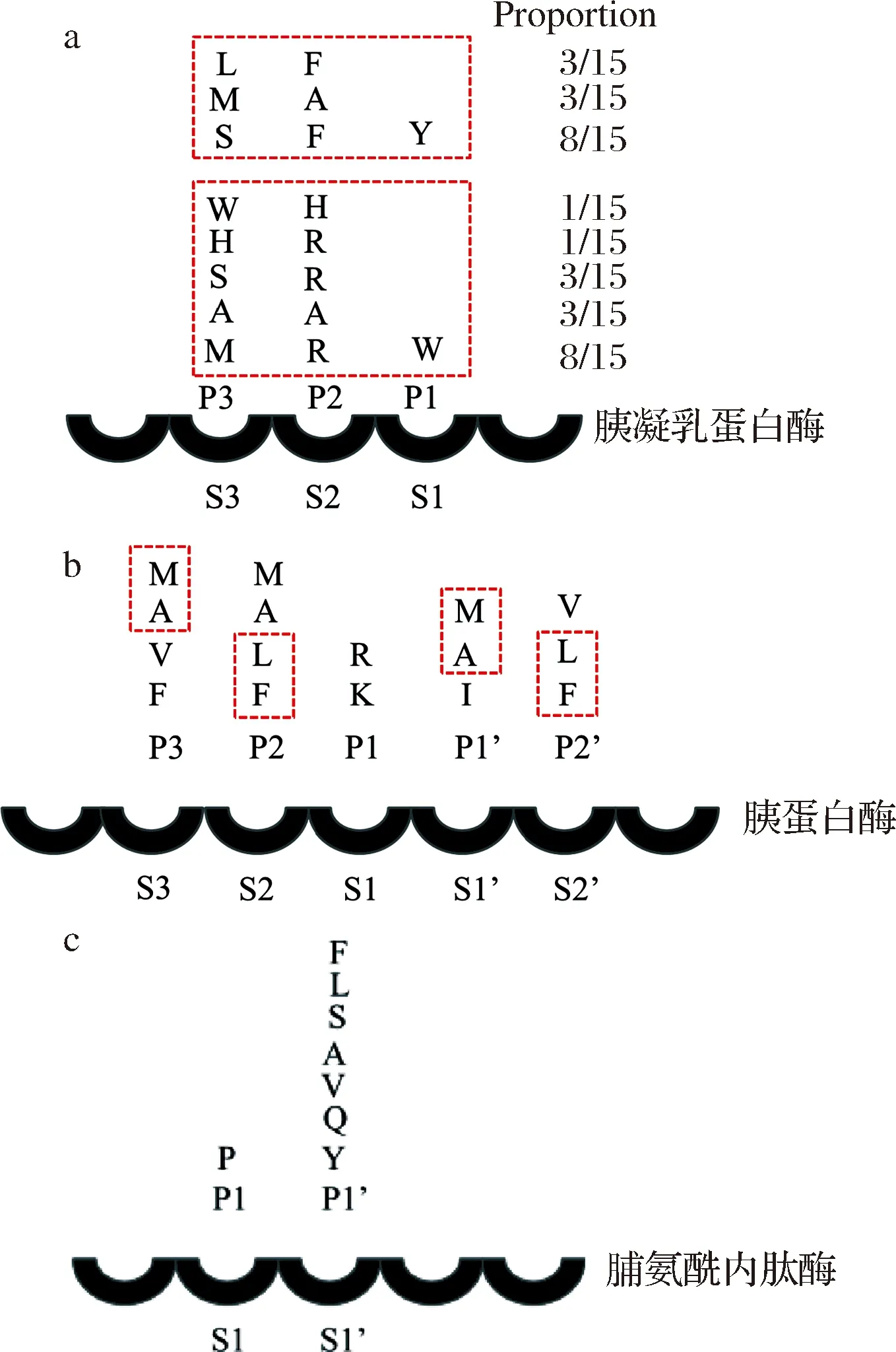
a-胰凝乳蛋白酶;b-胰蛋白酶;c-脯氨酰内肽酶图5 三种蛋白酶的主要特异性位点Fig.5 The main specific sites of three proteases
另一方面,底物与酶的结合部位的氨基酸侧链的大小和结构,也对蛋白酶的底物特异性有着重要影响。α-胰凝乳蛋白酶、胰蛋白酶和弹性蛋白酶与相结合底物的部位均成口袋状,如图6所示,但三者具有不同的底物特异性。α-胰凝乳蛋白酶、胰蛋白酶口袋状结合部位的开口处均为Gly-216和Gly-226,体积较大的氨基酸残基的侧链能顺利进入口袋。
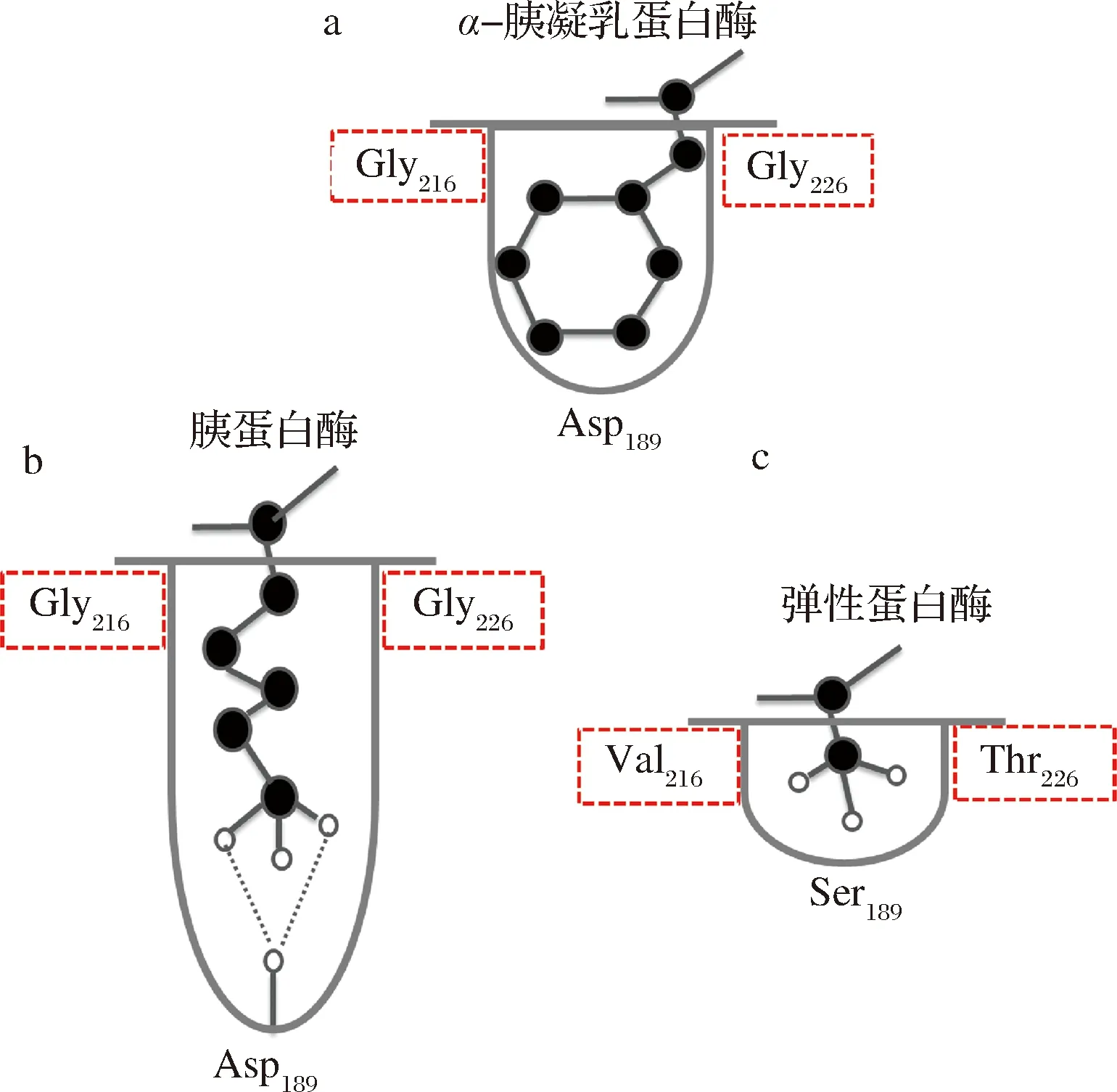
图6 胰凝乳蛋白酶、胰蛋白酶与弹性蛋白酶Fig.6 Chymotrypsin, trypsin and elastase
弹性蛋白酶口袋状结合部位的开口处被Val-216和Thr-226两个大的氨基酸残基侧链所占据,因此,只有小体积的氨基酸残基如-CH3才能进入,这样弹性蛋白的R1-只能为丙氨酸残基。而赖氨酰内肽酶的底物结合位点,由D225与邻近的T189、S214共同形成紧密的S1专一性口袋,狭窄的S1口袋只能容纳线性侧链的氨基酸,其中只有精氨酸和赖氨酸等具有足够长的侧链才能达到S1口袋底部,但由于D225从侧面进入S1口袋并且与精氨酸的侧链胍基在空间上不相容,从而阻碍了S1口袋与精氨酸的结合[32]。因此,S1专一性口袋的体积限制和D225对精氨酸的阻碍确保了赖氨酰内肽酶的赖氨酸特异性。角蛋白酶口袋中位于中间位置的Tyr215疏水性增加使得该酶酶活力先增后减,而侧链空间大小的增加或口袋的缩小使得对P1位氨基酸残基较小的底物酶活增加[33]。
一些蛋白酶优先水解肽键的这种专一性特点,在一些反应系统中还达不到要求,因为有的对底物切割位点附近的氨基酸顺序要求比较严格,因此加深对酶的底物结合亚部位以及底物与酶的结合部位的氨基酸侧链的大小和结构的研究,是提高底物专一性的重要途径。对结合部位的研究,可以更加准确切割目标位点,从而有效地提高蛋白酶的针对性。目前,利用蛋白酶与底物的结合特点,进行蛋白酶筛选底物的方法也十分丰富,今后也会呈现一种更加多样化的趋势。如,基于固载的混合蛋白质为筛选库进行蛋白酶底物筛选,将混合蛋白质通过化学作用键合到固相载体上作为筛选库,此时蛋白库与蛋白酶孵育,其中被蛋白酶酶切的底物蛋白产生的肽段进入溶液,未被酶切的非底物蛋白则留在固相载体上,固液分离后质谱定性定量鉴定溶液中底物肽段后即可得到特异性底物蛋白信息[34]。
2.3 酶分子表面电荷作用
酶分子表面电荷的改变,在不破坏相对活性和稳定性的情况下可使其活性部位周围的静电场发生改变,从而改变活性部位催化基团解离常数pKa,而活性催化基团的解离则直接影响到酶作用的pH范围,使得酶在不同的微环境下有着不同的底物偏好性[35]。α-胰凝乳蛋白酶含有的Ser-189/Asp-189羧基的负电荷可以与底物如赖氨酸ε-氨基的正电荷形成静电相互作用,从而与底物特异性结合。在胰蛋白酶酶解酰化大米蛋白的研究中发现,酰化作用使蛋白质表面的净负电荷增加,有利于胰蛋白酶S1结合袋中Asp残基的负电荷与底物肽链中P1端的负电荷匹配,从而益于胰蛋白酶与蛋白的结合[36]。由此推测,底物表面电荷的变化会影响酶分子表面电荷的作用,从而影响酶与底物的特异性结合。中温胰蛋白酶与嗜冷胰蛋白酶的特异性差异,在于特异性口袋外的非保守带电残基以及在S1口袋产生的电场在性质和幅度上的不同,前者表面电荷通常产生正向诱导S1口袋,而后者表面电荷产生该区域的负电场[37]。张爽[38]研究乳酸菌蛋白酶对凝乳品质的影响,证实了金属离子对乳酸菌蛋白酶特异性水解对应的酪蛋白的活力有较大的影响,其中Fe2+影响最大,结果表明金属离子可能与酶的结合部位有关。
由此可以推测,表面电荷的变化,会提高蛋白酶的特异性或者引起底物的偏好性变化,甚至可能直接改变作用底物的范围,使得酶分子具有异于野生型的特异性。因此,通过调整蛋白酶与底物作用的微环境,如酶分子表面电荷作用,可以达到蛋白酶特异性改造的目的。尽管酶分子表面电荷作用的研究不多,却也是蛋白酶特异性设计改造的重要方式之一。
3 展望
蛋白酶底物特异性对酶解产物的成分与组成都有较大影响,可直接影响最终产物的应用价值。因此,充分利用蛋白酶的特异性提高酶解效率和获取特异目标产物,在食品、医药、环境和饲料等领域有着广泛前景[39-42]。目前大多利用化学修饰、理性设计、非理性设计以及其他基因工程技术对蛋白酶进行改造,提高蛋白酶稳定性、产物产量以及底物特异性等,使得蛋白酶的应用更加具有针对性[43];但就化学修饰方法而言,虽然可以定向改进酶的底物特异性,但由于在实际操作过程中化学反应的参与在一定程度上会影响酶的空间构象,从而可能会导致酶活有一定程度的损失,不利于酶的进一步利用[44];通过分子设计来改变蛋白酶的特异性,也会伴随一些问题,如:以损失酶活为代价来提高其底物的专一性或极端环境耐受性[45-47]。因此,为提高酶解效率、得到特异目标产物,同时解决酶解法生产特异性产物的局限性问题,达到简化工序、减少资源浪费与环境污染以及降低成本等目的,研究者们仍需要从蛋白酶结合部位的基团、电荷等方面对水解特异性机制进行深入地研究,通过对酶解体系进行改造修饰、利用基因工程等手段来提高蛋白酶的水解特异性,以期扩大蛋白酶在食品、医药、环境资源利用与开发以及化工生产等方面的应用。
