UV-C辐照对凡纳滨对虾虾头主要内源酶酶学性质的影响
2019-11-06王贺曹文红章超桦秦小明郑惠娜高加龙
王贺,曹文红,2,3,4*,章超桦,2,3,4,秦小明,2,3,4,郑惠娜,2,3,4,高加龙,2,3,4
1(广东海洋大学 食品科技学院,广东 湛江,524088)2(广东省水产品加工与安全重点实验室,广东 湛江,524088)3(广东省海洋食品工程技术研究中心,广东 湛江,524088)4(水产品深加工广东普通高等学校重点实验室,广东 湛江,524088)
在对虾加工过程中,产生约占机体总质量30%~40%的虾头副产物[1]。对虾的生理结构独特,头部分布消化道、消化腺等消化系统,含有丰富的内源酶[2]。前期研究表明,UV-C辐照可提高虾头内源蛋白酶酶活,但对不同种类内源酶的作用尚不清楚[3]。UV-C波段波长为190~280 nm,有强烈的杀菌作用,可使蛋白质和DNA变性。UV-C辐照是一种应用广泛的食品保鲜技术[4],可引起酶蛋白的变性,易导致蛋白酶失活。但一些研究显示,适度剂量的UV-C会对生物酶具有激活作用。用UV-C辐照南极黄丝瓜藓,其过氧化氢酶、谷胱甘肽还原酶和过氧化物酶的酶活性均显著升高[5],经UV-C辐照后的银杏叶的抗氧化活性显著提高[6]。课题组开发了基于UV-C辐照和梯度温度实现蛋白质高效回收的虾头快速自溶技术[7-8],以凡纳滨对虾虾头为研究对象,检测分析UV-C辐照对虾头主要内源酶酶学性质及酶活的影响规律,为UV-C辐照激活虾头内源酶的机制研究及虾头酶制剂的开发提供基础数据。
1 材料与方法
1.1 材料与试剂
虾头:鲜活凡纳滨对虾,购于湛江市湖光镇市场,活体摘取虾头;福林酚试剂,北京鼎国生物科技有限公司;Chitin和牛血红蛋白,Sigma公司;蜗牛酶、棕榈酸对硝基苯酯、L-酪氨酸和甘氨酸,上海源叶生物有限公司;其他化学试剂均为国产分析纯。
1.2 主要仪器设备
HH-4A型数显恒温水浴锅,常州国华电器有限公司;PHSJ-4F型精密pH计,上海仪电科学仪器股份有限公司;UV-2550UV-C可见分光光度计,上海旦鼎国际贸易有限公司;T-18型分散机,上海珂淮仪器有限公司;TGL 16M型台式高速冷冻离心机,长沙英泰仪器有限公司;30 W紫外灯(波长253.7 nm),广东雪莱特光电科股份有限公司;Varioskan Flash型全自动酶标仪,美国Thermo公司。
1.3 实验方法
1.3.1 虾头UV-C辐照的方法
UV-C辐照虾头促进内源酶活力参考CAO[7]等的方法。取虾头匀浆,平铺于托盘上(虾浆厚度小于5 mm),置于紫外灯下辐照以激活内源酶(UV-C辐照条件:紫外灯功率30 W,紫外灯高于托盘20 cm,辐照时间20 min)。温度和pH对内源酶酶活影响较大,故以UV-C辐照、温度和pH为条件测定酶活,探究其对内源酶的影响。
1.3.2 虾头内源酶液初步提取
内源酸性蛋白酶酶液提取:将虾头在低温条件下匀浆,按体积比1∶3加入预冷(4 ℃)0.05 mol/L pH 3的甘氨酸-HCl缓冲液均质,在高速冷冻离心机以4 ℃、9 000 r/min离心10 min,上清液即为初步提取酶液。
内源碱性蛋白酶酶液提取:将虾头在低温条件下匀浆,按体积比1∶3加入预冷(4 ℃)0.05 mol/L pH 8的磷酸盐缓冲液均质,在高速冷冻离心机以4 ℃、9 000 r/min离心10 min,上清液即为初步提取酶液[9]。
内源脂肪酶酶液提取:按虾头和缓冲液体积比1∶2加入预冷(4 ℃)的 0.05 mol/L pH 8的Tris-HCl缓冲液,均质,在高速冷冻离心机以10 000 r/min、4 ℃离心25 min,重复2次,取上清液,即为粗酶液[10-12]。
内源几丁质酶酶液提取:将虾头按体积比1∶4加入20 mmol/L pH 5的醋酸钠缓冲液,在组织捣碎机中匀浆后速冻至0 ℃。解冻后在4 ℃抽提1 h,以8 000 r/min离心15 min,取上清液[13]。
内源多酚氧化酶酶液提取:虾头在低温条件下匀浆,加入2.5倍体积的0.067 mol/L磷酸缓冲液(0 ℃,pH 7.2)进行匀浆,匀浆后在4 ℃、10 000 r/min下离心30 min,合并上清液即为粗酶提取液[14-16]。
1.3.3 内源酶酶活力检测
1.3.3.1 酸性蛋白酶酶活力检测
准确配制所需pH的0.5%(体积分数)的血红蛋白溶液。取3支试管分别加入经稀释后的酶液20 μL、血红蛋白溶液1 mL,室温(25 ℃)下反应20 min,加入0.4 mol/L三氯乙酸(TCA)0.5 mL终止反应,常温下以10 000 r/min离心20 min,在280 nm波长处检测吸光值。
1.3.3.2 碱性蛋白酶活力检测
准确配制所需pH的2%(体积分数)的酪蛋白溶液。将1 mL 2%酪蛋白溶液于相应温度下预热5 min,然后加入1 mL经稀释后的粗酶液于相应最适温度下保温20 min,加入2 mL 0.4 mol/L TCA终止反应,继续保温10 min使残余蛋白质沉淀完全,然后于常温下以10 000 r/min离心15 min,取1mL上清液根据标准曲线的测定方法进行测定,空白溶液的配制:将1 mL酶液保温5 min,加入2 mL TCA,然后加入1 mL 2%酪蛋白溶液,静置10 min,于常温下以10 000 r/min离心15 min,上清液即为空白溶液。取上清液1 mL于500 nm波长处检测吸光值。
1.3.3.3 脂肪酶酶活力检测
取4-硝基苯磷酸二钠(pNPP)底物溶液,加入1 mL 0.05 moL/L pH 8的Tris-HCl溶液,混合均匀,37 ℃稳定2 min。在平行样中加入300 μL酶液,37 ℃水浴反应15 min。在空白管内加入300 μL已经灭活的酶,并将所有的管放入-20 ℃保持5 min以终止反应。在410 nm波长下测定吸光值。
1.3.3.4 几丁质酶酶活力检测
取3支试管,分别加入0.05 mol/L醋酸缓冲液、1%(体积分数)胶体几丁质、粗酶液各50 μL,37 ℃水浴反应2 h,4 000 r/min离心10 min终止反应。取上述反应的上清液50 μL,加入5 μL 1%(体积分数)蜗牛酶溶液,在37 ℃水浴反应30 min;随后加入25 μL饱和硼砂溶液,沸水浴7 min;待冷却后,向试管内加入250 μL冰醋酸、125 μL 1%(体积分数)对二氨基苯甲醛(DMAB)溶液,并在37 ℃水浴中反应15 min;在585 nm波长处测定吸光值。
1.3.3.5 多酚氧化酶酶活力检测
准确配制0.5 moL/L儿茶酚溶液、0.5 moL/LL-脯氨酸溶液和0.067 moL/L磷酸盐溶液,取3支试管,先后加入2.2 mL磷酸缓冲液、0.2 mLL-脯氨酸、0.2 mL儿茶酚,以及0.4 mL酶液,将试管置于37 ℃恒温水浴中10 min;然后将反应溶液置于比色皿中,在530 nm波长下测定吸光值。
1.4 UV-C辐照前后pH和温度对内源酶酶活力的影响
取新鲜虾头匀浆,探究UV-C辐照前后pH对内源酶的影响,经过UV-C辐照后,蛋白酶在40 ℃分别取pH 2~10测定酶活力。脂肪酶在40 ℃分别取pH 6~11测定酶活力。几丁质酶在37 ℃分别取pH 3~9测定酶活力。多酚氧化酶在37 ℃分别取pH 6~10测定酶活力。不经过UV-C辐照作为对照组,其余操作与上述相同。探究UV-C辐照前后温度对内源酶的影响,经UV-C辐照后蛋白酶分别在最适pH 3和pH 8 于10~70 ℃下测定酶活力;脂肪酶在pH 10于20~70 ℃测定酶活力。几丁质酶在pH 5于20~60 ℃测定酶活力。多酚氧化酶在pH 6于25~75 ℃下测定酶活力。不经过UV-C辐照作为对照组,其余操作与上述相同。
1.5 数据统计分析
每个实验重复3次,数据用“平均值±标准差”表示;采用Excel 2010进行标准偏差分析和作图,UV-C辐照前后的酶活差异性采用SPSS 20.0 软件进行t检验,P<0.05为显著差异(*),P<0.01为极显著差异(**)。
2 结果与分析
2.1 pH和温度对UV-C辐照前后凡纳滨对虾虾头内源蛋白酶酶学性质的影响
pH和温度是影响蛋白酶酶活力的重要因素。UV-C辐照前后在pH 2~11之间虾头的蛋白酶活性如图1所示。

图1 pH对UV-C辐照前后虾头内源蛋白酶酶活的影响Fig.1 Effect of pH on the activity of the endogenous protease in shrimp head before and after UV-C irradiation注:**表示在P<0.05水平上具有显著性差异;“表示在P<0.01水平上具有极显著性差异。下同。
UV-C辐照前后虾头的内源蛋白酶在酸性、碱性范围内均存在蛋白酶活性峰,其中酸性蛋白酶在pH 3~6左右,随着pH值的升高,酶活力逐渐变弱,而UV-C辐照前后活性峰都在pH 3左右,和本团队前期研究结果研究相同[17]。说明凡纳滨对虾酸性蛋白酶最适pH为3。碱性蛋白酶活性峰在pH 8~10之间,随着pH值再升高,酶活力逐渐下降,且UV-C辐照前后最适pH无明显变化,与庄志凯的研究结果相似[9],比DADSHAHI等从凡纳滨对虾中提取出的一种新型热稳定性蛋白酶的最适pH值7略高[18],可能与生活环境有关。如图2所示,在pH 3、温度60 ℃虾头内源酸性蛋白酶经UV-C辐照后酶活力(408.93 U/g)极显著高于未经过UV-C辐照的虾头内源蛋白酶(329.81 U/g)(P<0.01),提高了23.99%。在其他温度下,UV-C辐照后虾头内源蛋白酶的活力也均不同程度地高于未UV-C辐照的对照组;酸性蛋白酶的最适温度为50~70 ℃左右,与沈文英所研究的最适温度37 ℃相比略高[19]。图3为不同温度条件下UV-C辐照前后虾头内源碱性蛋白酶的酶活力变化,结果显示内源碱性蛋白酶(pH 8)在30、40、60 ℃时酶活力显著提高(P<0.05),在40 ℃时由2 253.45 U/g上升为3 098.24 U/g,提高了37.49%,其最适温度在40~60 ℃。研究发现海洋碱性蛋白酶最适温度60 ℃[20],潘滨等也研究发现凡纳滨对虾碱性蛋白酶最适温度为40~60 ℃[21],说明碱性蛋白酶在此温度范围内都有较高酶活。UV-C辐照能够促进虾头自溶[22],且UV-C辐照前后不同温度、pH下的酶活力变化数据表明,UV-C辐照能进一步提高虾头中原有活性蛋白酶的酶活,但不能激活新的内源蛋白酶。

图2 温度对UV-C辐照前后虾头内源酸性蛋白酶酶活的影响Fig.2 Effect of temperature on the activity of the endogenous acid protease in shrimp head before and after UV-C irradiation

图3 温度对UV-C辐照前后虾头内源碱性蛋白酶酶活的影响Fig.3 Effect of temperature on the activity of the endogenous alkaline protease in shrimp head before and after UV-C irradiation
2.2 pH和温度对UV-C辐照前后凡纳滨对虾虾头内源脂肪酶酶学性质的影响
在pH 6~11脂肪酶酶活力变化如图4所示,脂肪酶的活性总体先增加后降低,在pH 6~11,40 ℃时UV-C辐照大部分极显著高于对照组。其中pH 8酶活力由2.17 U/g上升为5.28 U/g提高了143.32%(P<0.01)。pH 10时酶活力由5.24 U/g上升为6.36 U/g,提高了21.37%(P<0.01)。脂肪酶酶活力最适pH为10左右,和南极磷虾相似,但是最适温度比南极磷虾高[11],可能是它们生活环境所致。经UV-C辐照后,在pH为6~10时虾头均显示出较高的脂肪酶活性,且最适pH范围扩大。由图5所知,不同温度下的酶活力先升高后降低,表明脂肪酶活化分子在一定范围内随着温度的增加而增加,从而使催化反应加快,但是脂肪酶处于高温情况下容易变性失活进而导致酶活力降低。在温度为40 ℃左右时酶反应速率最高;50 ℃以后,酶活力下降。在温度为70 ℃时酶失活,与其他学者研究结果相似[23]。经UV-C辐照后,在20、40和50 ℃酶活力极显著提高(P<0.01)。其中20 ℃时,酶活力由1.36 U/g上升为2.11 U/g,提高了55.15%。50 ℃时酶活力由0.85 U/g上升为1.69 U/g,提高了98.82%。UV-C辐照对虾头内源脂肪酶的最适pH范围有所扩大,但最适温度无显著变化。

图4 pH对UV-C辐照前后虾头内源脂肪酶酶活的影响Fig.4 Effect of pH on the activity of the endogenous lipase in shrimp head before and after UV-C irradiation

图5 温度对UV-C辐照前后虾头内源脂肪酶酶活的影响Fig.5 Effect of temperature on the activity of the endogenous lipase in shrimp head before and after UV-C irradiation
2.3 pH和温度对UV-C辐照前后凡纳滨对虾虾头内源几丁质酶酶学性质的影响
几丁质代谢与虾的生长密切相关,它在虾壳中合成、裂解[24]、体液调节过程中起重要作用[25]。虾头中含有几丁质酶并且肝胰腺中酶活力较高[26]。由图6所知,UV-C辐照前几丁质酶最适pH为5左右,与脊尾白虾中最适pH值相似[13],日本囊对虾几丁质酶最适pH 6.7[27]。经UV-C辐照后最适pH变为6左右。在40 ℃、pH 6时UV-C辐照后几丁质酶酶活力由3.74 U/g上升为5.15 U/g,提高了37.70%,酶活力显著提高(P<0.05)。由图7所示,几丁质酶最适作用温度为40 ℃,与罗氏沼虾[28]和脊尾白虾[13]的最适温度类似。在pH 6、不同温度下,经UV-C辐照后酶活力都有极显著差异,其中20 ℃时,UV-C辐照后酶活力由3.67 U/g上升为5.12 U/g,提高了39.51%(P<0.01)。30 ℃时,UV-C辐照后酶活力由3.76 U/g上升为4.89 U/g,提高了30.05%(P<0.01)。60 ℃时,UV-C辐照后酶活力由3.75 U/g上升为4.65 U/g,提高了24.00%(P<0.01)。因此,UV-C辐照对虾头几丁质酶具有显著的激活作用,对其最适pH有所影响,对其最适温度的影响不明显。
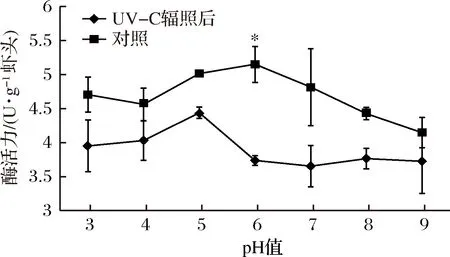
图6 pH对UV-C辐照前后虾头内源几丁质酶酶活的影响Fig.6 Effect of pH on the activity of the endogenous chitinase in shrimp head before and after UV-C irradiation

图7 温度对UV-C辐照前后虾头内源几丁质酶酶活的影响Fig.7 Effect of temperature on the activity of the endogenous chitinase in shrimp head before and after UV-C irradiation
2.4 pH和温度对UV-C辐照前后凡纳滨对虾虾头内源多酚氧化酶酶学性质的影响
UV-C辐照前后凡纳滨对虾虾头内源多酚氧化酶在不同pH条件下的酶活力变化如图8所示,UV-C辐照前后多酚氧化酶酶活力在pH 6~10都存在一个活性峰,其最适pH为8,与东海中华管鞭虾最适pH 7.5相近[29];在经过UV-C辐照后酶活力均显著提高,在pH为8时酶活力,由47.29 U/g提高到69.29 U/g,提升了46.52%(P<0.01)。图9为pH 8时不同温度对虾头内源多酚氧化酶活力的影响,在25~75 ℃的范围内,随着温度的升高多酚氧化酶酶活力呈下降趋势,但在75 ℃尚未完全失活,与CARVALHO等人的研究结果相似[30]。在温度为35 ℃时,经UV-C辐照后酶活由42.44 U/g上升为54.54 U/g,提高了28.51%(P<0.01)。在45 ℃时,经UV-C辐照后酶活由30.10 U/g上升为34.74 U/g,提高了15.42%(P<0.05)。在55 ℃时,经UV-C辐照后酶活力由26.92 U/g上升为29.55 U/g,提高了9.77%(P<0.05)。结果表明UV-C辐照对多酚氧化酶最适pH和温度没有明显影响,对酶活力有显著激活作用。
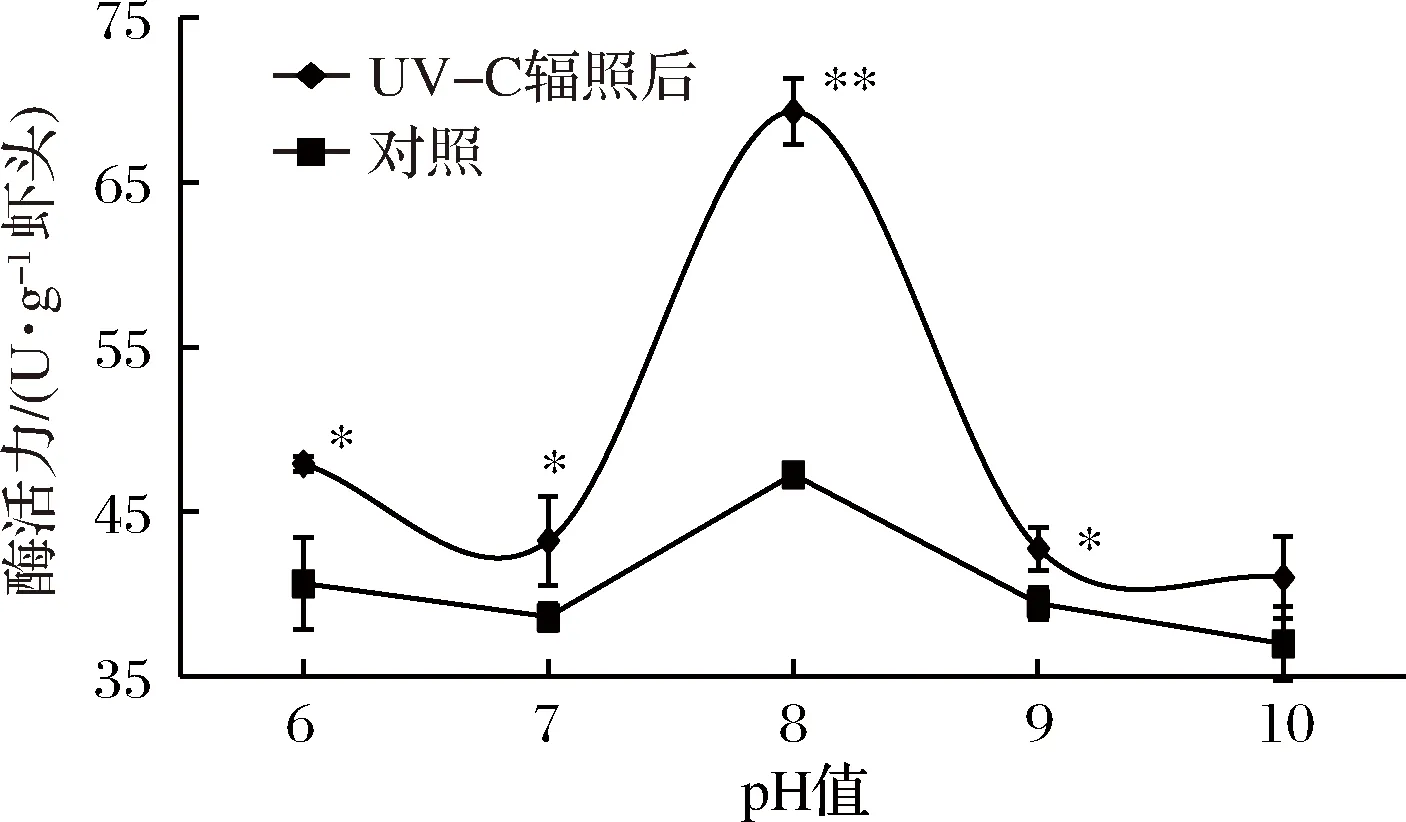
图8 pH对UV-C辐照前后多酚氧化酶酶活影响Fig.8 Effect of pH on the activity of the endogenous polyphenol oxidase in shrimp head before and after UV-C irradiation

图9 温度对UV-C辐照前后多酚氧化酶酶活影响Fig.9 Effect of temperature on the activity of the endogenous polyphenol oxidase in shrimp head before and after UV-C irradiation
3 结论
(1)UV-C辐照前后虾头酸性蛋白酶、碱性蛋白酶和多酚氧化酶的最适pH和温度的酶学特性无明显变化,对脂肪酶和几丁质酶的最适pH有所改变,对各种内源酶的最适温度均无显著影响。UV-C辐照后,内源酸性蛋白酶最适为pH 3,温度60 ℃左右;内源碱性蛋白酶的最适pH 8,温度50 ℃左右;内源几丁质酶最适pH由5变为6左右,温度40 ℃左右;内源脂肪酶最适pH由10变为6~10,温度40 ℃左右;内源多酚氧化酶最适pH 8,温度为25 ℃左右。
(2)在30 W、20 cm高度、UV-C辐照20 min的最适条件下,UV-C辐照后内源酶酶活提高,酸性蛋白酶酶活由329.81 U/g上升为408.93 U/g,提高了23.99%;碱性蛋白酶由2 253.45 U/g上升为3 098.24 U/g,提高了37.49%;脂肪酶由5.24 U/g上升为6.36 U/g,提高了21.37%;几丁质酶由3.74 U/g上升为5.15 U/g,提高了37.70%;多酚氧化酶由47.29 U/g上升为69.29 U/g,提高了46.52%。
(3)UV-C辐照对凡纳滨对虾虾头主要内源酶均有显著的激活作用,但其激活机制有待进一步深入研究。
