血清异常糖链糖蛋白联合尿细胞角蛋白-19检测对膀胱癌早期诊断的价值
2019-11-06吴万文吕蔡刘振湘徐海霞张淑芳
吴万文,吕蔡,刘振湘,徐海霞,张淑芳
膀胱癌是世界第七大常见癌症,是泌尿系统最常见的肿瘤之一[1]。男性占总发生率的80%左右[2-3]。在膀胱癌早期诊断上,膀胱镜检查及尿脱落细胞学检测被公认为临床上的金标准;但膀胱镜检查存在创伤大,尿脱落细胞学存在敏感性低等局限性,误诊、漏诊现象明显,致患者常错过最佳治疗时机[4]。临床上膀胱癌的病理分期及细胞分级对于该病的诊断、治疗及预后判断很重要,但目前尚缺乏一种真正能应用于临床的生物学标志物。异常糖链糖蛋白又称肿瘤异常蛋白(TAP),是肿瘤细胞新陈代谢过程中释放到血液中的一类异常糖基化蛋白,已被证明其与多种肿瘤的发生、发展、转移和预后关系密切[5-6]。细胞角蛋白(CK)-19是一种水溶性酸性多肽分子,主要分布于上皮细胞中,当膀胱上皮细胞发生癌变时,CK-19便被释放到尿液中[7]。本研究旨在探讨血清TAP联合尿CK-19检测对膀胱癌早期诊断的应用价值,为膀胱癌早期诊断提供参考。
1 对象与方法
1.1研究对象 选取2015年6月—2018年9月于海口市人民医院泌尿外科确诊的膀胱癌患者(膀胱癌组)50例,男38例,女12例,平均年龄(57.84±10.39)岁;其中病理检测结果根据WHO 2004分级系统分为乳头状瘤8例,低度恶性倾向的乳头状瘤15例,低级别膀胱癌11例和高级别膀胱癌16例。根据国际抗癌联盟的TNM分期标准,浅表性(Tis~T1期)膀胱癌27例,浸润性(T2~T4期)23例。纳入标准:(1)均为首次经病理学手段确诊为膀胱癌。(2)受试前无相关手术治疗史。(3)受试前1个月内未接受放、化疗及其他治疗。(4)配合并自愿完成所有检测项目。排除标准:(1)合并其他恶性肿瘤、泌尿系恶性疾病、精神病等相关疾病的患者。(2)中途放弃,检测数据不全者。选择同期45例泌尿系良性疾病者为对照组,男32例,女13例,平均年龄(58.97±11.28)岁。纳入标准:仅患尿道感染、尿路结石、慢性前列腺炎等泌尿系良性疾病,未患其他恶性肿瘤性疾病;配合并自愿完成所有检测项目。2组性别构成(χ2=0.292)、年龄(t=0.508)差异无统计学意义(P>0.05),具有可比性。本研究所有对象遵循自愿原则,均签署知情同意书。
1.2主要试剂与仪器 血清TAP检测试剂盒(凝集法)购自浙江瑞生医疗科技有限公司;CK-19检测试剂盒购自武汉博士康生物工程有限公司;显微镜购自日本Olympus;酶标仪购自美国Bio-Tek。
1.3方法
1.3.1样本采集 所有对象在采样1周前均未行膀胱镜检、导尿、膀胱灌注等泌尿系侵入性操作。采集研究对象手指末端的2滴新鲜全血用于TAP检测;同时采集新鲜尿液100~200 mL,新鲜尿液指无尿状态下饮水500 mL,1~2 h后第1次膀胱排空的尿液。
1.3.2血清TAP检测 取手指末端的2滴新鲜全血分别滴于玻片上,在玻片上推成约占玻片长度2/3的两片均匀血片,室温下静置15 min待干;后取TAP检测试剂在2片血片上各均匀滴加3滴,室温下静置15 min待干;后于显微镜下观察凝集物的大小并测量面积,记录所观察的最大凝集物面积代表该样本TAP的水平。
1.3.3尿CK-19检测 取收集的新鲜尿液于2 h内严格根据说明书操作,采用酶联免疫吸附反应检测CK-19的水平。
1.4统计学方法 采用SPSS 19.0软件进行统计学处理。符合正态分布的计量资料用均数±标准差(±s)表示,组间比较用t检验。计数资料用例(%)表示,组间比较采用χ2检验。偏态分布计量资料采用M(P25,P75)表示,组间多重比较采用Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.12组患者血清TAP及尿液CK-19水平比较 与对照组比较,膀胱癌组血清TAP及尿液CK-19水平均升高(均P<0.01),见表1。

Tab.1 Comparison of the serum TAP and urinary CK-19 levels between the two groups表1 2组患者血清TAP及尿液CK-19水平比较
2.2二元Logistic回归分析建立TAP与CK-19联合诊断模型 以是否膀胱癌为因变量(是=1,否=0),TAP和CK-19为自变量,经二元Logistic回归分析建立膀胱癌TAP与CK-19联合诊断模型:logit[TAP联合CK-19]=-4.118+0.030×TAP+0.327×CK-19,作为膀胱癌早期诊断新指标,见表2。
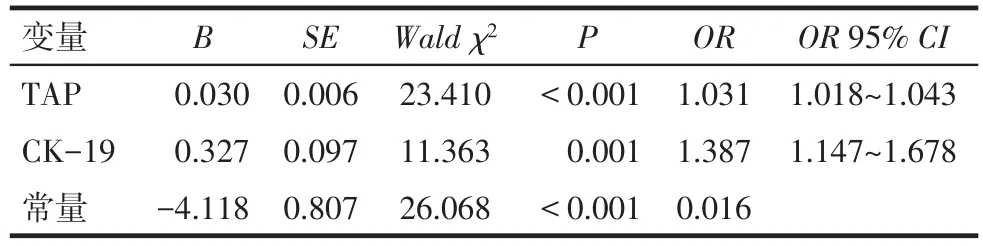
Tab.2 The results of binary Logistic analysis表2 二元Logistic回归分析结果
2.3ROC曲线及诊断效能分析 TAP联合CK-19检测ROC的AUC值、约登指数均高于TAP和CK-19,提示TAP联合CK-19诊断价值优于两者单独检测,见表3、4,图1。

Tab.3 ROC curve analysis of early diagnostic indicators of bladder cancer表3 各膀胱癌早期诊断指标ROC曲线结果分析

Tab.4 Comparison of efficacy of different methods in early diagnosis of bladder cancer表4 不同方法对膀胱癌早期诊断效能比较

Fig.1 The ROC curve of serum TAP,urine CK-19 and their combined detection图1 血清TAP、尿CK-19及二者联合检测的ROC曲线
3 讨论
目前,膀胱黏膜活检以及辅助的尿脱落细胞学检测被认为是膀胱癌诊断的金标准;然而,这些方法具有各自的局限性,因此寻找一种无创的早期诊断方法并对预后进行评估显得十分重要。近些年,越来越多的血清和尿液中的膀胱癌标志物被发现。例如TAP、膀胱癌抗原、生存素、特异性核基质蛋白4、CK-17、CK-19等[8]。而本研究通过二元Logistic回归分析建立TAP与CK-19联合诊断模型,结果发现TAP联合CK-19检测的ROC曲线下面积及约登指数均高于TAP及CK-19单独检测的结果,提示两者联合检测可作为膀胱癌早期诊断的新指标,并能提升单一指标检测的诊断价值及效能。
致癌因素的刺激促进原癌基因和抗癌基因的逐渐变异,继而导致癌症的发生。基因突变导致了功能蛋白的变化,进而导致一大类不规则的糖链糖蛋白的产生[9]。其中一种是钙-组蛋白复合物,另一种是糖链异常的糖蛋白,其主要分布在细胞膜上,是由变异基因翻译后形成的功能异常的糖蛋白;与正常糖蛋白比较,其具有较长的糖链和复杂的分支结构,分子质量也存在很大差异[10]。TAP是异常糖蛋白、钙组蛋白以及细胞癌变后基因表达产物的复合物,其可间接反应癌细胞的数量和癌变程度。当肿瘤细胞生长到一定数量时,TAP会释放到外周血中,通过凝集法被检测出。祁洁等[11]证实,血清TAP检测乳腺癌的敏感度、特异度和准确度均高于癌胚抗原和糖链抗原153,可作为乳腺癌早期筛查的重要指标。吴永梅等[12]证实,TAP检测是常见消化道肿瘤筛查、早期诊断及预后判断的科学、有效的方法。刘丽燕等[13]证实,外周静脉血TAP检测非小细胞肺癌(NSCLC)敏感性较高,可用于患者的疗效监测和评估。本研究显示,50例膀胱癌患者中有35例被检测为真阳性,仍有15例检测为TAP阴性,笔者猜测可能存在以下几个因素:(1)处于终末期的膀胱癌患者体内蛋白质水平较低,可导致分泌不规则的糖链糖蛋白的量显著低于试剂盒的检测范围。(2)患者体内癌细胞增殖不活跃,进而导致不规则的糖链糖蛋白的分泌水平较低,而45例泌尿系良性疾病患者(对照组)有4例检测为TAP阳性,一定程度上可能反映了这4例患者潜在的患癌风险,但仍需进一步检测来确认。
CK-19是分子质量大约在40 ku的Ⅰ类细胞角蛋白家族成员,是在早期发育过程中最早被发现的角蛋白。此外,许多癌前组织和恶性组织均发现CK-19的表达,例如肺癌、乳腺癌、胰腺癌、胃癌和结直肠癌等,提示CK-19在多种癌症的早期诊断方面可能具有潜在优势。CK-19阳性的肝细胞癌被证明具有早期转移、低分化与高侵袭性等恶性生物学特性,提示其对癌症干细胞、血管生成、肿瘤细胞侵袭性以及凋亡的作用明显[14]。郭晓斌等[15]证实,CK-19诊断老年早期NSCLC的敏感度为85.71%,特异度为82.50%,ROC曲线下面积为0.84,优于癌胚抗原及鳞状细胞癌相关抗原。晋学飞等[16]证实,人类软骨糖蛋白39与CK-19在膀胱癌患者的尿液中高表达,两者联合检测有利于膀胱癌的早期诊断。吕慧汇[17]证实,在膀胱癌的早期诊断中,尿CK-19检测的敏感度显著高于传统尿脱落细胞学检测,且尿端粒酶、生存素联合CK-19检测与单指标检测比较能显著提升检测的敏感度和准确性。Huang等[18]的Meta分析结果显示,在1 262例膀胱癌患者中,血清CK-19检测的敏感度为42%、特异度为94%,尿液CK-19检测的敏感度为82%、特度为80%,两者差异显著;但ROC曲线下面积分别为0.88和0.87,差异不明显,提示血清和尿液CK-19均可作为膀胱癌诊断的重要指标。而本研究通过二元Logistic回归分析建立TAP与CK-19联合检测的新诊断指标,结果显示两者联合检测的ROC曲线下面积、约登指数、敏感度和特异度均大于单指标检测的结果,提示两者联合检测能提升膀胱癌早期诊断的价值及效能。
综上所述,血清TAP及尿液CK-19在膀胱癌患者中高表达;且两者联合检测能提升单指标检测的诊断价值及效能,有助于膀胱癌的早期诊断。但本研究仍存在样本量偏少,试剂盒检测结果不准确的局限性。因此,血清TAP联合尿液CK-19检测在临床上的推广应用仍需进一步扩大样本去证实。
