高磷通过SET8调控p53/Bcl-2/Caspase信号通路促进血管平滑肌细胞钙化
2019-11-06张东雪路静
张东雪,路静
心血管疾病发病率逐年增加,血管钙化是导致心血管疾病发病率增加的关键环节[1]。Wang等[2]研究发现引起血管钙化的诸多因素中,高磷血症为始动因素,高磷可诱导血管平滑肌细胞(vascular smooth muscle cells,VSMCs)发生表型转化和凋亡,进而导致血管钙化的发生。寻找高磷因素诱导的血管钙化的机制,对于临床诊治有重要价值。组蛋白赖氨酸甲基转移酶SET8是现今发现的唯一能够特异性催化组蛋白H4第20位的赖氨酸甲基转移酶(H4K20),可甲基化p53、TWIST等非组蛋白,参与调控细胞增殖、凋亡及转分化等[3]。现SET8在血管钙化中的作用研究较少,且机制不明确。本研究旨在以大鼠VSMCs为研究对象,探讨SET8在高磷诱导VSMCs钙化中的作用及机制。
1 材料与方法
1.1实验试剂及仪器 胎牛血清和DMEM培养基购自美国GIBCO公司;反转录试剂盒和增强型ECL试剂盒购自美国Therom公司;SET8-短发夹RNA(shRNA)质粒购自广州复能基因有限公司;LipofectamineTM2000购自美国Invitrogen公司;PI/Annexin V凋亡检测试剂盒购自美国BD公司;鼠单克隆抗体SET8、p53和兔单克隆抗体Bax、Caspase3与兔多克隆抗体Bcl-2均购自英国Abcam公司;兔单克隆抗体GAPDH购自美国Bioworld公司;兔二抗与鼠二抗购自美国KPL公司。细胞培养箱、RT-PCR仪和蛋白电泳仪购自美国Therom公司,凝胶成像仪购自美国Proteinsimple公司,倒置荧光显微镜购自日本奥林巴斯公司。
1.2实验模型的制备与分组 选取6只清洁级SD大鼠,均为健康雄性,购自河北医科大学动物实验中心(证书号:1305090)。取大鼠胸主动脉,剥离弃去血管内外膜,取中膜,将其剪成1 mm×1 mm×1 mm小块,细胞培养瓶底均匀铺开,使用含10%胎牛血清的DMEM培养基培养细胞至第3~4代时接种于6孔板中,细胞融合度达70%~80%进行干预。为了探究高磷诱导的VSMCs中SET8及细胞凋亡情况,将VSMCs随机分为正常组和高磷组(10 mmol/L β-甘油磷酸),培养4 d,采用茜素红染色检测细胞内钙盐沉积,采用甲基麝香草酚蓝比色法检测钙含量,采用流式细胞学检测细胞凋亡情况,采用Western blot和PCR检测细胞内SET8、p53、Bcl-2、Bax、Caspase3的蛋白和mRNA的表达。为了探究SET8对细胞凋亡的调控作用,将VSMCs随机分为3组,对照组、空质粒组(NS-shRNA)和SET8-shRNA组,SET8-shRNA组采用靶向敲低SET8基因的shRNA质粒(浓度为2µg/L)转染VSMCs。转染48 h,提取细胞蛋白和mRNA,采用Western blot和PCR检测细胞内p53、Bcl-2、Bax、Caspase3的蛋白和mRNA的表达水平。
1.3茜素红染色 将VSMCs以5×104/孔接种于两个12孔板中,当细胞融合率达70%~80%,一个12孔板给予10 mmol/L β-甘油磷酸刺激,另一个12孔板给予转染刺激培养4 d后,用茜素红染液(pH=8.4,质量浓度为0.1%)对细胞进行钙化染色,置于37℃温箱中放置30 min,于倒置荧光显微镜下观察钙结节染色情况(钙盐沉积为橘红色)并照相。
1.4钙含量测定 取第3代VSMCs以5×104/孔密度接种于两个12孔板中,一个12孔板给予10 mmol/L β-甘油磷酸刺激,另一个12孔板给予转染刺激,细胞刺激4 d后弃上清液,用稀盐酸脱钙24 h,测定上清液中的钙含量,并将脱钙后的细胞用0.1%的SDS与0.1 mol/L NaOH的混合液溶解30 min,测定VSMCs中蛋白质的含量,结果用细胞钙含量与蛋白质含量的比值表示。实验均重复3次。
1.5流式细胞术检测细胞的凋亡 细胞接种于6孔板中,给予高磷刺激,4 d后用冷PBS液洗2遍,根据试剂说明书进行PI/Annexin V双重染色,应用流式细胞仪检测细胞的凋亡率。经PI/Annexin V双重染色后可根据不同区域区分细胞:左下象限PI和Annexin V均为阴性,为活细胞;左上象限PI为阳性、Annexin V为阴性,为死亡细胞;右下象限PI为阴性、Annexin V为阳性,为早期凋亡细胞;右上象限PI为阳性、Annexin V为阳性,为晚期凋亡细胞。实验重复3次。
1.6RT-PCR检测凋亡相关基因的表达 收集各组细胞提取mRNA后逆转录为cDNA。以cDNA为模板,RT-PCR检测SET8、p53、Bcl-2、Bax、Caspase3的表达,以GAPDH 作为内参照。引物序列见表1。反应条件为:预变性95℃5 min;变性95℃ 30 s,退火55℃30 s,延伸72℃ 40 s,循环35次;终末延伸72℃10 min。将产物电泳,收集图像并分析。实验重复3次。
1.7Western blot检测凋亡相关蛋白的表达情况 收集各组细胞提取蛋白,配制10%的SDS-聚丙烯酰胺凝胶,取50µg蛋白进行上样,恒压95 V电泳1.5 h。之后选取PVDF膜进行转膜,恒流200 mA转膜1 h,应用TBST洗膜3次,5%脱脂牛奶封闭1 h。加入一抗稀释液中(SET8 1∶500,p53 1∶1 000,Caspase3 1∶2 000,Bcl-2 1∶1 000,Bax 1∶2 000,GAPDH 1∶5 000),4℃孵育过夜,洗膜,放入二抗(稀释比例1∶5 000)稀释液中,37℃孵育1 h,洗膜后拍照。实验重复3次。
1.8统计学方法 采用SPSS 19.0软件进行统计学处理。计量资料呈正态分布的以均数±标准差(±s)表示,2组间比较采用t检验,多组间的比较采用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。

Tab.1 Primer sequence of each purpose gene表1 各目的基因引物序列
2 结果
2.1高磷对VSMCs钙化的影响 茜素红染色及钙含量测定结果均显示,高磷组钙盐沉积较正常组显著增加,差异有统计学意义(P<0.05),见图1。

Fig.1 The expression of calcification in each group of VSMCs图1 各组VSMCs钙化的表达情况
2.2高磷对VSMCs凋亡的影响 流式细胞仪检测结果显示,高磷组细胞凋亡率明显高于正常组(P<0.05),见图2。

Fig.2 Results of apoptosis in each group of VSMCs图2 各组VSMCs凋亡结果
2.3高磷对VSMCs凋亡相关指标表达的影响 与正常组比较,高磷组SET8、Bcl-2 mRNA和蛋白相对表达量明显降低,p53、Bax、Caspase3 mRNA和蛋白相对表达量明显升高,差异有统计学意义(P<0.05),见图3。
2.4干扰SET8对VSMCs钙化的影响 茜素红染色与钙含量测定结果均显示,与对照组和空质粒组比较,SET8-shRNA组钙盐沉积显著增加,差异有统计学意义(P<0.05),见图4。
2.5干扰SET8基因后对凋亡相关指标表达的影响 与对照组和空质粒组比较,SET8-shRNA组Bcl-2 mRNA和蛋白相对表达量明显降低,p53、Bax、Caspase3 mRNA和蛋白相对表达量明显升高,差异有统计学意义(P<0.05),见图5。
3 讨论
血管钙化是心血管疾病死亡率增高的独立危险因素[4]。血管钙化是由细胞介导的且高度可调的过程,其重要机制有细胞的凋亡、自噬、表型转化等[5]。而VSMCs凋亡是血管钙化发生的重要机制之一[6]。大量研究发现,高磷可诱导VSMCs发生凋亡,是血管钙化重要的危险因素之一[7-8]。因此,寻找高磷因素诱导的血管钙化的机制,对于临床诊治有重要价值。
研究表明高磷可促进VSMCs转分化,进而诱导细胞凋亡[9]。本研究发现,给予高磷刺激后,橘红色钙结节明显增多,钙含量也明显增多,表明高磷促进血管钙化的发生。流式细胞仪检测结果提示,高磷组细胞凋亡率明显升高,提示高磷诱导VSMCs发生了凋亡。高磷组Bcl-2 mRNA和蛋白相对表达量明显降低,p53、Bax、Caspase3 mRNA和蛋白相对表达量明显升高,显示高磷通过调控p53信号通路,抑制Bcl-2表达,促进Bax、Caspase3的表达,进而参与调控VSMCs的钙化。高磷组SET8表达水平降低,提示SET8可能参与了高磷导致的血管钙化。

Fig.3 The expressions of mRNA and protein in each group of VSMCs图3 各组VSMCs mRNA和蛋白的表达
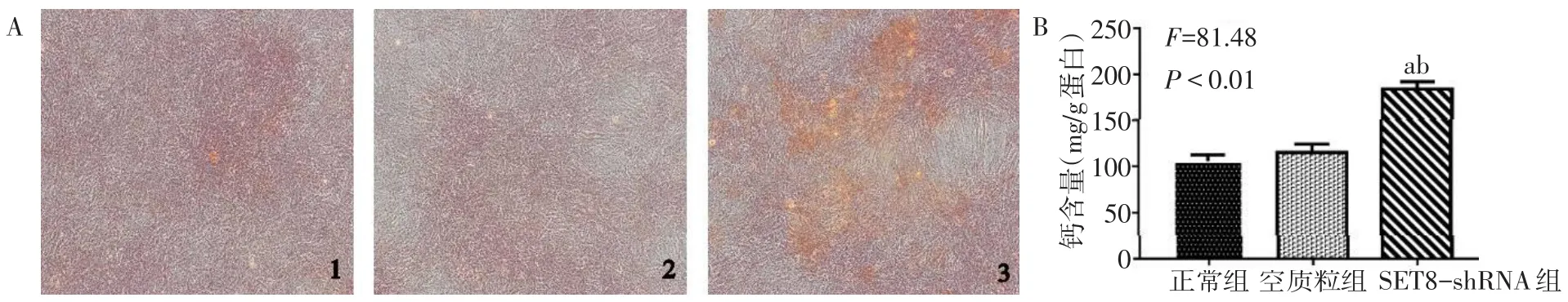
Fig.4 Effects of interfering SET8 on calcification of VSMCs图4 干扰SET8对VSMCs钙化的影响
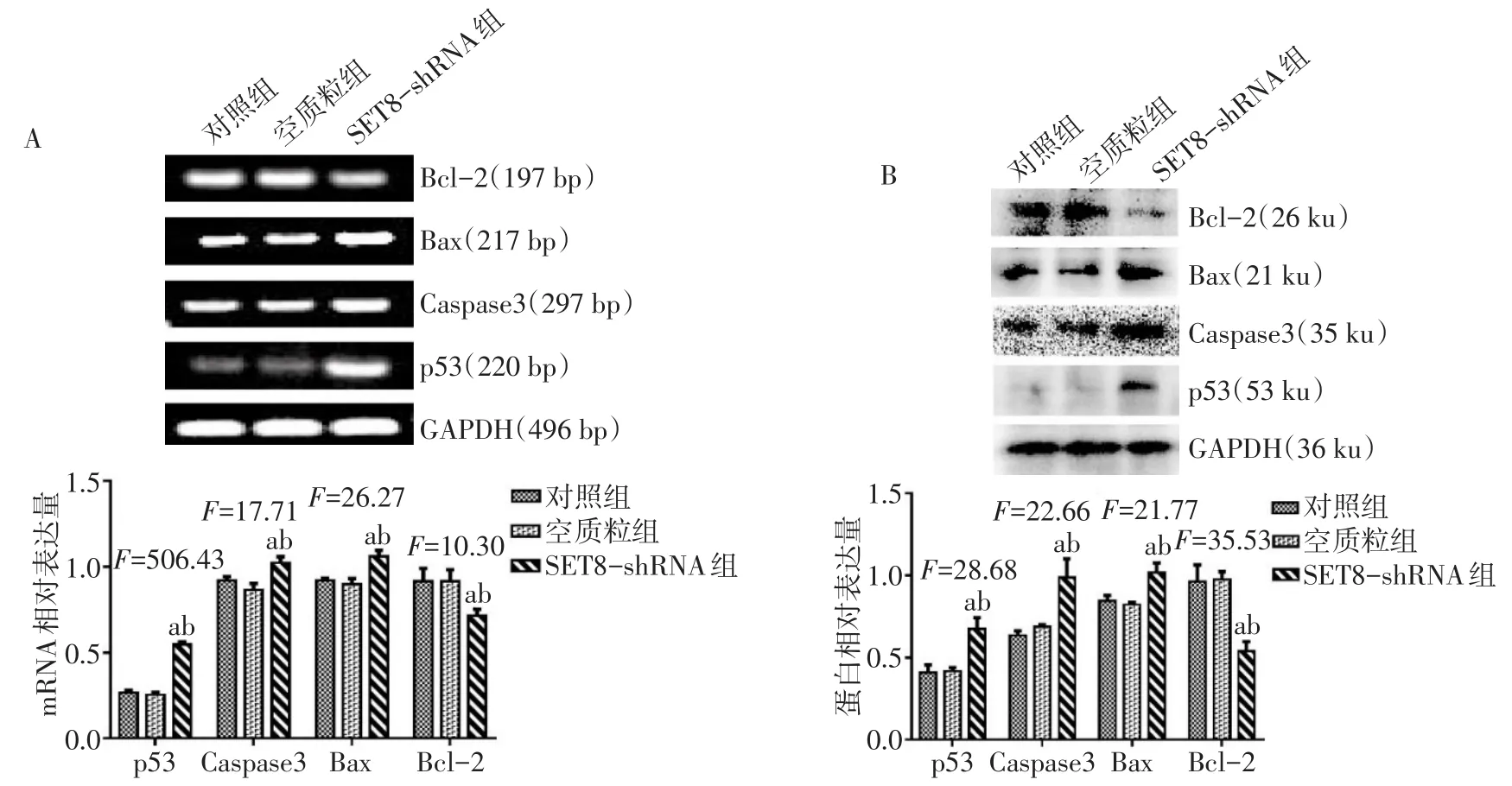
Fig.5 The expression levels of mRNA and protein of p53,Bcl-2,Bax and Caspaste3 in each group of VSMCs图5 各组VSMCs p53、Bcl-2、Bax、Caspase3mRNA和蛋白的表达
SET8是唯一能够特异性催化H4K20单甲基化的赖氨酸甲基转移酶,同时也可甲基化p53、TWIST、Wnt等非组蛋白,并参与细胞转移、增殖、凋亡等多种生物学过程[10]。有研究显示干扰SET8表达可导致肿瘤细胞和血管平滑肌细胞转分化及凋亡[11-12]。抑癌基因p53是SET8最重要的非组蛋白底物,能够调控细胞周期和细胞凋亡[13]。SET8可以特异性单甲基化p53的382赖氨酸位点(p53K382me1),抑制p53靶基因转录,从而抑制细胞凋亡和细胞周期阻滞[14]。Bcl-2和Bax是正负凋亡调节因子,Bcl-2起抗凋亡作用,Bax起促进凋亡作用。Bax的启动子中存在p53的结合位点,p53能促进Bax的表达,而导致细胞凋亡[15]。Bcl-2能够抑制Caspase3的活性,而减少细胞凋亡,进而抑制血管钙化[16]。本研究结果显示,干扰 SET8后 Bcl-2表达下调,p53、Bax、Caspase3表达上调,提示高磷可能通过下调SET8表达,调控p53/Bcl-2/caspase信号通路,下调抗凋亡蛋白Bcl-2表达,上调促凋亡蛋白Bax和Caspase3的表达,从而参与调控VSMCs的钙化和凋亡。
