骨碎补总黄酮通过SDF1/CXCR4信号途径促进小鼠骨髓基质细胞ST-2迁移
2019-11-06吴紫璇郝征郭亚萍张翟轶陈璐瑶彭雁飞郑纺
吴紫璇,郝征,郭亚萍,张翟轶,陈璐瑶,彭雁飞△,郑纺△
全世界范围内因交通事故、工伤、运动创伤或疾病等原因造成的骨缺损、骨折的伤患人数每年高达几百万。由于骨结构的特殊性,即使能够愈合,亦常需要长达几周甚至几个月的固定、限制活动,往往会导致肢体废用性萎缩、关节粘连、褥疮、呼吸及泌尿系感染等多种并发症,极大影响了患者的劳动能力和生活质量。目前临床上多采用骨组织工程学技术来治疗该类疾病,即将体外培养的高浓度种子细胞种植于人工或天然合成的细胞外基质载体上,并复合相关诱导因子,然后移植于体内,从而达到修复骨缺损的目的。然而,近年来研究发现,即使是利用传统组织工程学修复骨缺损也存在着免疫排斥等缺陷[1],因此寻找安全有效的治疗骨缺损方法成为目前骨伤科治疗领域的热点。
骨碎补是骨伤科的常用中药,多用于治疗骨相关疾病,具有很好的疗效。骨碎补总黄酮(assemble flavone of rhizome drynaria,AFRD)是骨碎补的主要有效成分,动物实验证明,AFRD能够提高废用性骨质疏松大鼠的骨组织体积、骨小梁密度和厚度[2]。同时有研究表明,基质细胞衍生因子1/趋化因子受体4(SDF1/CXCR4)信号途径与骨缺损修复和骨形态发生蛋白2(BMP2)诱导的骨髓基质细胞(bone marrow stromal cells,BMSCs)迁移密切相关,能够参与骨缺损部位的骨再生[3]。此外,SDF1/CXCR4信号途径本身也能够促进骨髓基质细胞迁移至受损部位,参与骨缺损修复。然而,骨碎补治疗骨缺损的作用是否与其促进骨髓基质细胞迁移及SDF1/CXCR4信号途径相关,目前鲜有报道。因此,本研究以乙醇超声法从强骨胶囊中获取AFRD,以小鼠骨髓基质细胞系ST-2为研究对象,观察AFRD对ST-2细胞迁移及SDF1/CXCR4信号途径的调节作用,以期为揭示骨碎补治疗骨缺损的作用机制提供研究依据。
1 材料与方法
1.1实验材料 强骨胶囊(主要成分为AFRD,每250 mg强骨胶囊含AFRD不少于180 mg)购自北京岐黄制药公司;α-MEM培养基、胰蛋白酶、胎牛血清(FBS)购自美国Gibco公司;Trizol LS购自美国Invitrogen公司;逆转录试剂盒购自美国Applied Biosystems公司;定量PCR试剂盒购自哈尔滨新海基因检测有限公司;CXCR4抗体、GAPDH抗体购自英国Abcam公司;辣根过氧化物酶(HRP)标记的山羊抗兔、山羊抗鼠抗体购自北京中杉金桥生物技术有限公司。
1.2方法
1.2.1细胞培养 小鼠骨髓基质细胞系ST-2培养于含有10%FBS、100 U/mL青霉素和100 mg/L链霉素的α-MEM培养基中,于在37℃、5%CO2条件下培养。每隔2 d换液1次。待细胞汇合至80%左右时进行传代。
1.2.2CCK-8法检测ST-2细胞增殖 使用0.25%的胰蛋白酶消化ST-2细胞,制成单细胞悬液,以1×105个/mL的密度将细胞接种至96孔板中,而后将细胞放入培养箱内继续培养24 h。分别使用对照试剂DMSO(control)和不同浓度(5、20、50、100 mg/L)的AFRD处理细胞0、24、48和72 h,每种处理设置3个复孔。干预期满后,根据CCK-8试剂盒说明,在每孔培养基中加入10%CCK-8溶液,在培养箱中继续孵育1 h。使用酶标仪检测各孔培养基在450 nm处的光密度(OD)值,评价AFRD对ST-2细胞增殖的影响。
1.2.3Transwell法检测ST-2细胞的迁移 将Transwell小室放置于24孔板中,消化ST-2细胞,以含不同浓度AFRD的无血清培养基重悬细胞,并以5×104个/mL的密度将细胞接种于Transwell上室。在下室中加入含10%FBS的培养基以形成营养梯度,并于37℃、5%CO2培养箱中继续培养24 h。待培养期满后,吸弃Transwell上室中的培养基,并用棉签蘸除上室的细胞,将小室置于4%多聚甲醛中室温下固定1 h,取出小室风干后,使用0.01%的结晶紫染色30 min,用PBS漂洗2次去除浮色。晾干小室后,将其置于倒置显微镜下拍照、计数,使用Image J软件进行细胞计数分析,计算细胞迁移率,迁移率=(24 h穿膜细胞数-0 h穿膜细胞数)/0 h穿膜细胞数×100%,评价不同浓度AFRD对细胞迁移的影响。
1.2.4荧光定量PCR检测SDF1和CXCR4的基因表达 使用不同浓度的AFRD(5、20、50、100 mg/L)干预ST-2细胞48 h,使用细胞提取RNA,逆转录获得cDNA单链,逆转录条件为25℃ 10 min,37℃ 30 min,42℃30 min,85℃5 min。逆转录具体操作步骤按Applied Biosystems公司TaqMan Reverse Transcription Reagents试剂盒说明书进行。以cDNA为模板,GAPDH作为内参基因,荧光定量PCR检测SDF1和CXCR4的mRNA表达。反应条件:95℃预变性10 min;95℃变性10 s,60℃退火10 s,共45个循环。每组设置3个复孔,目的基因相对表达量用2-ΔΔCt计算。荧光定量PCR扩增的基因引物序列见表1。

Tab.1 Amplification of gene primers by fluorescence quantitative PCR表1 荧光定量PCR扩增基因引物序列
1.2.5Western blot检测CXCR4的蛋白表达 不同浓度的AFRD(5、20、50、100 mg/L)干预ST-2细胞72 h后,使用RIPA蛋白裂解液裂解细胞,提取细胞总蛋白并使用BCA蛋白定量法检测浓度。10%SDS-聚丙烯酰胺凝胶电泳分离蛋白,将蛋白转移至PVDF膜上。PBST漂洗后,于5%脱脂牛奶中室温封闭1 h。封闭结束后用PBST漂洗,加入CXCR4一抗(稀释比例1∶2 000),4℃孵育过夜。将膜取出放入PBST溶液中,摇床震荡漂洗3次,每次5 min。加入HRP标记的二抗,室温孵育1 h。孵育结束后使用PBST漂洗3次,每次15 min。加入显影液拍照,以GAPDH为内参。
1.2.6CXCR4抑制剂AMD3100干预实验 使用50 mg/L AMD3100干预ST-2细胞,Transwell实验观察SDF1/CXCR4信号途径阻断后,AFRD对ST-2细胞迁移作用的变化,荧光定量PCR和Western blot检测AFRD对ST-2细胞中SDF1和CXCR4基因表达水平的影响。
1.3统计学方法 使用SPSS 21.0软件进行统计学分析,实验数据采取均数±标准差(±s)表示,组间比较采用单因素方差分析和重复测量资料方差分析,组间多重比较采用Dunnett-t检验及LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1AFRD对ST-2细胞增殖的影响 对于CCK-8法检测结果,经重复测量资料的方差分析,组别(F=26.680,P<0.001)、时间(F=465.780,P<0.001)、组别与时间的交互作用(F=7.785,P<0.001)均有统计学意义,除5 mg/L外,20、50、100 mg/L AFRD处理24、48和72 h,ST-2细胞增殖明显增加,与control组比较差异有统计学意义。见图1。
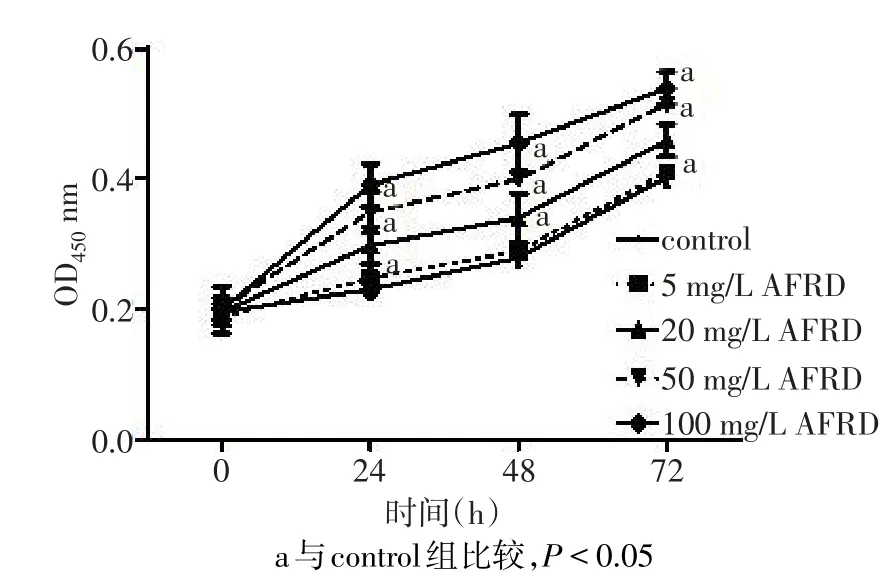
Fig.1 Effects of AFRD on proliferation of ST-2 cells图1 AFRD对ST-2细胞增殖的影响
2.2AFRD对ST-2迁移能力的影响 结果显示,control组与5、20、50、100 AFRD组的ST-2细胞迁移能 力 差 异 有 统 计 学 意 义(n=6,F=229.882,P<0.001)。5、20、50、100 mg/L AFRD干预ST-2细胞24 h后,与control组比较,ST-2细胞的迁移能力明显提高,且随浓度升高而增加,呈现浓度依赖性。见图2。

Fig.2 AFRD promotes the migration of ST-2 cells图2 AFRD促进ST-2细胞迁移
2.3AFRD对SDF1和CXCR4基因表达的影响
2.3.1AFRD对SDF1和CXCR4基因mRNA表达的影响 Control组与5、20、50、100 mg/L AFRD组的SDF1基因的mRNA表达差异有统计学意义(n=6,F=47.696,P<0.001)。与control组相比,5、20、50、100 mg/L AFRD均可明显上调ST-2细胞内SDF1基因的mRNA表达(P<0.05),但各浓度AFRD上调SDF1的作用差异无统计学意义(P>0.05)。各浓度AFRD均可明显上调CXCR4基因的mRNA表达(n=6,F=35.147,P<0.001),且随浓度增加,上调作用越显著,呈现出浓度依赖性,见图3。

Fig.3 Effects of AFRD on mRNA expression of SDF1 and CXCR4图3 AFRD对SDF1和CXCR4 mRNA表达的影响
2.3.2AFRD对CXCR4蛋白表达的影响 结果显示,与control组比较,5、20、50、100 mg/L AFRD明显上调ST-2细胞内CXCR4的蛋白表达(F=13.466,P<0.001),并有随AFRD的浓度增加,上调作用越显著的趋势。见图4。
2.4AMD3100逆转AFRD促ST-2细胞迁移和上调SDF1和CXCR4基因表达 选择促ST-2细胞迁移作用最明显的50 mg/L AFRD进行SDF1/CXCR4通路抑制实验。Transwell实验结果显示,control组、50 mg/L AFRD组、50 mg/L AFRD+AMD3100组的ST-2细胞迁移能力差异有统计学意义(n=6,F=69.642,P<0.001)。与50 mg/L AFRD组比较,CXCR4抑制剂AMD3100干预后,AFRD促进ST-2细胞迁移的作用被抑制(P<0.001),见图5。此外,control组、50 mg/L AFRD组、50 mg/L AFRD+AMD3100组的SDF1和CXCR4 mRNA表达差异有统计学意义(F值分别为224.339、1 428.424,P<0.001),与50 mg/L AFRDz组比较,AMD3100抑制了AFRD对SDF1和CXCR4 mRNA表达的上调作用,见图6。Control组、50 mg/L AFRD组、50 mg/L AFRD+AMD3100组的CXCR4的蛋白表达量的差异有统计学意义(F=5.733,P<0.05),与50 mg/L AFRD比较,AMD3100抑制AFRD对和CXCR4蛋白的上调作用,见图7。

Fig.4 AFRD promoted the protein expression of CXCR4 in ST-2 cells图4 AFRD促进ST-2细胞中CXCR4的蛋白表达
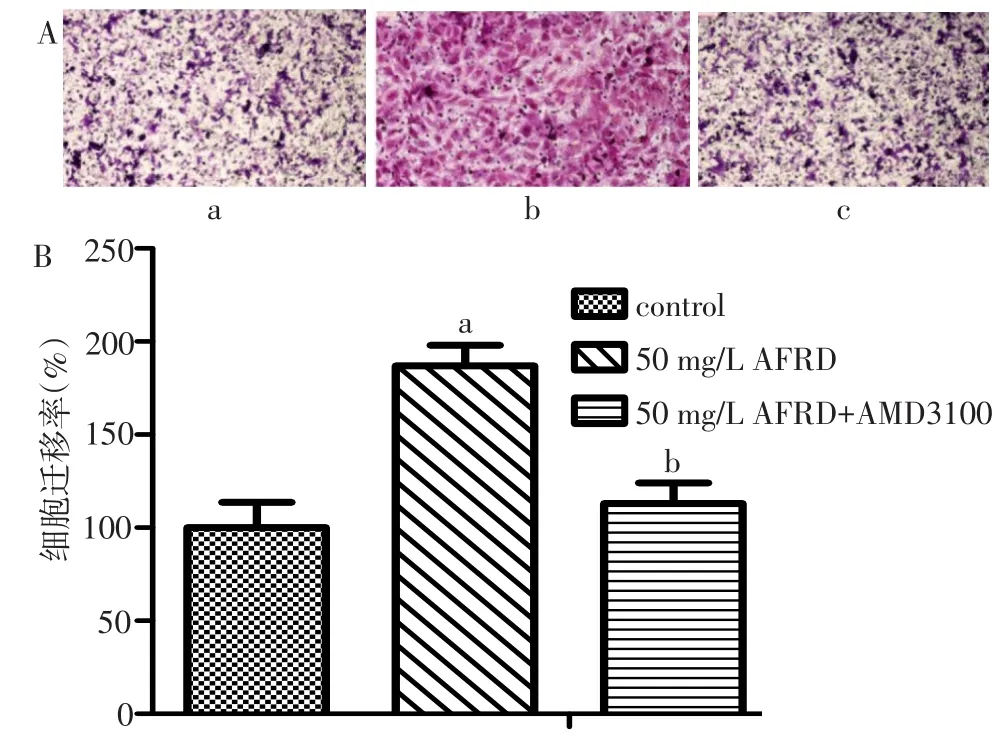
Fig.5 AMD3100 blocked the migration of ST-2 cells induced by AFRD图5 AMD3100阻断AFRD促进ST-2细胞的迁移作用
3 讨论

Fig.6 AMD3100 blocked the up-regulation effect on the mRNA expression of SDF1 and CXCR4 induced by AFRD图6 AMD3100阻断AFRD对SDF1和CXCR4 mRNA表达的上调作用

Fig.7 AMD3100 blocked the up-regulation effect on proteinexpression of CXCR4 induced by AFRD图7 AMD3100阻断AFRD对CXCR4蛋白表达的上调作用
3.1骨髓基质细胞的迁移及调控与骨损伤的关系 骨髓基质细胞是一类成体骨髓中的多能干细胞,能够在适宜诱导条件下分化为成骨细胞、软骨细胞、脂肪细胞和其他几种结缔组织细胞(如腱细胞)等。在发生骨损伤时,尽管骨折断端周围也存在骨髓基质细胞,但仅能满足轻度骨缺损或骨折修复的需要。对于严重或大块的骨缺损,即使植入自体骨、异体骨或组织工程骨,除植骨周围有少量细胞存活外,大部分骨缺损区域内缺乏足够的骨髓基质细胞。显然,骨损伤修复过程中,损伤局部聚集足够数目的骨髓基质细胞是促进骨修复的前提条件和重要的细胞学基础。趋化因子家族及其受体是操控骨髓基质细胞动员和迁移的重要因子。SDF1即CXCL12,属于趋化因子家族中的CXC亚族,主要由骨髓基质细胞合成和分泌,具有强大的趋化作用,其特异性受体CXCR4在许多细胞表面表达。SDF1与其受体CXCR4构成的SDF1/CXCR4信号途径在骨髓基质细胞的动员与定向迁移中发挥了重要作用[4]。发生骨损伤时,SDF1/CXCR4信号途径能够募集骨髓基质细胞趋化迁移到损伤部位,参与骨再生修复。
3.2AFRD治疗骨损伤的具体作用机制尚不明确 《本草新编》记载:骨碎补,味苦,气温,无毒,入骨,用之以补接伤碎最神。归肝、肾经,具有止痛、补肾、强骨的功效,主要用于治疗跌扑闪挫、筋骨折伤、肾虚腰痛、筋骨痿软、牙齿松动等相关病症[5]。临床上骨碎补多用于治疗骨质疏松症及骨缺损等骨科相关疾病,具有很好的疗效[6]。研究报道,大于1 000 mg/L的骨碎补不会引起斑马鱼内脏中毒,2 000 mg/L骨碎补对斑马鱼幼鱼无毒性,这些结果有力证明了骨碎补的安全性[7]。骨碎补总黄酮是骨碎补主要活性成分,药代动力学研究表明,给骨缺损模型鼠灌服骨碎补后,在动物血清中能够检测到包括黄芪苷、柚皮苷、木犀草素-7-o-β-d-葡萄糖苷在内的8种黄酮[8]。体内实验表明,骨碎补总黄酮能够提高股骨干缺损大鼠的骨密度,维持骨微结构的完整程度,有利于骨缺损的恢复;且骨碎补总黄酮的治疗效果优于骨碎补的质控成分——单一黄酮类化合物柚皮苷[9]。另有研究表明,骨碎补总黄酮能够提高大鼠颅骨骨缺损的愈合过程中血Ca、P、碱性磷酸酶(ALP)的浓度,促进缺损部位的愈合[10],但是具体作用机制还不甚明确。有研究发现骨碎补提取物能够促进骨髓基质细胞的成骨分化,并且促进趋化因子CXCL12的分泌[11],提示骨碎补修复骨损伤的作用可能与其促进骨髓基质细胞趋化到损伤部位存在关联,但骨碎补总黄酮能否促进骨髓基质细胞迁移,且该作用是否通过SDF1/CXCR4信号通路介导并不明确。
3.3AFRD可能通过SDF1/CXCR4信号通路介导ST-2细胞迁移修复骨损伤 本研究观察了AFRD对小鼠骨髓基质细胞迁移的影响及SDF1/CXCR4信号途径的调节,发现AFRD能够增强ST-2细胞的迁移能力,且随着AFRD浓度的升高作用逐渐增强,呈现剂量依赖性。同时,AFRD能够促进ST-2细胞内SDF1和CXCR4的基因及CXCR4蛋白表达;而CXCR4抑制剂AMD3100干预后能够抑制AFRD促进ST-2细胞迁移及上调CXCR4基因表达的作用,以上实验证明AFRD促进ST-2细胞迁移的作用可能是通过SDF1/CXCR4信号途径介导的。
综上所述,基于本研究结果,笔者认为AFRD修复骨损伤的作用与其促进骨髓基质细胞迁移至骨缺损部位有关,且这一作用是通过激活SDF1/CXCR4信号途径实现的。当然,除了促进骨髓基质细胞迁移外,AFRD修复骨损伤的作用是否还可能通过其他作用机制发挥作用,包括促进损伤部位血管新生等还有待进一步探讨。
