敲降胰高血糖素基因对胰岛素瘤形成的影响
2019-11-06朱国玲成兰云张恒田浩门秀丽
朱国玲,成兰云,张恒,田浩,门秀丽△
胰岛素瘤是功能性胰腺内分泌肿瘤中最常见的一种,来源于胰岛β细胞[1-2],该肿瘤具有较强的自主分泌胰岛素能力,并且胰岛素的分泌不受低血糖抑制,临床上常表现为反复发作并逐渐加重的低血糖,甚至危及生命[3]。长期低血糖不仅可引起中枢神经系统的抑制症状,并且可诱发大量儿茶酚胺类物质释放入血引起交感神经兴奋症状。因其临床表现复杂多样,极易引起漏诊、误诊和误治[4-5],有报道超过40%的胰岛素瘤病例初诊为神经系统疾病[6-7]。尽管在过去30年胰岛素瘤发生率有明显升高[8],但目前胰岛素瘤仍属于较少见的疑难病症,对其发病机制的了解较少,该类肿瘤的生物学特性尚有待研究。本课题组前期研究发现大鼠胰岛素瘤既表达胰岛素基因,也表达胰高血糖素基因[9],但有关胰高血糖素基因在胰岛素瘤形成中的作用鲜见报道。本研究拟采用本课题组已经成功构建的胰岛素瘤裸鼠模型[9],观察敲降胰高血糖素基因对胰岛素瘤形成的影响,为进一步探讨胰岛素瘤的发病机制提供实验依据。
1 材料与方法
1.1实验材料 (1)细胞。大鼠胰岛素瘤细胞系(INS-1细胞)、大鼠胰岛α细胞系(INR-1G9细胞)、INS-1细胞的单细胞克隆(r9细胞)、人胰岛素瘤细胞、293T细胞、人近端肾小管上皮细胞系(HK-2细胞),上述细胞系均由中日友好医院临床医学研究所娄晋宁教授惠赠。(2)实验动物。nu/nu裸鼠购自北京维通利华实验动物技术有限公司,动物合格证号SCXK(京)2006-0009,6~8周龄,体质量20~25 g,均为雄性,无特定病原体(specific pathogen free,SPF)条件下饲养。(3)主要试剂与仪器。1640培养基、胎牛血清(FCS)均购自美国GIBCO公司,胰蛋白酶、链脲佐菌素、氨苄青霉素均购自美国Sigma公司,葡萄糖购自中国大冢制药有限公司,精氨酸购自上海信谊药业有限公司,去甲肾上腺素、乙酰胆碱(TGI)均购自上海禾丰制药有限公司,胰岛素(insulin)ELISA试剂盒、ECL化学发光试剂均购自美国Millipore公司,胰高血糖素(glucagon)放射免疫分析试剂盒购自中国原子高科股份有限公司,兔抗insulin多克隆抗体、羊抗glucagon多克隆抗体均购自美国Santa Cruz公司,总RNA提取试剂盒、质粒中提试剂盒均购自美国Promega公司,BCA法蛋白测定试剂盒购自碧云天生物技术公司,T4 DNA连接酶购自宝日医生物技术有限公司,HB101化学感受态细胞购自北京鼎国昌盛生物技术有限公司,pLVTHM-shglucagon慢病毒质粒与辅助质粒psPAX2、pMD2.G由中日友好医院临床医学研究所娄晋宁教授惠赠。ELX800自动酶标仪购自美国Bio-Tek公司,紫外凝胶成像系统购自美国Bio-Rad公司,SN-6105γ放射免疫计数器购自上海核所日环光电仪器有限公司,全自动激光共聚焦显微镜1X81购自日本Olympus公司。
1.2细胞培养 INS-1细胞、INR-1G9细胞、r9细胞和人胰岛素瘤细胞用1640培养基(内含10%胎牛血清,青霉素/链霉素1.0×104U/L,5.5 mmol/L葡萄糖,10 mmol/L HEPES,50µmol/L β-巯基乙醇,1 mmol/L丙酮酸钠),其中r9细胞培养时另外添加100 mg/L G418;HK-2细胞用DMEM/F12培养基(内含10%胎牛血清,青霉素/链霉素1.0×104U/L),各种细胞于5%CO2,37℃培养。待细胞生长至融合度为90%时用0.025%胰蛋白酶/EDTA传代。
1.3激光共聚焦显微镜观察INS-1细胞胰岛素和胰高血糖素的表达 将INS-1细胞(1×105/孔)、人胰岛素瘤细胞(5×104/孔)和HK-2细胞(5×104/孔)接种于激光共聚焦专用的培养皿中,72 h后吸去细胞培养液,PBS洗2次,4%多聚甲醛室温固定细胞20 min,PBS洗2次后,用0.1%Triton X-100+0.1%柠檬酸钠冰上通透8 min,PBS洗2次后,0.1%BSA/PBS/Tween 20室温封闭20 min。PBS洗2次,然后用1∶80稀释的兔抗鼠胰岛素抗体4℃孵育过夜。PBS洗2次后,用1∶50稀释的cy3标记的羊抗兔一抗,37℃孵育50 min,PBS洗3次。然后加入1∶80稀释的羊抗鼠胰高血糖素抗体,37℃孵育60 min,PBS洗2次,再加入1∶150稀释的FITC标记的兔抗羊二抗,37℃孵育50 min,用PBS洗3次,激光共聚焦显微镜下观察荧光的强弱并拍照,激发波长488 nm,发射波长520 nm。
1.4胰高血糖素基因敲降
1.4.1pLVTHM-shglucagon慢病毒载体构建 Shglucagon(Gcg glucagon[Rattus norvegicus]Gene ID:24952)质粒由华大基因合成。pLVTHM-shglucagon正义链:5'-CGCGTACTAGTCCCCGGAAGAAGTCGCCATAGCTGATTCA AGAGATCAGCTATGGCGACTTCTTCCTTTTTGGAAAT-3',反义链:5'-CGATTTCCAAAAAGGAAGAAGTCGCCATAGCT GATCTCTTGAATCAGCTATGGCGACTTCTTCCGGGGACTAG TA-3',通过Oligo退火合成shDNA,在T4 DNA连接酶作用下,与退火的DNA oligo于4℃连接16 h,转化大肠杆菌感受态细胞后,送上海生工生物工程股份有限公司进行阳性鉴定。用磷酸钙-DNA共沉淀法共转染至病毒包装细胞HEK-293T,进行慢病毒颗粒的包装。感染前24 h,调整293T细胞密度为2×106/L,接种于T75细胞培养瓶,37℃、5%CO2培养箱内培养,待细胞密度达60%~70%时即可感染。3种质粒[pLVTHM-shglucagon(同时可表达绿色荧光蛋白)20µg、pMD2G 5µg和psPAX2 15µg]按比例混合后用无菌去离子水调到250µL,加入250µL 0.5 mol/L CaCl2混合均匀,然后逐滴缓慢加入500µL 2×HeBS,以最大速度涡旋混匀。实验台上静置30 min,然后稀释到10 mL新鲜培养基中,加入培养瓶,温和振动培养瓶使沉淀物均匀分布到细胞单层上。培养24 h后弃去培养液,加入15 mL新鲜培养液继续培养,分别于转染48 h和72 h后收集细胞上清培养基,4℃,3 000 r/min离心10 min收集上清并用0.45µm微孔滤膜过滤除菌,慢病毒上清分装到5 mL无菌EP管中,-80℃保存,可以直接用于转导目的细胞。同样方法制备仅含绿色荧光蛋白(GFP)报告基因的阴性对照慢病毒载体。
1.4.2慢病毒感染INS-1细胞 将上述分装的慢病毒上清从-80℃冰箱取出,慢病毒上清与目的细胞培养基的混合比例为1∶2或1∶3,转导INS-1细胞4~6 h后更换新鲜培养基。根据感染情况将同时间点的INS-1细胞分为3组:空白对照组,不进行感染,其他培养条件同各感染组;单纯转染慢病毒(N-pLV)组,感染pLVTHM,即只含有GFP;敲降胰高血糖素(N-pLV-G)组,感染pLVTHM-shglucagon。48 h在荧光显微镜下观察目的细胞荧光强弱可以初步判断慢病毒是否感染成功,继续培养至60 d,分别观察30 d、60 d时细胞的荧光强弱变化。
1.4.3RT-PCR检测胰高血糖素基因的表达 将3组细胞以2×105/mL的密度接种于24孔培养板中,每组细胞设置5个复孔,应用正常培养基培养3 d后收集各组细胞,应用Promega试剂盒提取细胞总RNA,并反转录成cDNA。扩增引物委托上海生工生物工程股份有限公司合成。胰高血糖素基因的引物序列:上游5'-GTTTACATCGTGGCTGGATTG-3',下游5'-TGAATTCCTTTGCTGCCTGGC-3',扩增片段 349 bp。参照Promega RT-PCR system试剂盒说明书进行反转录和PCR扩增,50µL反应体系添加0.1µg模板,上、下游引物的终浓度分别为1µmol/L。PCR反应条件:95℃预变性4 min;94℃变性15 s,58℃退火30 s,72℃延伸30 s,共35个循环,72℃延伸3 min。1.5%琼脂糖凝胶电泳,紫外凝胶成像系统扫描采集图像。
1.4.4Western blot检测胰高血糖素蛋白的表达水平 将3组细胞以1×105分别接种6孔培养板,3 d后收集并裂解细胞,提取总蛋白,BCA蛋白浓度测定试剂盒检测总蛋白量。样本经10%SDS-聚丙烯酰胺凝胶电泳(120 V恒压)分离,然后按照200 mA恒流电转移70 min,将蛋白自凝胶转印至PVDF膜。PVDF膜经去离子水清洗后用5%脱脂奶粉室温封闭2 h,然后加入1∶500稀释的羊抗鼠胰高血糖素抗体,4℃孵育过夜,TBST漂洗后用1∶2 000稀释的辣根过氧化物酶标记的抗羊IgG二抗孵育1.5 h,漂洗后用ECL化学发光试剂盒增强发光,X线片显影。利用美国Bio-Rad公司紫外凝胶成像系统对X线片上的条带进行平均光密度(IOD)值测量。以βactin作为内参。实验重复3次。
1.4.5细胞分泌功能的检测 将3组细胞分别种于24孔板,2×106/孔中,每组3个平行孔。培养72 h后,用含2.5 mmol/L葡萄糖(glucose)的培养基平衡5 h,然后用KRBH(Krebs-Ringer bicarbonate HEPES buffer)液洗2次,分别加入2.5、20 mmol/L glucose的KRBH 0.5 mL,并加入抑肽酶使其终浓度为1 mg/L,刺激细胞2 h,收集上清液,用于胰岛素和胰高血糖素测定。胰岛素测定采用ELISA法,胰高血糖素的测定采用放射免疫分析法,均严格按照试剂盒说明书进行操作。
1.4.6MTT法检测细胞的增殖能力 将空白对照组、单纯转染慢病毒组和敲降胰高血糖素组细胞以9×103/孔分别种于96孔板中,用培养液调整每孔终体积为200µL,每个浓度设置6个复孔,分别在培养第0、1、3、5、7天从培养箱中取出培养板测量细胞量,首先轻轻吸出每孔培养液,然后每孔加入浓度为5 g/L的MTT溶液30µL,37℃继续孵育4 h,小心吸去每孔内培养液之后,每孔加入150µL DMSO,轻轻振荡,枪头吹吸混匀,待细胞内结晶紫完全溶解后,在ELX800自动酶标仪设置波长492 nm处读取每孔光密度(OD)值。每个实验重复3次。
1.4.7体内实验 利用本课题组已成功构建的大鼠胰岛素瘤动物模型[9]。首先刮取3组细胞,将其分别移植到裸鼠左肾包膜下,在0、1、2、3、4、5、6周监测血糖变化。实验第45天处死动物,取出双侧肾脏,肉眼观察比较不同组动物肾脏大小并拍照。然后进行免疫组织化学染色。即取部分移植部位肾脏经10%福尔马林液固定后,制备石蜡切片,经常规脱蜡、水化,微波热修复,3%过氧化氢溶液封闭内源性过氧化物酶。一抗分别使用兔抗鼠胰岛素抗体、羊抗鼠胰高血糖素抗体,4℃孵育过夜,二抗使用辣根过氧化物酶标记的羊抗兔IgG抗体或兔抗羊IgG抗体,37℃30 min,二氨基联苯胺(DAB)显色,苏木精复染,脱水、透明封片后镜检,采用Motic Med 6.0数码医学图像分析系统分析免疫组织化学染色样本的IOD值。
1.5统计学方法 数据应用SPSS 17.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验;2组间比较采用t检验;P<0.05为差异有统计学意义。
2 结果
2.1胰岛素瘤细胞的特性分析 激光共聚焦显微镜观察结果显示,INS-1细胞和人胰岛素瘤细胞同时表达胰岛素和胰高血糖素;但作为对照的肾小管上皮细胞HK-2细胞中两者都不表达。见图1。
2.2胰高血糖素在胰岛素瘤形成中的作用
2.2.1INS-1细胞胰高血糖素基因敲降株的建立 pLVTHM与包装质粒共转染293T细胞48 h后,细胞表达较强的GFP(图2A),表明慢病毒包装成功。将包装好的病毒感染INS-1细胞后,INS-1细胞表达GFP(图2B),随着传代培养时间的延长,在30 d(图2C)和60 d(图2D)时检测发现GFP的表达无明显变化,而与单纯转染慢病毒组相比,敲降后INS-1细胞中胰高血糖素mRNA(IOD,0.53±0.14vs.1.37±0.42,t=3.184,P<0.05)和蛋白表达水平(IOD,0.28±0.06vs.0.96±0.12,t=4.351,P<0.05)均明显降低(图3),说明胰高血糖素基因敲降成功。

Fig.1 The expressions of insulin and glucagon in cells of each group(Immunofluorescence staining,×1 500)图1 各组细胞胰岛素和胰高血糖素基因的表达(免疫荧光染色,×1 500)
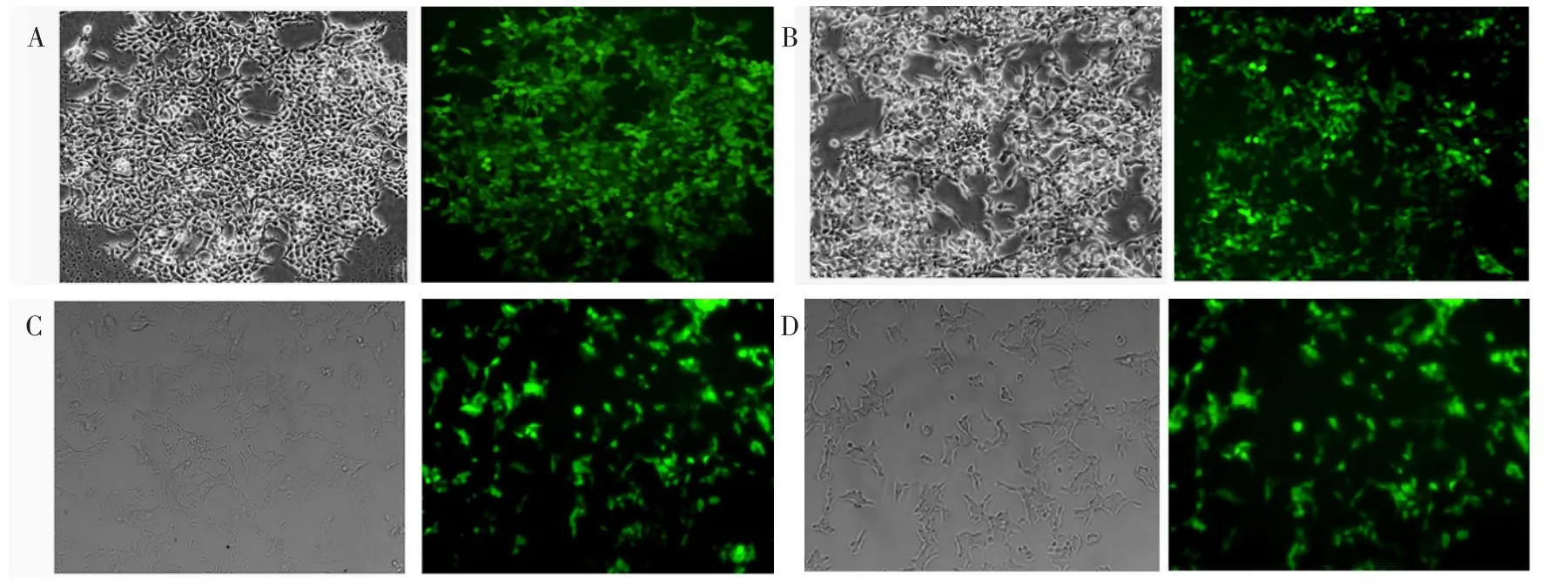
Fig.2 The glucagon gene knock down in INS-1 cells(×200)图2 INS-1细胞中胰高血糖素基因的敲降(×200)

Fig.3 Effects of glucagon gene knockdown on INS-1 cells图3 INS-1细胞胰高血糖素基因的敲降效果
2.2.2敲降胰高血糖素对INS-1细胞分泌功能的影响 敲降INS-1细胞胰高血糖素基因72 h后,3组低浓度(2.5 mmol/L)和高浓度(20 mmol/L)葡糖糖刺激的胰岛素的分泌未见明显变化(P>0.05);敲降胰高血糖素组低浓度、高浓度葡糖糖刺激的胰高血糖素分泌较空白对照组和单纯转染慢病毒组明显降低(P<0.05),见表1。
Tab.1 Effects of glucagon knockdown gene on insulin and glucagon secretion in INS-1 cells stimulated by different concentrations of glucose表1 敲降胰高血糖素基因对不同浓度葡萄糖刺激INS-1细胞胰岛素和胰高血糖素分泌功能的影响 (µg/L,n=3,±s)

Tab.1 Effects of glucagon knockdown gene on insulin and glucagon secretion in INS-1 cells stimulated by different concentrations of glucose表1 敲降胰高血糖素基因对不同浓度葡萄糖刺激INS-1细胞胰岛素和胰高血糖素分泌功能的影响 (µg/L,n=3,±s)
*P<0.05;a与空白对照组比较,b与单纯转染慢病毒组比较,P<0.05
组别空白对照组N-pLV组N-pLV-G组F胰岛素2.5 mmol/L 11.06±1.06 12.29±0.83 11.55±0.88 1.298 20 mmol/L 48.59±2.45 52.09±2.25 55.14±3.87 6.075胰高血糖素2.5 mmol/L 73.45±5.25 78.24±2.50 31.70±1.84ab 158.699*20 mmol/L 694.79±16.85 692.33±12.30 285.57±15.25ab 749.93*
2.2.3敲降胰高血糖素对INS-1细胞增殖能力的影响 MTT结果显示,与空白对照组相比,转染空载慢病毒对细胞增殖能力无明显影响(P>0.05),但敲降胰高血糖素基因可以明显降低INS-1细胞的增殖能力(P<0.05),见图4。
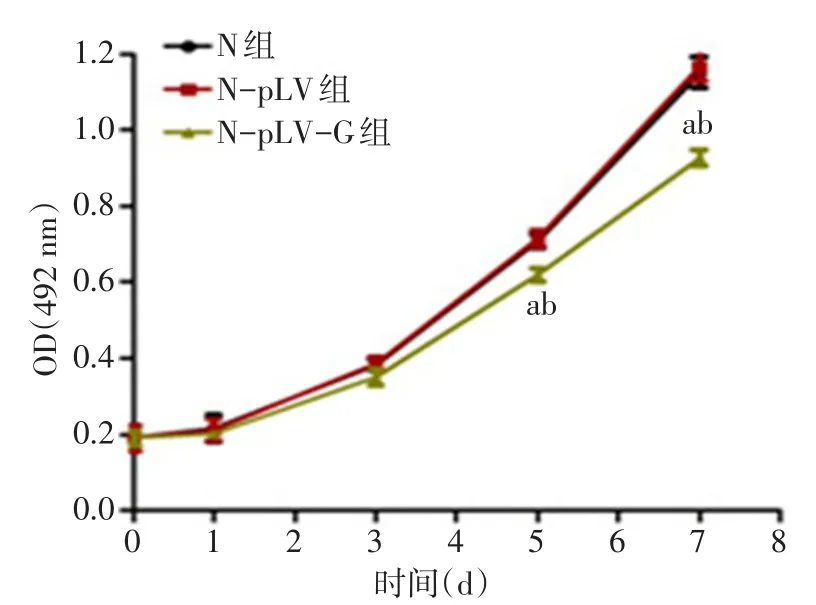
Fig.4 Effects of glucagon knockdown on proliferation of INS-1 cells图4 敲降胰高血糖素对INS-1细胞增殖能力的影响
2.2.4体内移植 3组裸鼠血糖在移植第1、2周时的差异无统计学意义;移植第3、4、5周时,3组血糖逐渐下降,但敲降胰高血糖素组血糖仍高于同时期的空白对照组和单纯转染慢病毒组(P<0.05);至移植第6周时3组血糖差异无统计学意义,见图5。肾脏大体形态观察结果显示,敲降胰高血糖素组肾脏肿瘤较单纯转染慢病毒组有所减小,见图6。免疫组化染色结果显示,与单纯转染慢病毒组相比,敲降胰高血糖素组细胞胰岛素(IOD)的表达未见明显变化(1.67±0.29vs.1.58±0.32,t=0.361,P>0.05),而胰高血糖素(IOD)表达降低(0.43±0.08vs.1.51±0.24,t=7.394,P<0.05),见图7。
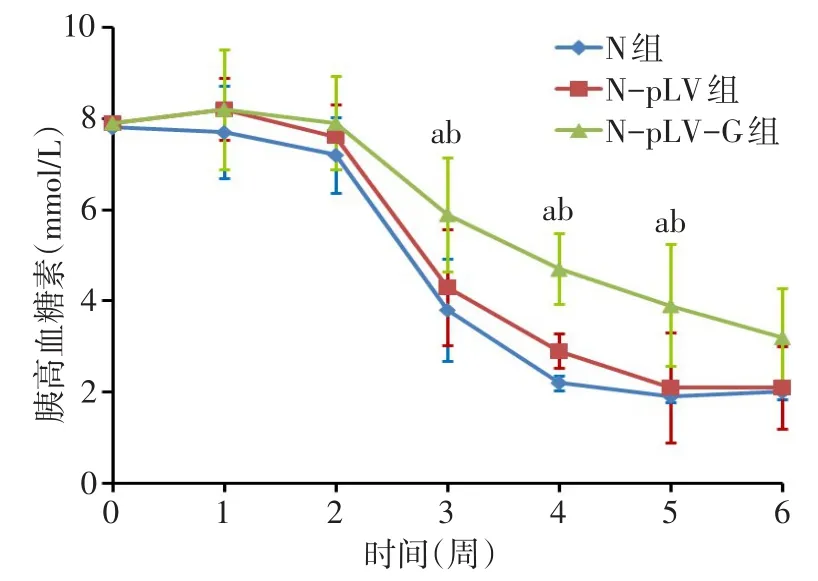
Fig.5 The changes of blood glucose in INS-1 cells after glucagon knockdown and transplanted into the left kidney capsule of nude mice图5 敲降胰高血糖素基因细胞移植到裸鼠左肾包膜下后血糖水平的变化

Fig.6 Tumorigenicity after glucagon knockdown in INS-1 cells and transplanted into the left kidney capsule图6 敲降胰高血糖素基因细胞移植到裸鼠左肾包膜下后的成瘤情况
3 讨论
胰岛素瘤起源于胰岛β细胞,约87%属于良性肿瘤[10],其中具有胰岛素分泌功能的功能性胰岛素瘤约占80%[11],因其过量分泌胰岛素可导致反复低血糖,甚至可引起脑细胞损伤。由于其临床表现复杂多样,临床上极易误诊、误治[4-5],且目前其发病机制尚不明确。
本课题组前期研究发现,大鼠胰岛素瘤细胞系INS-1细胞和人胰岛素瘤细胞既表达胰岛素,同时也表达胰高血糖素[9]。但关于胰高血糖素基因是否影响胰岛素瘤形成的报道较少。有研究显示,正常情况下,胰岛α细胞对胰岛β细胞的存活和胰岛素分泌具有支持作用[12],并且胰高血糖素对胰岛β细胞的增殖和胰岛素分泌也有一定的促进作用[13]。INS-1细胞系来自胰岛β细胞经过放射线照射诱导成的胰岛β细胞瘤,具有胰岛β细胞的绝大部分功能,可对葡萄糖刺激做出反应而分泌大量胰岛素。本研究结果显示,INS-1细胞不仅表达胰岛素而且表达胰高血糖素,与本课题组前期研究结果一致[9]。
为了进一步探讨胰高血糖素基因在胰岛素瘤形成中的作用,本研究利用慢病毒介导的基因敲降系统建立了胰高血糖素敲降的INS-1细胞株。由于基因敲降所使用的载体pLVTHM不仅能在宿主细胞中持续表达shRNA,而且表达GFP,因此本研究利用细胞表达GFP的情况初步判断细胞转染效率。细胞免疫荧光染色、RT-PCR及Western blot结果显示,慢病毒介导的基因敲降系统可明显降低INS-1细胞中胰高血糖素基因的表达水平,并且不随细胞传代和增殖而发生改变,说明本研究成功构建了稳定敲降的胰高血糖素基因的INS-1细胞系。体外实验发现敲降胰高血糖素基因可降低INS-1细胞胰高血糖素的分泌,而对胰岛素分泌功能无明显影响,并且敲降胰高血糖素基因可明显降低INS-1细胞的增殖能力,提示体外敲降胰高血糖素基因可抑制胰岛素瘤细胞的增殖。之后,本研究利用本课题组前期已成功构建的胰岛素瘤动物模型,进一步探讨胰高血糖素基因敲降在动物整体水平上对胰岛素瘤形成的影响[9],该胰岛素瘤模型具有临床胰岛素瘤的特点,适合用于对胰岛素瘤的深入研究。
本研究结果显示,与单纯转染慢病毒组相比,移植敲降胰高血糖素基因细胞的裸鼠血糖下降较慢,形成的肿瘤体积也较小。移植瘤免疫组织化学染色结果显示,敲降胰高血糖素基因细胞移植组裸鼠移植瘤细胞胰岛素的表达未见明显变化,而胰高血糖素表达明显降低,提示敲降胰高血糖素基因可在一定程度上抑制胰岛素瘤细胞的增殖,使肿瘤体积较小,并且能减少胰岛素的释放,使裸鼠血糖下降较慢。笔者推测胰岛素瘤的生长可能与胰高血糖素基因表达水平有关。

Fig.7 Immunohistochemical staining of transplantation site after transplantation of knockdown of glucagon gene cells(×200)图7 敲降胰高血糖素基因细胞移植后移植部位的免疫组化染色(×200)
